Гепатит а геном и белки
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 31 декабря 2018;
проверки требуют 3 правки.
Ви́рус гепати́та B (англ. Hepatitis B virus, HBV) — ДНК-содержащий вирус из семейства гепаднавирусов, возбудитель вирусного гепатита B. В мире по различным оценкам от 3 до 6 % людей инфицировано вирусом гепатита B. Носительство вируса не обязательно сопровождается гепатитом, однако носитель вируса может заражать других людей.
Классификация[править | править код]
Выделяют 10 генотипов вируса: A, B, C, D, E, F, G, H, I и J. Различия между генотипами составляют более 8 %. Генотипы A и D распространены повсеместно; генотипы C и B характерны для Юго-Восточной Азии и Японии. Генотип Е распространен преимущественно в Африке. Генотип F был найден среди коренного населения Южной Америки и на Аляске. Генотип G спорадически встречается в различных частях света, в частности в Соединенных Штатах Америки и во Франции. Генотипы Е и G характеризуются низкой вариабельностью в последовательности нуклеотидов в геноме, по сравнению с другими генотипами.
Генотипы вируса гепатита B могут обладать различными биологическими свойствами. В последнее время все большое значение придаётся генотипу вируса в клинических аспектах течения вирусной инфекции, а также чувствительности к антивирусным препаратам. На сегодняшний день установлено, что инфекция, вызванная вирусом гепатита B генотипов В и С, коррелирует с повреждением печени; а инфекция, обусловленная вирусом гепатита B генотипа А, эффективно излечивается терапевтическими методами с использованием интерферона
Строение вирусной частицы[править | править код]
Вирион (вирус вне клетки хозяина) состоит из нуклеопротеида, капсида и суперкапсида. Капсид — икосаэдр размером 28 нм, внутри которого заключена ДНК вируса (нуклеопротеид). В состав капсида входит основной белок ядра (HBcAg — от «Hepatitis B core Antigen»). Суперкапсид представляет собой липидную мембрану, в которую встроены молекулы белка наружной оболочки — поверхностного антигена (HBsAg — от «Hepatitis B surface Antigen»). Диаметр вирусной частицы — 42 нм.
Строение генома[править | править код]
Геном вируса гепатита B представляет собой одну двуцепочечную кольцевую ДНК длиной около 3200 нуклеотидов (длина генома различна у разных изолятов). Одна из цепей («плюс-цепь») ДНК короче другой (её длина составляет 1700—2800 нуклеотидов). Вторая цепь тоже не является замкнутой и к её 5’-концу ковалентно присоединена молекула полимеразы (P).
В геноме вируса найдено 4 гена: S, С, Р, X, кодирующих соответственно HBsAg, HBcAg, полимеразу и белок-регулятор экспрессии генов. Кроме того, там есть регуляторные последовательности ДНК, ответственные за синтез белков и репликацию вируса. Гены частично перекрываются, что обусловливает малый размер генома.
Отличительной особенностью генома вируса гепатита В является его высокая информационная ёмкость (особенно на фоне того, что его ДНК является наименьшей по размеру среди всех известных ДНК-содержащих вирусов). Это достигается тем, что в молекуле ДНК, заключающей в себе геном данного вируса, имеется 6 перекрывающихся рамок считывания генов[2].
Репликация вируса[править | править код]
Несмотря на то, что вирус гепатита B является ДНК-содержащим вирусом, в его жизненном цикле имеется РНК-стадия. После проникновения вируса в клетку вирусная ДНК перемещается в клеточное ядро и транскрибируется с образованием полноразмерной прегеномной РНК трёх мРНК меньшей длины. Синтезированные РНК перемещаются в цитоплазму, где мРНК транслируются и прегеномная РНК вместе с полимеразой упаковывается в белковую оболочку. Полимераза вируса гепатита B способна осуществлять обратную транскрипцию, и на матрице прегеномной РНК синтезируется вирусная минус-цепь, а на её матрице — плюс-цепь.
Кроме того, геном вируса полностью или частично может интегрироваться в геном гепатоцита. При этом могут повреждаться гены гепатоцита, что приводит к раку печени.[источник не указан 3464 дня] По другим данным, вирус находится в клетке в эписомном состоянии, а онкогенным эффектом обладает белок Х — транскрипционный фактор, рекрутирующий транскрипционную машину клетки для синтеза РНК вируса[3]
Профилактика[править | править код]
Упомянутый выше поверхностный HBsAg-антиген, находящийся в наружной оболочке, применяют для производства высокоэффективной профилактической вакцины.
Примечания[править | править код]
Источник
Вирус гепатита В принадлежит к семейству Hepadnaviridae (гепатотропные ДНК-содержащие вирусы). Зрелый вирус, называемый также частицей Дейна, имеет диаметр 42 нм. Он окружен наружным слоем липопротеинов, под которым находится белковая оболочка, содержащая поверхностный антиген HBjAg, и нуклеокапсидное ядро с ядерным антигеном HBjAg. Нуклеокапсид содержит геном и полимеразу HBV (вирус гепатита В). Помимо зрелого вируса, в сыворотке крови инфицированного человека можно обнаружить две другие, более мелкие вирусные частицы — сферическую и тубулярную диаметром 20 нм. Концентрация мелких частиц в сыворотке крови в 10 ООО раз превышает концентрацию зрелых вирусов. Они состоят из гликопротеиновой оболочки и липидов хозяина. Биологическое значение столь высокой концентрации пустой оболочки не ясно, но полагают, что мелкие вирусные частицы являются «отвлекающим» фактором, позволяющим защитить вирус от иммунной системы хозяина.
Геном HBV (вирус гепатита В) представлен двухцепочечной кольцевой ДНК длиной около 3200 нуклеотидов. Она имеет четыре перекрывающиеся открытые рамки считывания, которые кодируют поверхностный и ядерный антигены, полимеразу и белок HBxAg (ген X). 5′-Конец полной минус-цепи ДНК ковалентно связан с геном, кодирующим полимеразу, в то время как 5′-конец плюс-нити связан с коротким фрагментом кэпи-рованной РНК. 5′-Концы минус- и плюс-цепи ДНК содержат области коротких прямых повторов (длиной 11-12 нуклеотидов), известных как DR1 и DR2. Эти области являются затравочными в процессе синтеза соответствующих им цепей ДНК.
Оболочка HBV (вирус гепатита В) состоит из фосфолипидов клетки и трех кодируемых вирусом белков: малого S {smalt), среднего М (middle) и большого L (large). Область оболочки, занимаемая белками L, М и S, имеет выраженные гидрофобные свойства и называется 5-доменом. L-белок имеет протяженную область, состоящую из 109-120 аминокислот и называемую npe-Sl. М-белок содержит область из 55 аминокислот, обозначаемую как npe-S2. Трансляция этих капсидных белков начинается с трех сайтов в пределах одной открытой рамки считывания и заканчивается общим терминирующим кодоном.
Ген С состоит из двух участков — С (core), кодирующего ядерный антиген HB^Ag, и пре-С, кодирующего антиген Е (HB^Ag). Синтез HB^g «запускается» инициирующим кодоном AUG на участке С, в то время как при синтезе HB_Ag процесс транскрипции продолжается вверх от кодона AUG на пре-С участок. Образующийся слитный белок с молекулярной массой 25 кДа подвергается посттрансляционному процессингу, в ходе которого от него отщепляются два фрагмента и образуется HBEAg с молекулярной массой 16 кДа. Мутации в промоторной области на участках С и пре-С приводят к подавлению экспрессии HBgAg. Недавно выявлены новые мутации в области, предшествующей кодону AUG участка пре-С, которые проявляются подавлением экспрессии HBEAg и ранней сероконверсией у носителей HBV (вирус гепатита В). В эксперименте на животных показано, что HBgAg не влияет существенно на жизнеспособность вируса, и биологическая роль этого антигена в жизненном цикле HBV (вирус гепатита В) окончательно не установлена. Возможно, HBgAg выполняет иммунорегулирующую функцию в организме больного.
Участок, кодирующий полимеразу, специфичен для ДНК вируса гепатита В, о чем будет сказано в следующих разделах.
Ген X кодирует белок НВх с молекулярной массой 16 кДа, обладающий плейотроп-ным свойством. Исследования in vivo показали, что функциональная неполноценность белка НВх приводит к подавлению экспрессии гена С. Это подтверждает гипотезу о том, что усиление экспрессии облигатных генов HBV (вирус гепатита В) — существенная функция белка НВх при гепатите В. НВх играет также важную роль в модулировании передачи клеточного сигнала и активации некоторых клеточных сигнальных путей. В отличие от трансактивации, НВх модулирует процесс репарации ДНК и таким образом участвует в механизме развития рака печени.
Источник
Гепатит А — острое инфекционное заболевание печени, вызываемое вирусом гепатита А (англ. HAV). Заражение HAV может приводить к развитию смертельно опасного молниеносного гепатита (острой печеночной недостаточности). С «болезнью немытых рук» близко знакомы миллионы людей, а вот HAV пока остается одним из самых малоизученных вирусов. Недавно была получена кристаллическая структура этого инфекционного агента. Удивительно, но она оказалась похожей на структуру пикорнаподобных вирусов насекомых. Возможно, эта информация сможет пролить свет как на происхождение HAV, так и на некоторые его загадочные свойства.
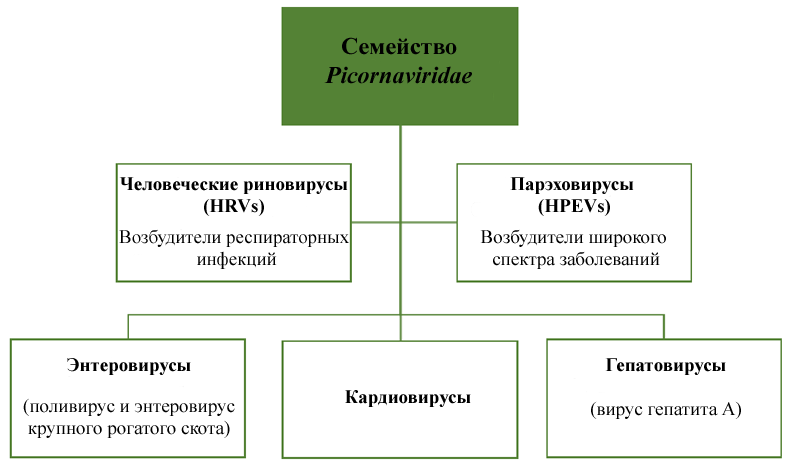
Рисунок 1. Классификация пикорнавирусов.
По данным ВОЗ, в мире ежегодно регистрируется около 1,4 млн случаев заболевания гепатитом А. В основном это удел населения развивающихся стран с неблагополучной санитарной обстановкой и низким уровнем личной гигиены [1]. Но именно в таких странах проживает большинство землян. Почему же до сих пор возбудитель столь распространенной и опасной инфекции не был досконально изучен? Одна из причин — его необычная структура. Вирус гепатита А относится к семейству Picornaviridae. Пикорнавирусы — маленькие икосаэдрические вирусы, у которых нет внешней оболочки, а геном представлен одноцепочечной РНК. К пикорнавирусам относятся одни из самых маленьких известных патогенов человека и животных (рис. 1), в том числе такие привычные нам «простудные» вирусы [2].
Структура пикорнавирусов
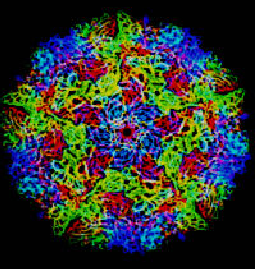
Рисунок 2. Структура энтеровируса крупного рогатого скота. Белок VP1 обозначен синим цветом, VP2 — зеленым, VP3 — красным и VP4 — желтым. Рисунок из [3].
Все вирусы имеют белковую оболочку, предохраняющую их нуклеиновую кислоту от внешних воздействий — капсид (от лат. capsa — вместилище, ящик). Капсид, в свою очередь, состоит из отдельных одинаковых структурных единиц (белков) — капсомеров. Капсид пикорнавирусов имеет шарообразную структуру диаметром 30 нм и состоит из 60 копий каждого из четырех структурных белков — VP1, VP2, VP3 и VP4. Кристаллическая структура пикорнавирусной частицы следующая: белки VP1, VP2 и VP3 состоят из 240–290 аминокислотных остатков; каждый из белков принимает форму восьмицепочечной антипараллельной β-складчатой структуры (так называемая структура «рулет с вареньем» (jelly roll)) (рис. 2). Эти белки образуют наружную поверхность капсида, толщина которого составляет приблизительно 5 нм. Белок VP4 состоит всего лишь из 70 аминокислотных остатков и лежит поперек внутренней поверхности капсида [3]. В итоге капсид пикорнавирусов приобретает форму икосаэдра, или, другими словами, он обладает икосаэдрической симметрией. То есть субъединицы вируса расположены в виде правильного икосаэдра вокруг РНК, скрученной в клубок. Белковые субъединицы (капсомеры) больших икосаэдрических вирусов для сохранения формы сгруппированы в морфологические группы, различимые с помощью электронного микроскопа: это могут быть пентамеры (5 субъединиц) или гексамеры (6 субъединиц), формирующие в капсиде каналы [4, 5]. Структурный белок VP1 образует пентамеры, к которым примыкают белки VP2 и VP3, образующие вершины икосаэдра с трехлучевой симметрией. Между пентамерами и белками VP2 и VP3 образуется углубление, которое называется каньон. В этом каньоне у большинства пикорнавирусов есть так называемый карман — пространство, в которое при упаковке вируса попадает небольшая молекула, обычно некий липид. Этот липид, или «карманный фактор», нужен для того, чтобы стабилизировать капсид вне клетки. Как только вирус связывается с нужным рецептором и попадает в клетку, фактор выходит из кармана, запуская распаковку частицы и делая возможным проникновение РНК в цитоплазму [2].
Сверчок и HAV: связь раскрыта!
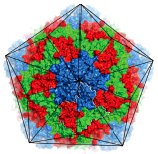
Рисунок 3. Поверхность HAV. Синим цветом обозначен белок VP1, зеленым — VP2, красным — VP3. Черными линиями обозначены границы частицы. Рисунок из [6].
Как выяснила группа ученых из Великобритании и Китая, структура вируса гепатита А отличается от таковой других пикорнавирусов [6]. Внешняя поверхность HAV — гладкая, без углублений (рис. 3). Основные белки капсида — VP1, VP2 и VP3 — формируют восемь антипараллельных β-структур и охватывают всю толщину капсида. В целом, HAV является высокоупорядоченным вирусом, и организация его белковых цепей сходна с таковой других представителей Picornaviridae. Однако ученые нашли несколько отличий. Во-первых, у вируса гепатита А отсутствует типичный для пикорнавирусов «карманный фактор». Вторая тонкая деталь — небольшое изменение в N-конце белка VP2, а именно — небольшое сгибание на границе пентамеров. Это сгибание усиливает взаимодействие одного пентамера с соседним за счет образования дополнительной цепи на VP2-β-структуре. В итоге меняется связность субъединицы: смежные протомеры (полипептидные цепи, являющиеся исходной единицей организации структуры белка) одного пентамера сшиты вместе примыкающим пентамером. Из всех пикорнавирусов такой структурой обладает только вирус гепатита А, однако похожие структуры есть и у пикорнаподобных вирусов насекомых, например, у паралитического вируса сверчка (cricket paralysis virus (CrPV)). Таким образом, некоторые загадочные свойства HAV могут объясняться тем, что этот вирус является связующим звеном между «современными» пикорнавирусами и более «примитивными» предшественниками вирусов насекомых.
Новые факты о HAV
Было обнаружено, что вирусные частицы HAV более устойчивы к физическим и химическим воздействиям, чем частицы других Picornaviridae [6]. Они остаются стабильными при температуре до 80 °С и значениях pH около 2. Можно было бы предположить, что такая устойчивость вызвана изменениями домена VP2 на границе пентамеров, что описывалось выше. Однако, стабильность паралитического вируса сверчка, организованного подобно HAV, ничем не отличается от таковой прочих пикорнавирусов. Дальнейшие исследования показали, что устойчивости частицы HAV способствует состыковка небольших аминокислотных остатков и тирозиновых боковых цепей, прижатых вокруг оси двойной симметрии.
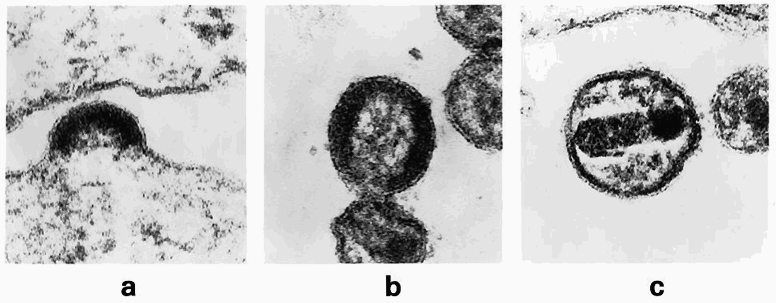
Рисунок 4. Вирусный бадинг на примере вируса иммунодефицита человека (ВИЧ). a — накопление вирусных белков в клетке приводит к «выпячиванию» вируса наружу; b — работа ESCRT приводит к сужению в основании мембранного выступа, что вызывает образование вирусной частицы, содержащей пузырек; c — «почка» отщепляется, оставляя свободным внеклеточный вирион. Фотография предоставлена доктором Matthew Gonda для Wikimedia.
Также HAV отличается от других пикорнавирусов (в частности, энтеровирусов) и механизмом проникновения в клетку-хозяина. Энтеровирусы передают свой геном через поры в мембране эндосомы, формируемые амфипатической (включающей участки с противоположными — гидрофильными и гидрофобными — свойствами) N-концевой спиралью VP1 и белком VP4. Процесс инфицирования состоит из двух шагов: проникновения вирусной частицы и высвобождения ее генома. Первый шаг для HAV хорошо изучен: вирус без изменений попадает в клетку путем трансцитоза (что как раз-таки свойственно пикорнаподобным вирусам насекомых), тогда как второй шаг — высвобождение РНК-генома — остается неясным. Возможно, для разборки вирусной частицы требуются специфические факторы инфицируемой клетки-хозяина. Недавние исследования показали, что HAV содержит тандем мотивов YPX3L, которые связывают ALIX-компонент ESCRT-пути [7]. То есть вирус способен привлекать ESCRT-комплекс, обычно служащий для облегчения высвобождения частиц оболочечных вирусов путем экзоцитоза. ESCRT (endosomal sorting complex required for transport) — совокупность белков, необходимых для мембранных перестроек при формировании выпячиваний и впячиваний. Работая вместе с другими вспомогательными белками, ESCRT включает режим ремоделирования (изменения) мембраны, что приводит к ее изгибанию, отделению от цитоплазмы и дальнейшему «перерезанию» шейки выпячивания. Таким образом происходит выход вируса, или вирусный бадинг (англ. budding — почкование) (рис. 4). ESCRT играет важную роль в ряде клеточных процессов, таких как биогенез мультивезикулярных тел, отделение клеток и попадание вирусов в клетку. Чтобы помочь вирусу гепатита А проникнуть в клетку, белок ALIX связывает и рекрутирует ESCRT-III, компоненты которого участвуют в основных процессах ремоделирования мембраны.
HAV — переходная эволюционная форма
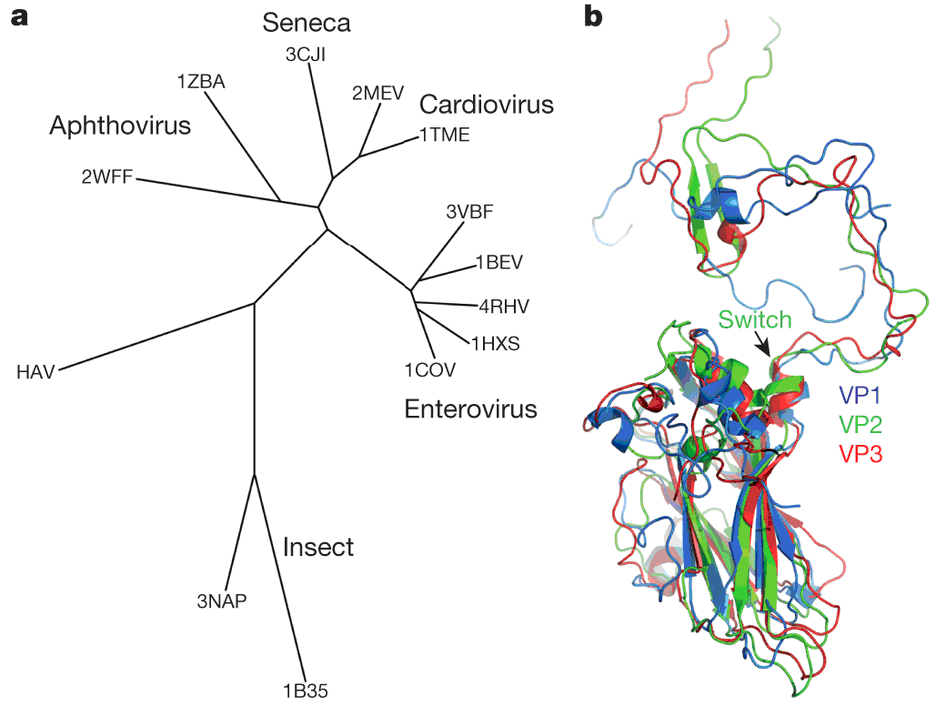
Рисунок 5. Филогения. a — дендрограмма представителей пикорнавирусов и крипавирусов: EV71 — энтеровирус 71, 1BEV — энтеровирус крупного рогатого скота, 4HRV — человеческий риновирус 14, 1HXS — полиовирус 1 типа, 1COV — вирус Коксаки B3, 1TME — вирус Тейлера, 2MEV — вирус менго, 3CJI — Seneca valley virus, 1ZBA — вирус ящура A10, 2WFF — вирус конского ринита А, 3NAP — вирус клопов Triatoma и 1B35 — вирус CrPV, паралитический вирус сверчка; b — суперпозиция (наложение) белков VP1 (синий), VP2 (зеленый) и VP3 (красный) вируса гепатита А. Рисунок из [6].
Таким образом, можно сделать вывод, что HAV обладает тонкими, но глубокими структурными различиями с другими пикорнавирусами. Филогенетический анализ показывает, что HAV связан как с классическими пикорнавирусами, так и с пикорнаподобными вирусами насекомых (рис. 5а). Кроме того, замена N-концевого домена в белке VP2 повышает уровень его гомологии с белками VP1 и VP3 (рис. 5b). Это подтверждает идею о том, что HAV сохранил структурные и функциональные особенности первичных пикорнавирусов, которые были родственны пикорнаподобным вирусам насекомых. Та же замена в белке VP2 позволила вирусу гепатита А приобрести эффективные механизмы внедрения своего генома в клетку, что стимулировало взрывное появление разнообразных форм современных пикорнавирусов млекопитающих.
Полученные знания о кристаллической структуре и происхождении HAV раскрывают широкие перспективы в борьбе с этим вирусом. Например, можно синтезировать препараты, направленные на разрушение структуры вируса. Или, зная, что HAV, как и его предки, попадает в клетки путем трансцитоза, пытаться блокировать этот процесс. Можно сделать лекарства, направленные на разрушение комплекса HAV-ESCRT, и таким образом предотвращать активную репликацию вируса в клетках. Думаю, что исследования в этой области не заставят себя ждать, и скоро мы узнаем о появлении на рынке новых препаратов, способных эффективно бороться с вирусом гепатита А.
- «Гепатит А». (2014). Сайт ВОЗ. Информационный бюллетень N°328;
- Залезть в карман к простуде;
- Ферменты лишают донорскую кровь групповой специфичности;
- Вирусы-платформы: яд во благо;
- «Огуречная» мечта;
- Wang X., Ren J., Gao Q., Hu Z., Sun Y., Li X., Rowlands D.J., Yin W., Wang J., Stuart D.I., Rao Z., Fry E.E. (2015). Hepatitis A virus and the origins of picornaviruses. Nature. 517, 85–88;;
- Feng Z., Hensley L., McKnight K.L., Hu F., Madden V., Ping L. et al. (2013). A pathogenic picornavirus acquires a nenvelope by hijacking cellular membranes. Nature. 496, 367–371..
Источник

