Гепатит с у гематологических больных
Диагностика гепатитов В и С у гематологических больных — анализы, особенности
Современная этиологическая диагностика вирусных гепатитов основана на обнаружении специфических маркеров соответствующих вирусов. Один из методов их выявления — тестирование различных антигенов вируса и антител к ним в ИФА. Наиболее прогрессивна и информативна так называемая генная диагностика: обнаружение вирусной РНК или ДНК с помощью ПЦР.
Для диагностики гепатита В в ИФА исследуют:
1) HBsAg-поверхностный антиген гепатита В, ранее называвшийся австралийским. Он указывает на факт инфицированности гепатитом В;
2) HbeAg — антиген инфекционности, свидетельствующий об активной вирусной репликации;
3) анти-НВс —антитела к ядерному антигену вируса гепатита В: класса IgM—ранние антитела острого периода, класса IgG—поздние антитела к ядерному антигену;
4) анти-НВе — антитела к HBeAg, чаще всего характеризующие прекращение активной репликации вируса (так называемая сероконверсия);
5) анти-HBs—антитела к HBsAg, обеспечивающие протективный иммунитет.
С помощью ПЦР для диагностики гепатита В тестируют ДНК вируса гепатита В — основного маркера репликации вируса.
Для диагностики гепатита С исследуют:
1) с помощью ИФА наличие анти-HCV-антител к вирусу гепатита С (для их выявления желательно использовать тест-системы второго — третьего поколения, отличающиеся большей специфичностью). Они указывают только на инфицированность вирусом гепатита С;
2) с помощью ПЦР наличие РНК вируса гепатита С — основного маркера репликации вируса.
Говоря о специфической диагностике гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями (ОГЗ), следует рассмотреть вопрос о применимости стандартных подходов к выявлению различных маркеров этих вирусов у данного контингента в связи с возможным нарушением процесса антителообразования на фоне глубокой иммуносу-прессии, развивающейся в ходе полихимиотерапии (ПХТ).
Исследования, в которых сделана попытка подтвердить или опровергнуть роль антительных маркеров у пациентов с онкологическими гематологическими заболеваниями, пока единичны.
Так, в отдельных работах сообщается, что при гепатите В иммуносупрессия нарушает обычную последовательность обнаружения в сыворотке крови антигенов и антител: у больных, которые до начала ПХТ были анти-НВs-позитивными, в процессе лечения могут вновь определяться HBsAg и HBeAg, свидетельствуя о несостоятельности анти-HBs в качестве протективных антител. Угнетение механизмов, ограничивающих вирусную репликацию, ведет к тому, что виремия нередко достигает высокого уровня.
Если антитела к столбняку, дифтерии и полиомиелиту сохраняются во время и после ПХТ, то титры антител к вирусам (ветряной оспы, кори и гепатита В) резко снижаются. Это в большей мере относится к детям с лейкозами, чем с солидными опухолями. Снижение или отсутствие выработки анти-HBs отметили также R. Repp и соавт. и R. Rokicka-Milewska и соавт.. Если при гепатите В эта особенность может отразиться только на ретроспективной диагностике, то для распознавания гепатита С, основанного чаще всего на обнаружении анти-HCV с помощью ИФА, такое положение может иметь принципиальное значение, препятствуя полному и своевременному выявлению всех инфицированных.
Антитела к вирусу гепатита С (анти-HCV) вообще образуются медленно, в течение 8—15 нед от момента инфицирования, но у иммунокомпетентных лиц персистируют в организме длительно и в большинстве случаев пригодны для выявления гепатита С, являясь в настоящее время рутинным и скрининговым маркером.
Некоторые авторы, проводившие немногочисленные и небольшие по объему исследования у иммунокомпрометированных пациентов, указывают на возможность отсроченного образования антител к вирусу гепатита С и считают недостаточным использование только ИФА для диагностики данного заболевания у этого контингента пациентов. В частности, С. Cornu и соавт. обнаружили, что у 5 из 6 обследованных ими иммунокомпрометированных пациентов анти-HCV начали обнаруживаться лишь спустя 14 мес и более от момента инфицирования, установленного с помощью ПЦР.
По данным М. Arico и соавт., антительная диагностика позволяет выявить около 70 % детей с ОЛЛ, инфицированных вирусом гепатита С. Значение ПЦР в выявлении пациентов, инфицированных вирусами гепатитов В и С, продемонстрировано при обследовании турецких детей: у 13,9 % больных с онкологическими гематологическими заболеваниями диагноз гепатита В установлен только при обнаружении ДНК вируса гепатита В, а 5,8 % анти-HCV-негативных детей оказались инфицированными вирусом гепатита С при тестировании РНК.
По нашим данным, на фоне онкологического гематологического заболевания нарушены естественные соотношения и последовательность появления специфических антигенов и антител, что значительно затрудняет диагностику гепатитов В и С у этих пациентов. Так, при гепатите В маркерный спектр отличается своеобразной «извращенностью»: в первые дни и недели обнаруживают больше антител, в том числе анти-HBs (возможно, донорского происхождения), которые элиминируются в период завершения ПХТ, сменяясь маркерами активной вирусной репликации, сосуществующими с анти-HBs.
В то же время синтез анти-НВс IgM, сопутствующий в иммунокомпетентном организме вирусной репликации и являющийся одним из ее маркеров, у пациентов с онкологическими гематологическими заболеваниями почти отсутствует, а у пациентов без онкологических гематологических заболеваний происходит их активная наработка (7,7 % против 78,6 %).
С общебиологической точки зрения, выявленные феномены ждут объяснения, а в прикладном плане они демонстрируют особенности специфической диагностики инфицированности вирусом гепатита В у больных с онкологическими гематологическими заболеваниями и необходимость поиска других подходов к распознаванию болезни. Этой цели служит использование ПЦР, которая позволяет существенно повысить выявляемость пациентов с онкологическими гематологическими заболеваниями, инфицированных вирусом гепатита В: в 16 % случаев обнаружение ДНК этого вируса было единственным маркером инфицирования.
Более того, у 50 % детей, находившихся на полихимиотерапии и позитивных по каким-либо маркерам вируса гепатита В, вирусная ДНК выявлялась в отсутствие HBeAg, т. е. была единственным показателем репликации вируса, в то время как среди детей без онкологических гематологических заболеваний подобная ситуация встречалась лишь в 14,5 % случаев, т. е. в 3,5 раза реже.
При гепатите С также не обнаружено параллелизма между выявлением анти-HCV и РНК вируса гепатита С. Весьма демонстративным было преимущество тестирования РНК перед антительной диагностикой: у 44,4 % детей с онкологическими гематологическими заболеваниями РНК вируса гепатита С оказалась единственным маркером инфицирования.
Как и при гепатите В, диагностическая значимость генных и антительных маркеров зависит от фазы ПХТ. Период интенсивного и поддерживающего лечения онкологического гематологического заболевания при гепатите С — это время абсолютной репликативной активности и резкого снижения антителообразования, способность к которому частично восстанавливается по завершении полихимиотерапии. В наших наблюдениях у 74,9 % детей это сопровождалось продолжением вирусной репликации.
Практические выводы о специфической диагностике гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями сводятся к следующему:
1) рутинные подходы недостаточны для распознавания инфицированности пациентов с онкологическими гематологическими заболеваниями вирусами гепатитов В и С;
2) необходимо комплексное исследование всего известного спектра маркеров;
3) ведущую, определяющую роль в диагностике гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями играет тестирование ДНК вируса гепатита В и РНК вируса гепатита С в ПЦР;
4) только путем внедрения ПЦР-диагностики в учреждениях для больных с онкологическими гематологическими заболеваниями можно обеспечить полную и своевременную диагностику гепатитов В и С;
5) обязательность обследования всех пациентов с помощью современных маркеров:
— при поступлении;
— при повышении активности АЛТ на этапах ПХТ;
— каждые 3—6 мес в ходе и в течение года после ПХТ.
— Также рекомендуем «Клиника гепатитов В и С у гематологических больных — динамика анализов»
Далее рекомендуем для ознакомления следующие статьи:
- Поражения вирусом простого герпеса (ВПГ) гематологических больных — эпидемиология, частота
- Клиника и диагностика поражений вирусом простого герпеса при иммунодефиците
- Лечение поражений вирусом простого герпеса. Профилактика реактивации вируса
- Поражения вирусом ветряной оспы у гематологических больных (VZV-инфекции) — диагностика, лечение
- Поражения вирусом Эпштейна-Барр гематологических больных — диагностика, лечение
- Поражения вирусом герпеса типа 6 гематологических больных — диагностика, лечение
- Распространенность гепатита В и С у гематологических больных — эпидемиология
- Диагностика гепатитов В и С у гематологических больных — анализы, особенности
- Клиника гепатитов В и С у гематологических больных — динамика анализов
- Течение гепатитов В и С у гематологических больных — критерии оценки
Источник
Профилактика гепатитов В и С у гематологических больныхВ профилактике гепатитов В и С при онкологических гематологических заболеваниях существуют два основных направления. Первое — это тестирование высокочувствительными методами на маркеры этих гепатитов препаратов донорской крови. В развитых странах в отношении гепатита В эта проблема решена уже в прошлом десятилетии, в отношении гепатита С успешно решается. Эффективность подобной профилактики достаточно высока. Так, по данным J. Lopez-Jimenez, в период отсутствия систематического тестирования донорской крови на анти-HCV с помощью ИФА вероятность инфицирования пациентов онкологического гематологического заболевания составляла 42 %, а с 1989 г., после введения тестирования, снизилась до 12,5 % несмотря на возросшую трансфузионную нагрузку. В Японии тестирование доноров на анти-HCV и РНК привело к заметному снижению риска инфицированности вирусом гепатита С при ТКМ (ни у одного из 6 пациентов и у 7 из 11 до введения тестирования). Второе направление профилактики вирусных гепатитов у пациентов с онкологическими гематологическими заболеваниями заключается в вакцинации, которая в отношении гепатита В в настоящее время приоритетна. Однако эффективность вакцинации, многократно доказанная применительно к обычным пациентам, у больных с онкологическими гематологическими заболеваниями проблематична. Глубокая иммуносупрессия, развивающаяся в период ПХТ, приводит к значительному снижению антительного ответа на вакцинацию или даже к его отсутствию. Немногие исследователи, занимавшиеся этой проблемой, приходят к неутешительному выводу о неэффективности вакцинопрофилактики гепатита В на фоне ПХТ. По данным R. Rokicka-Milewska и соавт., использовавших вакцину Энджерикс-В у детей с лейкозами и лимфомами, после завершения ПХТ вакцинация у 88 % из них была эффективной. Из 18 больных, находившихся на поддерживающей терапии, ни у одного не отмечено выработки антител. По данным D. Ridgway и нашим наблюдениям, на фоне интесивной ПХТ из крови исчезают уже имевшиеся анти-HBs, а циркулирующие не оказывают протективного действия. В этой ситуации рекомендуется введение двойных доз вакцины (например, 40 мкг взрослым и 20 мкг детям) 4 раза по схеме: 0—1—2—6 мес, однако и эта мера не всегда эффективна. Имеются сообщения об эффективности пассивной иммунизации против гепатита В специфическим иммуноглобулином. Частота гепатита В среди 285 детей с лимфопролиферативными заболеваниями и солидными опухолями составила 10,2 % в группе вакцинированных специфическим иммуноглобулином и 36,8 % в группе не получавших его. Эти единичные сообщения позволяют наметить пути достижения успеха. В последние годы на основе более широких исследований эти пути изучаются и высказываются более оптимистические взгляды на проблему. Так, польские исследователи наблюдали 1242 человека: 558 детей с онкологическими гематологическими заболеваниями и солидными опухолями, 193 их родственника, 302 человека ухаживающего персонала и 189 здоровых детей (контроль). Для профилактики инфицирования вирусами гепатитов В и С проводили комплекс мероприятий, включавший пассивно-активную профилактику гепатита В (вакцинация + введение специфических антител) перед началом ПХТ, интенсификацию неспецифической профилактики, специальные образовательные программы для родственников пациентов и ухаживающего персонала. В результате через 1,5—4 года протективным иммунитетом к гепатиту В обладали 62,9 % пациентов, инфицированность вирусом гепатита С снизилась на 2,8 %, 0,5 % родственников оказались инфицированными, а персонал остался здоровым. Авторы считают такой подход к профилактике гепатитов В и С перспективным, снижающим риск распространения инфекции. Таким образом, в условиях значительного прогресса в лечении онкологических гематологических заболеваний гепатиты В и С представляют собой проблему, значение которой все более возрастает. В силу высокой трансфузионной нагрузки, токсического поражения паренхиматозных органов (в первую очередь печени) и глубокой иммуносупрессии, связанных с необходимостью проведения ПХТ, гепатиты В и С на фоне онкологического гематологического заболевания отличаются своеобразием распространения, диагностики, клинического течения, подходов к лечению и профилактике. 1. Распространенность гепатитов В и С среди пациентов с онкологическими гематологическими заболеваниями велика и варьирует в широких пределах: гепатита В — от 0 до 47,4 % , гепатита С — от 1 до 43 % . 2. Специфическая серологическая диагностика гепатитов В и С осложнена несостоятельностью образования и протективных свойств противовирусных антител, в связи с чем в распознавании этих заболеваний первостепенное значение приобретают не маркеры-антитела, а определение генетического материала вирусов с помощью ПЦР (ДНК вируса гепатита В и РНК вируса гепатита С). Они же выдвигаются на первый план при суждении о наличии и степени виремии. 3. Клинические проявления гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями отличаются значительным своеобразием: 4. Данные о лечении гепатитов В и С, в частности ИФН-а, у больных с онкологическим гематологическим заболеванием немногочисленны и противоречивы. Не разработаны показания к терапии ИФН-а, дозы, схемы, соотношения характера и фазы полихимиотерапии. В качестве предварительной рекомендации при гепатите С может быть предложена стартовая доза ИФН-а 3 000 000 МЕ/м2 3 раза в неделю, при гепатите В — 5 000 000 МЕ/м2 3 раза в неделю в течение 6—12 мес под контролем активности АЛТ, содержания РНК и ДНК вирусов в ПЦР и состава крови (число тромбоцитов, нейтрофилов, лимфоцитов). 5. В период интенсивной полихимиотерапии следует назначать гепатопротекторы (гептрал). Обязательным компонентом патогенетической терапии является длительное (6—12 мес) применение препаратов УДХК (урсосан и др.), особенно при хроническом гепатите С. 6. В профилактике гепатитов В и С у больных с онкологическим гематологическим заболеванием первостепенную роль играет тестирование донорской крови и ее дериватов на наличие специфических маркеров вирусов этих гепатитов. Вакцинопрофилактика у этого контингента больных проблематична: на фоне полихимиотерапии она недостаточно эффективна, после нее нередко оказывается запоздалой, однако поиски в этом направлении необходимо продолжить. — Также рекомендуем «Шок у гематологических больных — диагностика, лечение» Далее рекомендуем для ознакомления следующие статьи:
|
Источник
Лечение гепатитов В и С у гематологических больных — схемы ИФН-терапии
Лечение пациентов с онкологическими гематологическими заболеваниями, больных гепатитами В и С, представляет задачу повышенной сложности. Необходимость учета фазы лечения основного заболевания осложняет ситуацию.
Реализация основного современного принципа этиотропной противовирусной терапии хронических гепатитов В и С (снижение вирусной нагрузки вплоть до элиминации возбудителя или как минимум прекращение его активной репликации) становится возможной лишь в период поддерживающей ПХТ или по ее окончании.
Основу современного лечения хронических гепатитов В и С составляет парентеральное применение препаратов интерферона (роферон А и др.). Адаптация терапии интерферонами (ИФН) к лечению вирусных гепатитов на фоне онкологических гематологических заболеваний, разработка показаний, коррекция доз, схем, времени начала и длительности введения ИФН представляют собой важнейшую, но еще нерешенную задачу.
Общепринятые показания к назначению препаратов ИФН пациентам без онкологических гематологических заболеваний:
• обнаружение маркеров вирусной репликации с помощью ПЦР (ДНК ВГВ и РНК ВГС);
• повышение активности АЛТ в 1,5—2 раза и более;
• наличие некровоспалительных изменений и фиброза в пунктате печени.
Противопоказания к ИФН-терапии
Абсолютные:
• психозы, эписиндром (в том числе и в анамнезе);
• выраженная нейтро- и тромбоцитопения (менее 2 • 109/л и 100 • 109/л соответственно);
• декомпенсированный цирроз печени.
Относительные:
• возраст до 2 лет;
• декомпенсированный диабет;
• аутоиммунные заболевания.
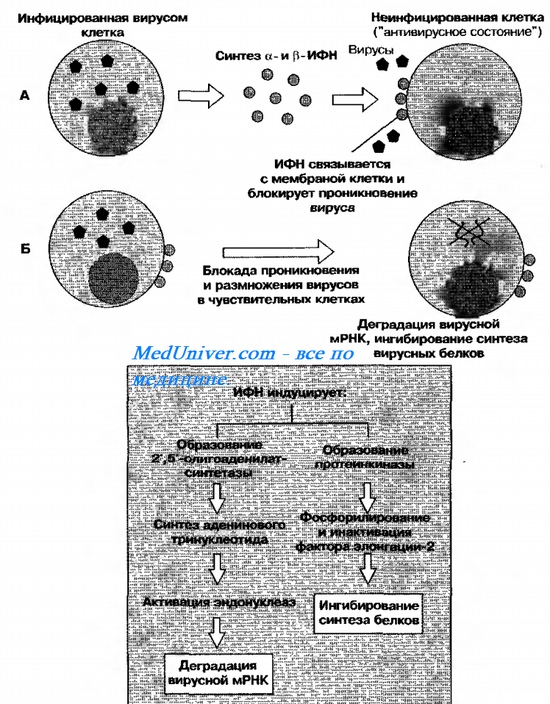
Механизмы антивирусного действия ИФН I.
A — в неинфицированных вирусом клетках ИФН вызывает развитие «антивирусного состояния», блокируя проникновение в них вирусов.
Б — после проникновения вируса в клетки, обработанные ИФН, вирусная РНК индуцирует образование РНК-проте-инкиназы. Фермент аутофосфорилируется, а затем фосфорилирует фактор элонгации 2, нарушая сборку белковой молекулы. Двухнитевая вирусная РНК индуцирует синтез 2’5′-олигоаденилатсинтетазы, катализирующей образование аденинового тринуклеотида с уникальными 2’5′-фосфодиэфирными связями. Последний активирует латентные эндонуклеазы, разрушающую вирусные мРНК.
Перед назначением ИФН-терапии врач должен учитывать так называемые предикторы эффективности:
— небольшая продолжительность болезни (от момента предполагаемого инфицирования) — до 3—5 лет;
— повышенная исходная активность трансаминаз;
— низкая вирусная нагрузка (по результатам количественной ПЦР менее 2 000 000 копий в 1 мл);
— «дикий» (НВе-позитивный) штамм ВГВ и «не-1-й» генотип ВГС;
— отсутствие иммуносупрессии.
К сожалению, у пациентов с онкологическими гематологическими заболеваниями набор предикторов априорно, как правило, неблагоприятен. Уже отмечались преобладание невысокой или нормальной активности АЛТ, высокая вирусная нагрузка, заведомое присутствие иммуносупрессии и нередко позднее распознавание гепатита в связи с бессимптомным течением.
Стандартные режимы ИФН-терапии у пациентов без онкологических гематологических заболеваний:
— хронический гепатит В: подкожное или внутримышечное введение по 5 000 000 МЕ/м2 3 раза в неделю в течение 6 мес;
— хронический гепатит С: по 3 000 000 МЕ/м2 3 раза в неделю в течение 12 мес.
По рассмотренным ранее причинам эти режимы ИФН-терапии нередко «не работают» у пациентов с онкологическими гематологическими заболеваниями. Эффективность ИФН-терапии у детей с онкологическими гематологическими заболеваниями в 1,5-2 раза ниже: 20-25 % против 45-47 %. У взрослых ответ на терапию наблюдается еще реже — до 8 % при 1b-генотипе.
Согласно нашему опыту, у этого контингента требуется определенная коррекция ИФН-терапии хронических гепатитов В и С: некоторое расширение показаний и интенсификация режимов лечения (последняя возможна только по окончании ПХТ).
1. Нормальные показатели АЛТ при высокой вирусной нагрузке не исключают необходимости ИФН-терапии, так как могут не отражать истинной активности процесса, а быть проявлением ареактивности.
2. Интенсификация режимов ИФН-терапии различными путями:
— увеличение дозы за счет ежедневного введения препарата в течение первых 4—6 нед и даже месяцев лечения;
— удлинение курса терапии (до 12 мес при хроническом гепатите В);
— комбинация двух противовирусных препаратов уже при назначении первичного курса лечения;
— обязательное применение патогенетической гепатозащитной терапии.
Два последних метода коррекции терапии рассматриваются далее.
Необходимость интенсификации ИФН-терапии требует, особенно у детей, максимально щадящего подхода к способу введения препарата. Этому в настоящее время наиболее полно отвечает новая форма — роферонпен (так называемая ручка), так как минимальный инъекционный объем и размер иглы значительно снижают болевые ощущения и наименее травматичны.
Кроме того, интенсификация режимов лечения и особенности контингента больных требуют от врача особенно пристального внимания к побочным эффектам ИФН-терапии.
Побочные реакции лечения ИФН качественно не отличаются от приводимых в литературе у пациентов без онкологических гематологических заболеваний. К побочным эффектам относятся следующие:
— гриппоподобный синдром (повышение температуры тела до 38—40 °С, озноб, головная боль, миалгии и др.), встречающийся почти у 100 % детей и 60—80 % взрослых после первых 3—5 инъекций, затем постепенно затухающий;
— нарушение функций ЦНС (слабость, утомляемость, лабильность настроения) у 15—45 % больных. У 10—25 % взрослых пациентов возникает депрессия, у детей, напротив, отмечаются повышенная возбудимость, раздражительность, двигательные нарушения вплоть до судорог;
— нарушения фунций органов желудочно-кишечного тракта (снижение аппетита, анорексия, снижение массы тела у 10—30 % больных), менее выраженные у взрослых и более значительные у детей раннего возраста;
— нарушения функций сердечно-сосудистой системы (гипо- и гипертония, аритмия) возможны, но редки;
— алопеция (у 15—25 % пациентов).
Интенсивность побочных реакций различна, чаще умеренная; тяжелые реакции сравнительно редки и обратимы.
Особый интерес представляют изменения в составе крови у больных онкологическими гематологическими заболеваниями на фоне лечения препаратами ИФН. У взрослых пациентов без онкологического гематологического заболевания нейтропения менее 3•109/л и тромбоцитопения менее 100•109/л встречаются с частотой от 4 до 7 %.
Сообщений о побочном миелосупрессивном действии ИФН при лечении детей с онкологическими гематологическими заболеваниями, больных гепатитами В и С, нет. Эти изменения встречались у 75 % леченных нами пациентов, но тяжелые (тромбоцитопения менее 100•109/л и нейтропения ниже 1•109/л) только у 8,3—12,5 % больных, что сопоставимо с цифрами, приводимыми итальянскими авторами, изучавшими побочные действия препаратов ИФН у 94 детей без онкологического гематологического заболевания.
Они наблюдали нейтропению менее 1 • 109/л у 7,4 % детей и также пришли к выводу, что побочные реакции при ИФН-терапии часты, но не слишком тяжелы и обратимы.
Весьма важно, что и частота, и выраженность побочных эффектов зависят от возраста пациентов и дозы ИФН. Изменения состава крови и похудание встречались тем чаще и были тем значительнее, чем моложе ребенок. Цитопения наблюдалась у всех детей до 3—5 лет, причем у абсолютного большинства касалась двух ростков (нейтрофильных лейкоцитов и тромбоцитов). Похудание также было более выраженным у детей до 5 лет.
При дозе 3 000 000 ME изменения состава крови и похудание были умеренными или отсутствовали, а при дозах 5 000 000— 6 000 000 ME эти явления отмечали почти у всех больных и были значительны.
— Также рекомендуем «Ламивудин (зеффикс) в лечении гепатитов В и С у гематологических больных — эффективность»
Далее рекомендуем для ознакомления следующие статьи:
- Лечение гепатитов В и С у гематологических больных — схемы ИФН-терапии
- Ламивудин (зеффикс) в лечении гепатитов В и С у гематологических больных — эффективность
- Рибавирин и ремантадин в лечении гепатитов В и С у гематологических больных — эффективность
- Гептрал в лечении гепатитов В и С у гематологических больных — эффективность
- Профилактика гепатитов В и С у гематологических больных
- Шок у гематологических больных — диагностика, лечение
- Острая дыхательная недостаточность (ОДН) у гематологических больных — диагностика, лечение
- Поражения сердечно-сосудистой системы у гематологических больных — диагностика, лечение
- Острая кровопотеря у гематологических больных — классификация, неотложная помощь
- Перикардит и тампонада сердца у гематологических больных — диагностика, лечение
Источник