Иммунопатологические реакции при гепатите в
Хронический гепатит – хроническое воспаление в печени, продолжающееся без тенденции к улучшению не менее 6 мес после первоначального выявления и/или возникновения болезни.
Патоморфология ХГ: расширение портальных трактов, воспалительная клеточная инфильтрация портальных полей, дистрофия и некроз гепатоцитов, умеренный фиброз при сохранении архитектоники печени.
Этиология ХГ:
1) алкоголь – ХГ возникает при ежедневном употреблении более 40 мл чистого этанола на протяжении 6-8 лет
2) вирусы гепатита В, С, D – хронизация гепатита В наблюдается у 5-10% больных, перенесших острую форму заболевания, а гепатита С – у 50-85% больных (преимущественно у тех, кто употреблял алкоголь)
3) ЛС (АБ, сульфаниламиды, противотуберкулезные, психотропные, препараты железа)
4) промышленные и природные токсины (хлорированные углеводороды, нафталин, бензол, мышьяк, фосфор, свинец, ртуть, золото, природные грибные яды)
5) паразитарные инфекции (описторхоз, шистосомоз)
6) хронические неспецифические инфекции – приводят к возникновению реактивного ХГ
7) аутоиммунные нарушения – развитие ХГ связывают с функциональной неполноценностью Т-супрессоров
Патогенез ХГ:
А) в основе хронических вирусных гепатитов – неполноценный клеточно-опосредованный иммунный ответ на вирусную инфекцию; при этом Т-лимфоциты узнают белки вируса, внедрившиеся в мембрану пораженного гепатоцита, и разрушают инфицированные клетки, однако они не в состоянии полностью элиминировать вирус из организма и предотвратить поражение новых гепатоцитов.
Б) в основе хронических аутоиммунных гепатитов – аутоиммунные нарушения, связанные с угнетением активности Т-супрессоров и появлением клонов цитотоксических Т-лимфоцитов, атакующих гепатоциты, выработкой аутоантител.
В) в основе хронических алкогольных гепатитов – аутоиммунные нарушения (соединения метаболитов алкоголя с белками цитоскелета гепатоцитов распознаются иммунной системой как неоантигены, что запускает иммунные механизмы повреждения гепатоцитов) + стеатоз печени, возникающий из-за избыточного образования холестерина и жирных кислот при метаболизме алкоголя в печени
Классификация ХГ:
1) по этиологии: вирусный (вирусный гепатит B, C,D, F); алкогольный; лекарственный (токсическо-аллергический); токсический; паразитарный; реактивный; аутоиммунный (люпоидный)
2) по клинико-морфологической форме:
а) хронический активный гепатит (с преимущественно печёночными проявлениями, с выраженными внепечёночными проявлениями, холестатический) – лимфоидная инфильтрация захватывает портальные тракты, разрушает пограничную пластинку и вторгается в печеночную дольку
б) хронический персистирующий гепатит – лимфоидная инфильтрация портальных полей не нарушает целостность пограничной пластинки и не проникает в печеночную дольку.
Клиническая картина ХГ:
А) персистирующий ХГ:
– астеноневротический синдром (нерезко выраженная слабость, снижение аппетита, ухудшение общего состояния)
– диспепсические явления (тошнота, отрыжка, горечь во рту)
– незначительная иктеричность склер, желтуха
– незначительная гепатомегалия (печень слегка уплотнена, с загругленным краем и ровной поверхностью)
– тяжесть или тупая боль в правом подреберье
– в БАК показатели функции печени не изменены
Б) активный ХГ:
– астеноневротический синдром (общая слабость, утомляемость, похудание, раздражительность, снижение аппетита)
– повышение температуры тела (обычно до субфебрильных цифр)
– диспепсические явления (тошнота, отрыжка, горечь во рту, вздутие живота, неустойчивый стул)
– иктеричность склер, желтуха различной интенсивности чаще транзиторного характера
– значительная гепатомегалия (печень увеличена, плотная, с заостренным краем, болезненная)
– тупая боль в правом подреберье, увеличивающаяся после еды
– возможен кожный зуд (при явлениях холестаза), признаки геморрагического диатеза (носовые кровотечения, геморрагии на коже – чаще при высокой активности процесса)
– иногда определяется нерезко выраженная спленомегалия
– возможны системные проявления (артралгия, перикардит, ГН, тиреоидит и др.)
– в БАК повышен уровень АсАТ, АлАТ в 3-5 раз и более, ГГТП, тимоловая проба
Диагностика ХГ:
1. УЗИ печени: умеренная гепатомегалия, акустическая неоднородность органа
2. Сцинциграфия с 99Те: неравномерное накопление изотопа тканью печени
3. Лапароскопия с прицельной биопсией: увеличенная печень с заострённым краем
4. Пункционная биопсия печени: инфильтрация портальных трактов, дистрофические изменения гепатоцитов, воспалительные инфильтраты в стенках внутридольковых протоков, различной степени некроз гепатоцитов
Задачи пункционной биопсии: 1) установить диагноз (выявить вирус и морфологические маркёры вирусного гепатита); 2) исключить группу заболеваний, имеющих сходную клиническую картину; 3) определить тяжесть некрозовоспалительного процесса (активность); 4) установить выраженность фиброза (стадию заболевания); 5) оценить эффективность лечения.
5. Лабораторная диагностика – выделяют ряд синдромов:
А) цитолитический синдром – повышение в БАК: АсАТ, АлАТ, ЛДГ, сывороточного железа, ферритина, ГГТП (морфологическая основа – дистрофия и некроз гепатоцитов)
Б) синдром мезенхимального воспаления – повышение в БАК: СРБ, серомукоида, СОЭ, гипергаммаглобулинемия, положительная тимоловая проба (морфологическая основа – воспалительная инфильтрация печёночной ткани и усиление фиброгенеза)
В) синдром печёночно-клеточной недостаточности – БАК: гипербилирубинемия за счёт неконъюгированной фракции, снижение альбумина, протромбина, эфиров ХС (морфологическая основа – выраженные дистрофические изменения гепатоцитов и/или значительное уменьшение функционирующей паренхимы печени)
Г) синдром холестаза – повышение в БАК: коньюгированного билирубина, ЩФ, ХС, жирных кислот, бета-липопротеидов (морфологичекая основа – накопление желчи в гепатоците, нередко сочетающееся с цитолизом печёночных клеток)
6. При вирусной этиологии – серологическая диагностика маркеров вирусной инфекции:
Вирусный гепатит | Фаза интеграции (носительство) | Фаза репликации |
HBV | HBsAg, анти-HBsAg, анти-HBe, анти-HBc IgG | HBeAg, анти-HBc IgM, HBV ДНК |
HCV | Анти-HCV IgG | Анти-HCV IgM, HCV РНК |
HDV | Анти-HDV IgG | Анти-HDV IgM, HDV РНК |
Принципы лечения:
1. При высокой степени активности ХГ – постельный режим, в остальных случаях – щадящий с ограничением физической активности; санация хронических очагов инфекции; стол № 5 (ограничение животных жиров, солей, жидкости)
2. Антивирусная терапия – при обнаружении вируса в фазе репликации: интрон, альфа-интерферон (при ВГВ – по 10 млн ЕД п/к 3 раза/неделю 4-6 мес., при ВГС – по 3 млн ЕД п/к 3 раза/нед 6-12 мес, при ВГD – по 10 млн ЕД п/к 3 раза/нед 12-18 мес)
3. Иммунодепрессантная терапия: ГКС используют при высокой степени активности патологического процесса (начальная доза преднизолона 30-40 мг/сутки с постепенным снижением до поддерживающей 10-15 мг/сутки после достижения эффекта на 6 мес и >; затем препарат постепенно отменяют на 2,5 мг/мес в течение 4-6 недель), при недостаточной эффективности ГКС и развитии побочных эффектов – цитостатики (азатиоприн 50-100 мг/сут)
4. Улучшение метаболизма гепатоцитов: витамины ундевит, декамевит, дуовит, витамин В12; липолевая кислота; гепатопротекторы (эссенциале, лив-52, карсил)
5. Иммуномодулирующая терапия – для повышения активности Т-супрессорной популяции лимфоцитов: левамизол(декарис) 100-150 мг/сутки через день 7-10 раз, затем поддерживающая доза 50-100 мг/неделю до года
6. Дезинтоксикационная терапия: 200-400 мл 5-10% р-ра глюкозы в/в, 200-400 мл 0,9% физ. р-ра в/в
Диспансеризация: при хроническом активном гепатите: каждые 2-3 месяца осмотр больного с определением в крови основных биохимических показателей (билирубин, АСТ, АЛТ, белковые фракции, протромбин), при хроническом персистирующем гепатите: обследование не реже 2 раз в год; при лечении поддерживающими дозами иммунодепрессантов – ежемесячный осмотр, общие клинические и биохимические исследования крови.
Source: uchenie.net
Читайте также
Вид:


Источник
В патогенезе гепатита В можно выделить несколько ведущих звеньев патогенетической цепи:
- внедрение возбудителя — заражение;
- фиксация на гепатоците и проникновение внутрь клетки;
- размножение вируса и «выталкивание» его на поверхность гепатоцита, а также в кровь;
- включение иммунологических реакции, направленных на элиминацию возбудителя;
- иммунокомплексное поражение органов и систем;
- формирование иммунитета, освобождение от возбудителя, выздоровление.
Поскольку заражение при гепатите В всегда происходит парентеральным путем, можно считать, что момент инфицирования практически равнозначен проникновению вируса в кровь. Попытки некоторых исследователей выделять при гепатите В энтеральную и региональную фазу малообоснованы. Больше оснований считать, что с током крови вирус сразу попадает в печень.
Тропизм вируса гепатита В к ткани печени предопределен наличием в составе НВsАg специального рецептора — полипептида с молекулярной массой 31 000 Да (РЗ1), обладающего альбумин связывающей активностью. Аналогичная зона альбумина находится и на мембране гепатоцитов печени человека и шимпанзе, чем по существу и определяется тропизм НВV к печени человека и шимпанзе.
При проникновении вируса внутрь гепатоцита происходит высвобождение вирусной ДНК, которая, попадая в ядро гепатоцита и исполняя роль матрицы для синтеза нуклеиновых кислот, запускает ряд последовательных биологических реакций, чьим итогом становится сборка нуклеокапсида вируса. Нуклеокапсид мигрирует через ядерную мембрану в цитоплазму где и происходит окончательная сборка частиц Дейна — полного вируса гепатита В.
Следует, однако, отметить, что при заражении гепатоцита процесс может пойти двумя путями — репликативным и интегративным. В первом случае развивается картина острого или хронического гепатита, а во втором — вирусоносительство.
Причины, предопределяющие два вида взаимодействия вирусной ДНК и гепатоцита, точно не установлены. Вероятнее всего, тип реагирования генетически детерминирован.
Итогом репликативного взаимодействия становятся сборка структур коровского антигена (в ядре) и сборка полного вируса (в цитоплазме) с последующей презентацией полного вируса или его антигенов на мембране или в структуре мембраны гепатоцитов.
Принято считать, что репликация вируса не приводит к поражению клетки на уровне гепатоцита, поскольку вирус гепатита В не обладает цитопатическим действием. Это положение нельзя считать бесспорным, так как оно основывается на экспериментальных данных, которые, хотя и свидетельствуют об отсутствии цитопатического действия вируса гепатита В, но получены на культурах тканей и поэтому не могут быть полностью экстраполированы на вирусный гепатит В у человека. Во всяком случае, вопрос об отсутствии поражения гепатоцитов в ходе репликативной фазы нуждается в дополнительном изучении.
Однако, независимо от характера взаимодействия вируса с клеткой, в дальнейшем печень обязательно включается в иммунопатологический процесс. При этом поражение гепатоцитов связано с тем, что в результате экспрессии вирусных антигенов на мембране гепатоцитов и выхода вирусных антигенов в свободную циркуляцию происходит включение цепи последовательных клеточных и гуморальных иммунных реакций, направленных в конечном итоге на удаление вируса ил организма. Этот процесс осуществляется в полном соответствии с общими закономерностями иммунного ответа при вирусных инфекциях. Для элиминации возбудителя включаются клеточные цитотоксические реакции, опосредованные различными классами клеток-эффекторов: К-клеток, Т-клеток, естественных киллеров, макрофагов. В ходе этих реакций происходит разрушение инфицированных гепатоцитов, что сопровождается высвобождением вирусных антигенов (НВсАg, НВeАg, НВsАg), запускающих систему антителогенеза, вследствие чего в крови накапливаются специфические антитела, прежде всего к коровому — анти-НВс и е-антигену — анти-НВЕ. Следовательно, освобождение печеночной клетки от вируса происходит в процессе ее гибели за счет реакций клеточного цитолиза.
Одновременно с этим накапливающиеся в крови специфические антитела связывают антигены вируса, образуя иммунные комплексы, фагоцитируемые макрофагами и выделяющиеся почками. При этом могут возникать различные иммунокомплексные поражения в виде гломерулонефрита, артериита, артралгий, кожных высыпаний и др. С участием специфических антител происходит очищение организма от возбудителя и наступает полное выздоровление.
В соответствии с изложенной концепцией патогенеза гепатита В все многообразие клинических вариантов течения болезни принято объяснять особенностями взаимодействия вируса и кооперацией иммунокомпетентных клеток, иначе говоря, силой иммунного ответа на присутствие вирусных антигенов. По современным представлениям, сила иммунного ответа генетически детерминирована и сцеплена с антигенами гистосовместимости локуса НLA первого класса.
Принято считать, что в условиях адекватного иммунного ответа на антигены вируса клинически развивается острый гепатит с циклическим течением и полным выздоровлением. На фоне снижения иммунного ответа к антигенам вируса иммуноопосредованный цитолиз выражен незначительно, поэтому не происходит эффективной элиминации инфицированных клеток печени, что приводит к слабовыраженным клиническим проявлениям с длительной персистенцией вируса и, возможно, развитию хронического гепатита. При этом, наоборот, в случае генетически детерминированною сильного иммунного ответа и массивности инфицирования (гемотрансфузии) возникают обширные зоны поражения печеночных клеток, чему клинически соответствуют тяжелые и злокачественные формы болезни.
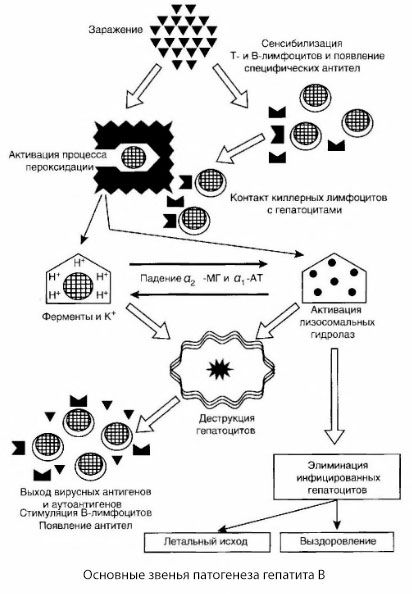
Представленная схема патогенеза гепатита В отличается стройностью, тем не менее в ней имеется ряд спорных и малоисследованных моментов.
Если следовать концепции гепатита В как иммунопатологического заболевания, можно было бы ожидать усиления реакций клеточной цитотоксичности с нарастанием тяжести заболевания. Однако, при тяжелых формах показатели клеточного звена иммунитета резко снижены, в том числе отмечается многократное падение, по сравнению с таковыми у здоровых детей, и показателя К-клеточной цитотоксичности. При злокачественной форме в периоде развития массивного некроза печени и особенно печеночной комы отмечается полная неспособность лимфоцитов к бластной трансформации под влиянием фитогематтлютинина, стафилококкового эндотоксина и НВsAg. Кроме того, отсутствует способность лейкоцитов к миграции по данным реакции торможения миграции лейкоцитов (РТМЛ), и выявляется резкое увеличение проницаемости мембран лимфоцитов по результатам исследований их с помощью флюоресцентного зонда тетрациклина.
Так, если показатели флюоресценции лимфоцитов здоровых людей составляют 9,9±2%, а при типичном гепатите В с доброкачественным течением они повышаются до 22,3±2,7%, то при злокачественных формах число флюоресцирующих лимфоцитов достигает в среднем 63,5±5,8%. Поскольку повышение проницаемости клеточных мембран однозначно оценивается в литературе как достоверный показатель их функциональной неполноценности, можно заключить, что при гепатите В, особенно при злокачественной форме, возникает грубое повреждение лимфоцитов. Об этом же свидетельствуют и показатели К-клеточной цитотоксичносги. При тяжелой форме на 1-2-й неделе заболевания цитотоксичность составляет 15,5±8,8%, а при злокачественной форме на 1-й неделе — 6.0±2,6, на 2-й — 22.0±6,3% при норме 44,8±2,6%.
Представленные данные однозначно свидетельствуют о выраженных нарушениях в клеточном звене иммунитета у больных с тяжелыми формами гепатита В. Очевидно также, что эти изменения возникают вторично, в результате поражения иммунокомпетентных клеток токсическими метаболитами и, возможно, циркулирующими иммунными комплексами.
Как показали исследования, у больных с тяжелыми формами гепатита В, особенно в случае развития массивного некроза печени, в сыворотке крови происходит падение титра HВsАg и НВeАg и одновременно начинают обнаруживаться в высоких титрах антитела к поверхностному антигену, что совершенно нехарактерно для доброкачественных форм болезни, при которых анти-НВV появляются лишь на 3-5-м месяцев болезни.
Быстрое исчезновение антигенов вируса гепатита В при одновременном появлении высоких титров противовирусных антител позволяет предполагать интенсивное образование иммунных комплексов и возможное их участие в патогенезе развития массивного некроза печени.
Таким образом, фактические материалы не позволяют однозначно трактовать гепатит В только с позиций иммунопатологической агрессии. И дело не только в том, что при этом не обнаруживается связи между глубиной и распространенностью морфологических изменений в печени, с одной стороны, и выраженностью клеточных факторов иммунитета — с другой. Теоретически это обстоятельство можно было бы объяснить поздними сроками исследования показателей клеточного иммунитета, когда иммунокомпетентные клетки подверглись мощному токсическому воздействию в связи с нарастающей функциональной недостаточностью печени. Можно, конечно, допустить, что иммунный цитолиз гепатоцитов происходит на самых ранних этапах инфекционного процесса, возможно, еще до появления клинических симптомов тяжелого поражения печени. Однако такое предположение маловероятно, поскольку у больных с острейшим (молниеносным) течением болезни выявлялись аналогичные показатели клеточного иммунитета и, кроме того, при морфологическом исследовании ткани печени не обнаруживалось массивной лимфоцитарной инфильтрации, в то же время выявлялись сплошные поля некротизированного эпителия без явлений резорбции и лимфоцитарной агрессии.
Объяснить морфологическую картину при остром гепатите только с позиций иммунного клеточного цитолиза весьма сложно, поэтому в ранних работах не исключали цитотоксическое действие вируса гепатита В.
В настоящее время это предположение нашло частичное подтверждение благодаря открытию вируса гепатита В. Как показали исследования, частота обнаружения маркеров гепатита D находится в прямой зависимости от тяжести заболевания: при легкой форме они обнаруживаются у 14%, среднетяжелой — у 18, тяжелой — 30, злокачественной — у 52% больных. Учитывая, что вирус гепатита D обладает некрозогенным цитопатическим эффектом, можно считать установленным, что в развитии фульминантных форм гепатита В большое значение имеет коинфекция вирусами гепатита В и D.
Патогенез гепатита В можно представить следующим образом. После проникновения вируса гепатита В в гепатоциты индуцируется иммунологическая атака на инфицированные гепатоциты Т-киллеров, выделяющих лимфотоксины в направлении печеночных клеток.
Интимные механизмы поражения гепатоцигов при гепатите В до настоящего времени не установлены. Ведущую роль играют активированные процессы перекисного окисления липидов и лизосомальные гидролазы. Пусковым моментом могут быть лимфотоксины, высвобождающиеся из эффекторных клеток при их контакте с гепатоцитами, но не исключено, что инициатором процессов переоксидации может выступать и сам вирус. В дальнейшем патологический процесс вероятнее всего развивается в следующей последовательности.
- Взаимодействие фактора агрессии (лимфотоксины или вирус) с биологическими макромолекулами (возможно, с компонентами мембран эндоплазматической сети, способными принимать участие в процессах детоксикации, по аналогии с другими повреждающими агентами, как это было показано по отношению к четыреххлористому углероду).
- Образование свободных радикалов, активация процессов перекисного окисления липидов и повышение проницаемости всех гепатоцеллюлярных мембран (синдром цитолиза).
- Движение биологически активных веществ по градиенту концентрации — потеря ферментов различной внутриклеточной локализации, донаторов энергии, калия и др. Накопление в клетках натрия, кальция, сдвиг pH в сторону внутриклеточного ацидоза.
- Активация и выход лизосомальных гидролаз (РНК-аза, ДНК-аза, катепсины и др.) с распадом печеночной клетки и высвобождением аутоантигенов.
- Стимуляция Т- и В-систем иммунитета с формированием специфической сенсибилизации Т-лимфоцитов к печеночному липопротеину, а также образование противопеченочных гуморальных аутоантител.
В предложенной схеме патогенеза гепатита В в качестве пускового фактора выступают вирусные антигены, чья интенсивная продукция наблюдается на самых ранних этапах заболевания и весь острый период, за исключением злокачественных форм, при которых продукция вирусных антигенов практически прекращается в момент развития массивного некроза печени, что и предопределяет быстрое снижение репликации вируса.
Очевидно также, что вирусные антигены активируют Т- и В-системы иммунитета. В ходе этого процесса возникает характерное перераспределение субпопуляций Т-лимфоцитов, направленное на организацию адекватного иммунного ответа, элиминацию инфицированных гепатоцитов, нейтрализацию вирусных антигенов, саногенез и выздоровление
При взаимодействии иммунокомпетентных клеток с вирусными антигенами на мембранах гепатоцитов или в ходе репродукции вируса внутри гепатоцита, возникают условия для активации процессов перекисного окисления липидов, управляющий как известно, проницаемостью всех клеточных и субклеточных мембран,
С этих позиций становится понятным столь закономерное и в высшей степени характерное для вирусных гепатитов возникновение синдрома цитолиза — повышенной проницаемости клеточных мембран
Конечным исходом синдрома цитолиза может быть полное разобщение окислительного фосфорилирования, истечение материала клетки, гибель печеночной паренхимы.
Однако в подавляющем большинстве случаев эти процессы не приобретают столь фатального развития. Только при злокачественных формах болезни патологический процесс протекает лавинообразно и необратимо, поскольку возникают массивное заражение, выраженный иммунный процесс, чрезмерная активация процессов переоксидации и лизосомальных гидродаз, явления аутоиммунной агрессии.
Эти же механизмы наблюдаются и при благоприятном течении гепатита В, с той лишь особенностью, что все они реализуются на качественно ином уровне. В отличие от случаев массивного некроза печени, при благоприятном течении болезни количество инфицированных гепатоцитов, а следовательно, зона иммунопатологического цитолиза меньше, процессы перекисного окисления липидов усиливаются не столь значительно, активация же кислых гидролаз приводит лишь к ограниченному аутолизу с несущественным высвобождением аутоантигенов, а следовательно, без массивной аутоагрессии, то есть все этапы патогенеза при благоприятном течении осуществляются в рамках сохраняющейся структурной организации паренхимы печени и сдерживаются защитными системами (антиоксиданты, ингибиторы и др.) и поэтому не имеют столь разрушительного действия.
Причины возникновения симптомов интоксикации при вирусных гепатитах исследованы не до конца. Предложение различать так называемую первичную, или вирусную, интоксикацию и вторичную (обменную, или метаболическую) можно считать позитивным, хотя это не раскрывает интимного механизма возникновения общетоксического синдрома. Во-первых, вирусы гепатитов не обладают токсическими свойствами, а, во-вторых, концентрация многих метаболитов далеко не всегда коррелирует с тяжестью заболевания и степенью выраженности симптомов токсикоза. Известно также, что и концентрация вирусных антигенов строго не коррелирует с тяжестью интоксикации. наоборот, с увеличением тяжести заболевания, а следовательно, нарастания степени токсикоза, концентрация НВsАg снижается и бывает самой низкой при злокачественных формах в момент возникновения глубокой печеночной комы. Вместе с тем частота обнаружения и титры специфических противовирусных антител прямо зависят от тяжести заболевания.
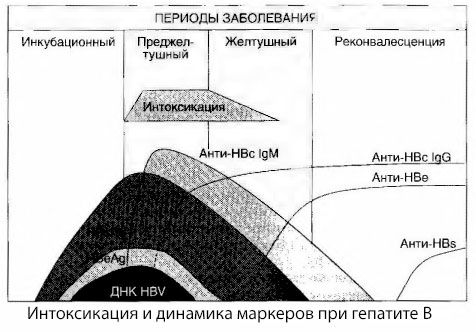
Интоксикация появляется не в момент регистрации вирусных антигенов, а в периоде циркуляции в крови противовирусных антител класса IgМ к коровскому антигену и антигену системы E. Более того, при тяжелых и особенно злокачественных формах у значительной части больных в крови появляются даже анти-НВs, чего обычно никогда не наблюдается при легких и среднетяжелых формах болезни.
Представленные данные дозволяют заключить, что синдром токсикоза при вирусных гепатитах, и гепатите В в частности, не возникает в результате появления в крови вирусных антигенов, а становится следствием взаимодействия вирусных антигенов с противовирусными антителами класса IgМ. Результат такого взаимодействия, как известно, — образование иммунных комплексов и, возможно, активных токсичных веществ.
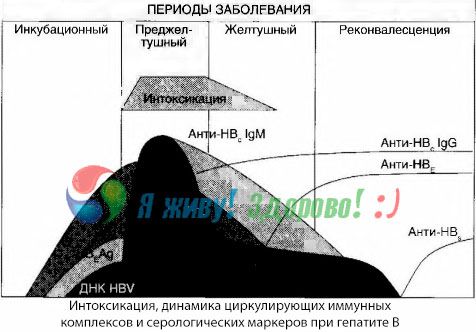
Симптомы интоксикации возникают в момент появления в свободной циркуляции иммунных комплексов, но в дальнейшем такой корреляции не прослеживается.
Частичное объяснение этому можно найти при исследовании состава иммунных комплексов. У больных с тяжелыми формами в крови циркулируют преимущественно комплексы среднего размера, а в их составе на высоте токсического синдрома преобладают антитела класса тогда как в периоде спада клинических проявлений и реконвалесценции комплексы становятся более крупными, а в их составе начинают преобладать антитела класса IgG.
Представленные данные касаются механизмов развития токсического синдрома в начальном периоде заболевания, но при токсикозе, возникающем на высоте клинических проявлений, они имеют лишь частичное значение и особенно — при развитии печеночной комы.
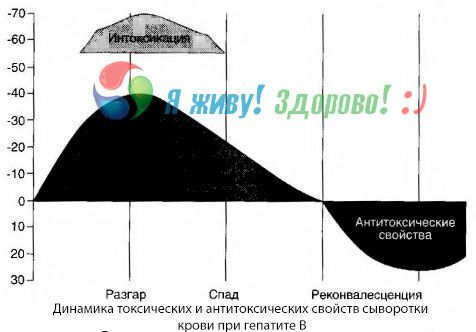
Методом гемокультур удалось показать, что при гепатите В в крови постоянно накапливаются токсины, высвобождающиеся из пораженной распадающейся печеночной ткани. Концентрация этих токсинов пропорциональна тяжести заболевания,они имеют белковую природу.
В периоде реконвалесценции в крови появляются антитела к этому токсину; но в случае возникновения печеночной комы концентрация токсина в крови резко возрастает, а антитела в крови не обнаруживаются.
Источник
