Изменения почек при циррозе
Поражение почек встречается у 10-20% лиц, страдающих заболеваниями печени, проявляясь различными вариантами от незначительного мочевого синдрома до быстропрогрессирующей необратимой почечной недостаточности. Одно время намечалась тенденция объединять все варианты содружественного поражения почек и печени под одним термином «гепаторенальный синдром», однако в настоящее время наблюдается стремление к дифференцированию как патогенетических путей, так и клинико-морфологических вариантов.
На современном этапе обсуждаются два основных патогенетических механизма, приводящих при заболеваниях печени к поражению почек, развитию «печеночной» нефропатии:
1) нарушение почечного кровотока;
2) прямое воздействие на почки токсических метаболитов, антител, иммунных комплексов.
Снижение почечного кровотока закономерно развивается при заболеваниях печени. Причинами нарушения почечной гемодинамики являются резкое повышение почечного сосудистого сопротивления под влиянием каких-то медиаторов, выделяемых больной печенью или недостаточно инактивируемых ею, а также перераспределение почечного кровотока, подтвержденное радио-изотопными исследованиями с 133Хе и ангиографией; меньшее значение в последние годы придается гиповолемии, развивающейся вследствие секвестрации крови в сосудах портальной системы.
Среди возможных медиаторов почечной вазоконстрикции называют ферритин, ароматические амины, бактериальный эндотоксин, ренин, кинины. При тяжелых циррозах печени, особенно при гепаторенальном синдроме, в крови резко повышен уровень ренина и ангиотензина II [Schroeder Е. et al., 1970; Wong P. et al., 1977], вызывающих почечную вазоконстрикцию, и снижен уровень брадикинина, увеличивающего почечный кровоток путем активации синтеза простагландина Е. Блокада простагландин-синтетазы индоцидом вызывает у больных циррозом обратимую почечную недостаточность [Reynolds Т. et al., 1976].
Обсуждается возможность развития почечной вазоконстрикции за счет неврогенных влияний в ответ на изменения внепочечного кровообращения. Уменьшение ренального кровотока наблюдается при стимуляции симпатических сосудистых сплетений вокруг сосудов печени, при внепеченочной портальной гипертензии в клинике и эксперименте. В связи с этим высказано предположение о существовании порторенального рефлекса, угнетающего почечный кровоток.
Почки могут поражаться и за счет токсического действия печеночных метаболитов — билирубина и желчных кислот, алкоголя, развития локальной внутрисосудистой коагуляции.
Сравнительно недавно стало изучаться участие иммунологических механизмов в патогенезе «печеночной» нефропатии. Антитела к почечной ткани обнаруживаются при остром вирусном гепатите, хроническом активном гепатите и первичном билиарном циррозе печени.
Существует предположение о наличии в ткани печени и почек близких антигенов, дающих перекрестные реакции. Однако при развитии «печеночного» ГН наиболее вероятен иммунокомплексный генез его. При вирусных и алкогольных гепатитах и циррозах в крови обнаруживают циркулирующие иммунные комплексы, при вирусных циррозах в почках находят австралийский антиген, антитела к нему, реже — другие иммуноглобулины [Brzosko W. et al., 1974; McIntosh R., 1976]. В сыворотке крови больных алкогольным циррозом печени резко повышен уровень IgA, нередко секреторного типа (Andre F. et al., 1976] и обнаруживаются в высоком титре антитела к IgA [Wilson I. et al., 1972]; в почечных клубочках выявляется иммунолюминесценция IgA и С3 [Nochy D. et al., 1976].
Возможна и роль нарушений клеточного иммунитета. При хроническом активном гепатите и первичном билиарном циррозе может наблюдаться инфильтрация почечной ткани малыми лимфоцитами, обнаруживается сенсибилизация лимфоцитов не только к антигенам печени, но и к мукопротеину Tamm—Horsfall, специфичному для эпителия дистальных почечных канальцев [Cochrane A. et al., 1976].
Разнообразие «печеночно-почечных связей», а также механизмов, с помощью которых пораженная печень влияет на почки, приводит к развитию различных клинико-морфологических вариантов печеночной нефропатии. Основными являются гепаторенальный синдром, ГН, печеночный гломерулосклероз, почечный канальцевый ацидоз, пиелонефрит.
Клиническая нефрология
под ред. Тареева Е.М.
Опубликовал Константин Моканов
Источник
Поражение почек у больных циррозом печени значительно ухудшает прогноз заболевания. В статье представлены диагностические критерии хронической болезни почек, острой болезни почек, острого повреждения почек и методы их лечения.

Таблица 1. Дефиниции заболеваний почек у пациентов с циррозом печени

Таблица 2. Стадии острого повреждения почек у больных циррозом печени
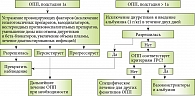
Алгоритм наблюдения и лечения больных циррозом печени с острым почечным повреждением

В среднем у 5–7% больных циррозом печени различной этиологии ежегодно наблюдается декомпенсация заболевания [1–3]. Декомпенсированный цирроз печени – заболевание с мультиорганной (системной) дисфункцией. Декомпенсированной стадии заболевания предшествует стадия компенсации (асимптомная стадия), когда клинические симптомы заболевания отсутствуют. Средняя продолжительность жизни пациентов с компенсированной стадией заболевания – 12 лет.
Существуют три стадии компенсированного цирроза печени:
- стадия 0: отсутствуют признаки портальной гипертензии и варикозно расширенные вены пищевода (ВРВП), измерение жесткости печени (liver stiffness measurement, LSM) > 15, но 5, но
- стадия 1: ВРВП отсутствуют, определяется значимая портальная гипертензия – LSM ≥ 20 или давление в воротной вене ≥ 10 мм рт. ст.;
- стадия 2: имеют место ВРВП и значимая портальная гипертензия.
Декомпенсация цирроза печени (симптомная стадия) характеризуется наличием клинических признаков заболевания, средняя продолжительность жизни не превышает двух лет. Манифестация декомпенсированного заболевания часто сопровождается кровотечением из ВРВП. Конечная стадия декомпенсации цирроза печени характеризуется развитием рефрактерного асцита, печеночной энцефалопатии или желтухи, почечной недостаточности, присоединением инфекции [1, 3, 4].
О функциональном состоянии почек судят по уровню креатинина крови и снижению скорости клубочковой фильтрации (СКФ).
Критерии почечной недостаточности у пациентов с циррозом печени были определены более 30 лет назад и базировались на уровне креатинина ≥ 1,5 мг/дл, что соответствовало показателю СКФ ≤ 40 мл/мин/1,73 м2. Важно, что у пациентов с заболеваниями печени даже незначительное увеличение уровня креатинина крови может вызывать заметное снижение СКФ. Тем не менее диагноз почечной дисфункции при заболеваниях печени все еще основан на показателях креатинина крови [5, 6]. В случае повышения уровня креатинина крови и снижения СКФ у пациентов с заболеванием печени необходимо исключить хроническую болезнь почек (ХБП), острую болезнь почек (ОБП), острое повреждение почек (ОПП) или их сочетание (табл. 1).
Цирроз печени может сопровождаться ХБП, обусловленной сопутствующими заболеваниями, например сахарным диабетом, артериальной гипертензией и/или такими заболеваниями почек, как IgA-нефропатия, вирусная гломерулопатия.
Распространенность ХБП у пациентов с циррозом печени до сих пор не изучена. Диагноз ХБП основывается на снижении СКФ на протяжении трех и более лет (СКФ 2). СКФ рассчитывается по формулам, учитывающим уровень креатинина, наличие (отсутствие) признаков повреждения почечной паренхимы (протеинурия, гематурия, анормальные значения ультрасонографии). Стадия ХБП определяется исходя из уровня снижения СКФ [7–9].
Критерием ОБП служит повреждение почек, зафиксированное в течение менее трех месяцев: СКФ снижается менее 60 мл/мин/1,73 м2, или на 35% и более, либо уровень креатинина увеличивается на 50% и более за указанный промежуток времени.
В настоящее время вместо термина «острая почечная недостаточность» используется термин «острое повреждение почек», предложенный экспертами Международной организации по улучшению глобальных результатов лечения заболеваний почек KDIGO (Kidney Disease: Improving Global Outcomes) [10, 11]. При ОПП не отмечается каких-либо структурных изменений почек. Диагноз основан на увеличении уровня креатинина сыворотки крови в 1,5 раза по сравнению с исходным (если это известно или предполагается, что увеличение уровня произошло в течение предшествующих семи дней, или абсолютное увеличение уровня креатинина на 0,3 мг/дл (≥ 26,5 мкмоль/л) и более – на протяжении двух дней).
Следует подчеркнуть, что диагностика ОПП, согласно критериям KDIGO, может базироваться как на уровне креатинина сыворотки крови, так и на объеме выделяемой мочи. То есть, исходя из данных критериев, диагноз ОПП правомерен и при объеме мочи менее 0,5 мл/кг/ч за шесть часов [11–13]. Однако, согласно новому консенсусу Международного асцитического клуба (International Ascites Club), объем мочи не учитывается при диагностике ОПП у больных циррозом печени. Это объясняется тем, что больные циррозом печени с асцитическим синдромом часто страдают олигурией с выраженной задержкой натрия, несмотря на относительно нормальную СКФ, объем мочи у них может повышаться на фоне применения диуретиков [14].
Новая система разделения ОПП на стадии основана на процентном увеличении уровня креатинина сыворотки крови у больных циррозом печени по сравнению с базовым уровнем (начальная стадия) либо при пиковом значении креатинина во время госпитализации в случае прогрессирующего ОПП (пиковая стадия). У пациентов с циррозом печени значение креатинина в течение последних трех месяцев, до его повышения, следует рассматривать как базовое. Согласно критериям KDIGO, стадия 1 соответствует увеличению креатинина на 0,3 мг/дл (≥ 26,5 мкмоль/л) и более, или в 1,5–2 раза от базового. Стадия 2 ОПП соответствует увеличению уровня креатинина сыворотки крови более чем в два раза, но менее чем в три раза. Стадия 3 верифицируется при увеличении уровня креатинина более чем в три раза (табл. 2) [11].
Как показали результаты недавних исследований, у пациентов с циррозом печени со стадией 1 ОПП эффективность терапии зависит от уровня креатинина сыворотки крови. Его увеличение более чем на 1,5 мг/дл (132,6 мкмоль/л) ассоциируется с худшим прогнозом [15–17]. В отличие от системы KDIGO эксперты Международного асцитического клуба предложили разделять стадию 1 на подстадии 1а (креатинин
С учетом системы стадирования и результатов нескольких проспективных исследований был предложен новый алгоритм лечения ОПП у пациентов с циррозом печени (рисунок) [14]. При подстадии 1а (увеличение уровня креатинина до значений менее чем 1,5 мг/дл (132,6 мкмоль/л)) в некоторых случаях достаточно устранить провоцирующие факторы: отменить гепатотоксические препараты, нестероидные противовоспалительные препараты, уменьшить дозу или отменить диуретики и бета-блокаторы, увеличить объем плазмы, пролечить диагностированные инфекции. Но уже с подстадии 1b кроме полной отмены диуретических препаратов рекомендовано вводить альбумин из расчета 1 г на 1 кг веса больного на протяжении двух дней. Если после двухдневного лечения признаки ОПП сохраняются, необходимо исключить наличие у пациента гепаторенального синдрома (ГРС) или других видов ОПП.
У больных циррозом печени могут наблюдаться все виды ОПП – преренальное, ГРС, ренальное, острое тубулярное, постренальное повреждение [8]. Необходимо дифференцировать ГРС от острого тубулярного некроза. Конечно, возможно разграничение различных вариантов повреждения с помощью пункционной биопсии почек. В отличие от острого тубулярного некроза при ГРС отсутствуют морфологические изменения в почках. Поскольку биопсия почки редко проводится при ОПП, в настоящее время предлагают использовать биомаркеры. Для дифференциальной диагностики между острым тубулярным некрозом и ГРС целесообразно определять в моче липокалин, ассоциированный с желатиназой нейтрофилов. Концентрация этого белка в моче и крови значительно повышается в первые часы после развития ОПП. Подобный анализ позволяет быстро установить диагноз и назначить адекватную терапию. Скорее всего этот тест в будущем получит широкое распространение в клинической практике [18–22].
Экспертами Международного асцитического клуба классификация ГРС была пересмотрена. Сегодня выделяют два типа ГРС. Тип 1 соответствует ГРС-ОПП, тип 2 подразумевает нарушение функции почек, соответствие критериям ГРС, но не ОПП (не-ОПП-ГРС).
Согласно критериям Международного асцитического клуба, ГРС-ОПП возникает только при наличии у больных декомпенсированным циррозом печени асцита и признаков ОПП (увеличение уровня креатинина на 0,3 мг/дл (≥ 26,5 мкмоль/л) и выше на протяжении 48 часов, или на 50% и более на протяжении семи дней). При диагностике ГРС-ОПП необходимо исключить шок, органическое поражение почек (отсутствие протеинурии и микрогематурии и структурных изменений почек по данным ультрасонографии), доказать отсутствие в анамнезе приема в ближайшее время нефро- и гепатотоксических препаратов, улучшение в течение двух дней после отмены диуретических средств и назначения альбумина в дозе 1 г на 1 кг веса пациента [14, 23].
Всем пациентам c ГРС-ОПП со стадией выше 1а необходимо незамедлительно назначить вазоконстрикторы и альбумин с госпитализацией в палату интенсивной терапии. Препаратом выбора из вазопрессоров является терлипрессин (Реместип). Препарат повышает тонус гладких мышц сосудистой стенки, вызывает сужение артериол, вен и венул в большей степени в брюшной полости, уменьшает кровоток в гладкомышечных органах и печени, снижает давление в портальной системе. Препарат можно вводить внутривенно болюсно (1 мг каждые 4–6 часов) или непрерывно внутривенно, 2 мг/сут. Если через два дня лечения уровень креатинина снижается менее чем на 25% пикового, дозу терлипрессина следует увеличить до максимальной – 12 мг/сут. При недоступности терлипрессина его можно заменить норадреналином. Если недоступны оба препарата, можно использовать мидодрин и октреотид, хотя их эффективность ниже. Одновременно с вазопрессорами вводится 20%-ный раствор альбумина, его суточная доза – 20–40 г. Для предупреждения перегрузки кровообращения целесообразно измерять центральный объем крови с титрованием дозы альбумина [24–29].
Профилактика ГРС основана на введении раствора альбумина пациентам с асцитическим синдромом, у которых не исключен риск развития спонтанного бактериального перитонита. В случае его верификации альбумин вводят из расчета 1,5 мг на 1 кг веса, на третий день от постановки диагноза – в дозе 1 мг на 1 кг веса пациента [30, 31].
Кроме того, в качестве профилактики спонтанного бактериального перитонита и развития на его фоне ГРС-ОПП используют норфлоксацин 400 мг/сут.
Источник
Печеночно-почечный синдром определяется как прогрессирующая олигурическая почечная недостаточность на фоне хронических и острых болезней печени при отсутствии других известных клинических или патологических причин для почечной недостаточности. Печеночно-почечный синдром характеризуется острым сужением сосудов наиболее ярко выраженным в корковых областях почек. Печеночно-почечный синдром при циррозе рассматривается как крайняя степень патофизиологического развития болезни, ведущая к удержанию ионов натрия и воды у больных.
Одной из основных причин печеночно-почечного синдрома является дисбаланс между внутрипочечным сужением и расширением сосудов. Его патогенез определяется гемодинамическими изменениями и нарушением прямых печеночно-почечных связей. Последнее включает в себя гепаторенальный рефлекс, который активируется разрушением гепатоцитов, увеличением внутрисинусоидального давления, что ведет к значительному снижению клубочковой фильтрации. Более того, снижение скорости образования в печени мочегонных факторов также может оказывать свое влияние, однако эти факторы пока еще не полностью идентифицированы. Гемодинамические изменения характеризуются периферическим расширением сосудов, что частично происходит в результате увеличения образования оксида азота вследствие эндотоксемии. Для поддержания кровяного давления расширение сосудов балансируется активацией симпатической нервной и различных гуморальных систем, регулирующих давление внутри организма. Все это одновременно является пусковым механизмом задержки ионов натрия и воды. В результате возникает гипердинамическая циркуляция, однако компенсаторные механизмы, очевидно, недостаточно эффективны для того, чтобы противостоять расширению сосудов и поэтому сохраняется ретенция натрия и воды. Таким образом, печеночно-почечный синдром имеет полное сходство с преренальной азотемией.
Печеночно-почечный синдром развивается при дальнейшем прогрессировании ренальной вазоконстрикции в результате уменьшения внутрисосудистого объема после парацентеза, кровотечений, больших доз диуретиков и, например, при длительном применении нестероидных противовоспалительных препаратов. Клинически печеночно-почечный синдром характеризуется олигурией, концентрированной, почти лишенной натрия, мочой на ранних стадиях без нарушений в моче количества элементов седиментации.
Таким образом, печеночно-почечный синдром имеет сходство с преренальной азотемией (уремией) и отличается от последней потерей улучшения функциональной способности почек после восстановления объема плазмы крови. Большинство больных циррозом печени при печеночно-почечного синдрома без экстренного соответствующего лечения погибают.
Стойкая, не исчезающая при коррекции гиповолемии, функциональная почечная недостаточность у больных циррозом печени — гепаторенальный синдром (печеночная нефропатия) — развивается чаще всего на фоне нарастающего и резистентного к лечению асцита, резко нарушенной функции печени, значительно выраженной задержки воды, гипонатриемии и значительного снижения содержания натрия в моче в результате нарушенной его экскреции почками. Печеночно-почечный синдром является следствием остро нарастающей гиповолемии — при кровотечении, рвоте, диарее, септицемии, эвакуации большого объема асцитической жидкости при парацентезе или чрезмерном диурезе при передозировке мочегонных средств. Аналогичный синдром со стойкой азотемией имеет место при фульминантной (молниеносной) печеночной недостаточности у больных с острым и подострым некрозом печени. У этих больных, а не у больных циррозом, целесообразно проводить гемодиализ. Печеночно-почечный синдром следует отличать от частых при циррозе печени эпизодов обратимой преренальной азотемии с метаболическим алкалозом, которые могут повторяться в течение нескольких лет из-за снижения объема крови при рвоте, диарее, полиурии или желудочно-кишечном кровотечении. В терминальной стадии цирроза печени печеночно-почечный синдром развивается у 80% больных, однако основной причиной смерти является не почечная недостаточность, а печеночная кома.
Как уже указывалось, в основе гепаторенального синдрома лежит почечная вазоконстрикция, главным образом в наружном слое корковой зоны почек (наружная кортикальная ишемия). Как следствие этого, возникает резкое снижение почечного кровотока и гломерулярной фильтрации и дальнейшее уменьшение выделения натрия почками при нормальной способности к канальцевой реабсорбции.
Печеночно-почечный синдром проявляется постепенным нарастанием в плазме крови содержания креатинина (> 212 мкмоль/л) и мочевины (> 8,3 мкмоль/л, иногда до 33 мкмоль/л), олигурией (< 500 мл мочи за сут.) с резко сниженной натрийурией (< 20-12 ммоль в сут. при норме 120-220 ммоль) с последующими гиперкалиемией и метаболическим ацидозом. Анализ мочи, как правило, не изменен либо имеет место невысокая протеинурия. При гистоморфологическом исследовании изменения в почках отсутствуют. Больные жалуются на резкую астению, сонливость, апатию и анорексию. У них развиваются атония желудка и толстой кишки с тошнотой и рвотой, признаки клеточной дегидратации (жажда, гипотония глазных яблок, снижение тургора кожи) наряду с интерстициальной гипергидратацией (отеки, асцит), ортостатическая гипотония вследствие избыточной капиллярной вазодилатации и открытия артериовенозных шунтов, тремор, геморрагический диатез, часто спонтанно возникают обильные желудочно-кишечные кровотечения и печеночная кома.
При остром канальцевом некрозе, нередко осложняющем тяжелые острые и хронические заболевания печени, в отличие от гепаторенального синдрома, концентрация натрия мочи, как и при других органических заболеваниях почек, остается достаточно высокой: может быть > 40 ммоль, но всегда > 12 ммоль за сут. (соотношение осмолярность мочи и осмолярность плазмы < 1:1, при гепаторенальном синдроме — > 1:1). Важно также иметь в виду, что у 60-85% больных циррозом печени (чаще алкогольным) развивается нефропатия, обусловленная отложением в мезангии почечных клубочков иммуноглобулинов, в основном за счет IgA, в сочетании с С3 — компонентом комплемента, так называемая IgA-нефропатия. Это осложнение обычно протекает клинически латентно и не сопровождается хронической почечной недостаточностью или артериальной гипертонией. Однако у 1/4 больных отмечаются изменения мочи, соответствующие изменениям при гломерулонефрите или при нефротическом синдроме, в единичных случаях наблюдается массивная гематурия. Цирроз печени нередко может сочетаться с хроническим пиелонефритом.
Мера профилактики печеночно-почечного синдрома при циррозе печени — тщательное устранение факторов, которые могут способствовать гиповолемии: строгий контроль за применением диуретических препаратов, эвакуацией больших количеств асцитической жидкости при парацентезах, дозой нестероидных противовоспалительных средств, борьба с инфекционными осложнениями и экстренные мероприятия для остановки кровотечений.
При печеночно-почечном синдроме следует ограничить введение белка до 0,5 г/кг (при таком режиме отрицательный азотистый баланс не развивается), ионов натрия и воды до 800-1000 мл/сут., так как для больных с почечной недостаточностью свойственно резкое снижение способности выделять жидкость, вследствие чего развивается гипонатриемия разведения и гипоосмолярность плазмы. Эффективно введение 5% р-ра глюкозы, подавляющей распад белка, особенно при белковом голодании. Рекомендовано сочетать инфузии альбумина по 50 г каждые 2 ч и 20% р-ра маннитола по 150 мл каждые 2 ч и далее — назначение фуросемида и антагонистов альдостерона (спиронолактона). При отсутствии эффекта прибегают к назначению орнитин-вазопрессина (25 ЕД через 12 ч и допамина 100 мг через 12 ч). Если и эти лечебные мероприятия при печеночно-почечном синдроме оказываются неэффективными, необходима трансплантация печени или наложение трансюгулярного (трансшейного) внутрипеченочного портосистемного стент-шунта (TIPS). Ввиду того что аргинин, как составляющий компонент цитраргинина, является донатором оксида азота, его применение может усугубить почечную недостаточность при печеночно-почечном синдроме.
Асцит-перитонит
Асцит-перитонит относится к тяжелейшим осложнениям портальной гипертензии с отечно-асцитическим синдромом. Он развивается вследствие спонтанного инфицирования асцитической жидкости возбудителями кишечного происхождения или при парентеральном попадании инфекции в организм.
Бактериальные инфекции являются частыми осложнениями у пациентов с портальной гипертензией, особенно у больных с циррозом. Среди них спонтанный бактериальный перитонит является наиболее известным и часто встречающимся в клинической практике, так как он широко распространен и ассоциируется с высоким уровнем смертности. Патофизиология спонтанного бактериального перитонита не полностью ясна, но скорее всего он возникает в связи с переходом бактерий из кишечного просвета в мезентериальные брыжеечные лимфатические узлы — феномен известный как бактериальная транслокация, системная циркуляция бактерий и в конечном итоге — переход их в асцитическую жидкость.
Асцит-перитонит наблюдается у 7-8% больных декомпенсированным циррозом печени. Летальность при этом осложнении, достигающую 80-100%, можно значительно снизить при своевременном диагнозе и проведении срочной антибактериальной терапии.
При бактериологическом исследовании чаще всего высевают Е. albi, а также стрептококки, Klebsiella, стафилококки и протей. Характерными симптомами являются абдоминальная боль, болезненность при пальпации живота, лихорадка, парез кишок с исчезновением шума кишечной перистальтики, зачастую без симптомов раздражения брюшины, в гемограмме — лейкоцитоз. У больных с асцитом-перитонитом прогрессирующе нарастают явления печеночной энцефалопатии, часто развиваются сепсис, острые кровотечения из вен пищевода и желудка, гепаторенальный синдром. Асцитическая жидкость, полученная при диагностическом парацентезе, более чем у 70% больных мутная, содержит > 400 лейкоцитов в 1 мкл, 15-80% которых представлены полиморфно-ядерными лейкоцитами, повышена концентрация лактата в асцитической жидкости.
При асците-перитоните необходимо экстренное назначение антибиотиков широкого спектра действия после диагностической пункции живота для бактериологического исследования асцитической жидкости.
Спонтанный бактериальный перитонит является мономикробной инфекцией, как правило, вызываемой грамнегативными бактериями. Цефалоспорины третьего поколения являются одним из вариантов лечения для пациентов со спонтанным бактериальным перитонитом, хотя последние исследования дают основание считать, что хинолоны (офлоксацин, ципрофлоксацин) также весьма эффективны при пероральном применении. При употреблении этих антибиотиков излечиваются 80-90% пациентов. Несмотря на высокий уровень излечиваемости, смертность очень высока (20-40%), что оправдывает использование профилактических мер у пациентов, имеющих предрасположенность к этому виду осложнений. Определены несколько подгрупп больных циррозом печени, которые представляют более высокий риск для развития асцита-перитонита:
больные с желудочно-кишечными кровотечениями;
пациенты с низким содержанием белков в асцитической жидкости (< 1 г/л);
выздоровевшие после первого эпизода спонтанного бактериального перитонита.
Селективная желудочная деконтаминация при помощи норфлоксацина эффективна по предотвращению спонтанного бактериального перитонита у этих подгрупп пациентов.
Источник

