Мутация вируса гепатита в лечение
Мутации вируса гепатита В. Генетическая изменчивость ВГВМутантом (от лат. mutare — меняться) называют ген, хромосому, организм или популяцию, отличающуюся от соответствующего дикого типа одним или более генетическим изменением — мутацией. Мутация — это относительно устойчивое и передающееся по наследству изменение генетического материала, представляющее собой биохимическое изменение в кодоне или физическое изменение в межхромосомных взаимоотношениях. Мутации HBV в современной научной литературе описывают довольно часто. Установлено, что HBV подвержен более частым мутациям, чем предполагалось ранее, поскольку для его репликации необходима обратная транскрипция РНК-прегенома — процесс, при котором вероятность ошибок считывания весьма высока. Эта вероятность, как установлено, составляет 2×10-4 замен оснований на сайт в год, то есть на 4 порядка превышает частоту мутаций других ДНК-вирусов, хотя и не достигает частоты мутаций РНК вирусов. Наличие длинных участков делеций свидетельствует о присутствии и других механизмов мутагенеза. Это могут быть ошибки считывания на других этапах репликации, действие клеточной топоизомеразы и сплайсинг генов с альтернативными донорными и акцепторными сайтами. Мутации могут возникнуть также в результате рекомбинации между коинфицирующими штаммами. Мутации HBV не ограничиваются отдельными ОРС и происходят во всех генах вируса и регуляторных элементах. Среду мутантов HBV, выделяемых от пациентов как с острой (фульминантной), так и хронической инфекцией, различают 4 группы: мутанты генов pre-сorе и core, мутанты генов preS и S (поверхностных) белков, мутанты генов полимеразы/обратной транскриптазы и мутанты гена X. Нередко у одного пациента мутанты сосуществуют с вирусами дикого типа. Фактически слугаи инфекции с угастием мутантных штаммов вируса следует рассматривать как микст-инфекцию с разными исходными ДНК, взаимодействующими друг с другом путем trans-активации и рекомбинации.
Впервые мутанты HBV обнаружены у пациентов с хроническим гепатитом В, в крови которых выявляли вирусную ДНК на фоне отсутствия серологических признаков текущей или перенесенной инфекции (т. е. HBsAg и анти-HBs). Поскольку HBV может персистировать в организме в течение нескольких лет и даже десятилетий, мутации способны накапливаться и становиться клинически значимыми. Основными факторами, способствующими этому накоплению, являются: длительное время персистенции вируса, высокая скорость репликации вируса (с выбросом в периферическую кровь до 1011 вирусных частиц в день), иммунный пресс и пресс лекарственной терапии. Некоторые мутации способны влиять на специфику течения инфекционного процесса, эффективность диагностики, профилактики и лечения. Эти важные в практическом отношении влияния позволяют ввести классификацию соответствующих механизмов. Так, снижение скорости выведения вирусов из организма иммунной системой и возрастание устойгивости к лекарственной терапии называют, соответственно, «иммунным ускользанием» и «терапевтическим ускользанием». Мутации в генах, кодирующих белки оболочки вируса, способны привести к снижению возможностей диагностических систем по детекции вируса и даже его полной «необнаруживаемости» методами, основанными на применении антител к вирусу дикого типа («диагностигеское ускользание») или к нераспознаванию нейтрализующими антителами, индуцированными вакцинацией {«вакцинное ускользание»). Точечные мутации в S-гене представляют наибольший интерес для практического здравоохранения, поскольку они способны влиять на иммуногенность HBsAg и, особенно, его детерминанты а, к которой вырабатываются протективные антитела. Для того чтобы объяснить, как мутация в одном участке гена может влиять на структуру двух или более удаленных друг от друга эпитопов, была предложена новая модель большого гидрофильного региона (БГР) S-белка. Исходная модель детерминанты а белка S предполагала наличие двухпетлевой структуры в районе аминокислотных остатков 124-147 с дисульфидными мостиками между аминокислотными остатками 124 и 137. В соответствии с вновь предложенной моделью (36), которая не отрицает возможного наличия дисульфидных мостиков, большой гидрофильный регион белка S (аминокислотные остатки 100-160 или 169) рассматривают как паутиноподобную структуру, образованную цистеиновыми остатками в позициях 107, 137, 138, 139 и 149 и локализованную на наружной оболочке вириона. Пептидные петли, образованные аминокислотными остатками 107-137 и 139-147, формируют выступы на оболочке вириона, а еще одна плотная петля образована аминокислотными остатками 121-124. Весь БГР разделен на 5 антигенных регионов, названных HBsl (от начала до аминокислотного остатка 120), HBs2 (аминокислотные остатки 120-123), HBs3 (а. о. 124-137), HBs4 (а. о. 139-147) и HBs5 (а. о. 148-169). Имеются данные о том, что пептидные петли антигенных регионов HBs2 и HBs4 плотно примыкают друг к другу. — Также рекомендуем «Заражение гепатитом В после прививки. Иммунитет к вирусу гепатита В» Оглавление темы «Диагностика вирусных гепатитов»:
|
Источник
Гепатит В – это заболевание, которое вызывается вирусом гепатита В (HBV), оно распространено во всем мире. Вирус содержится во всех биологических жидкостях пациентов с острой или хронической инфекцией. При передаче вируса вертикальным (от матери к ребенку) или горизонтальным путем (между маленькими детьми во время игры) инфекционный процесс почти всегда становится хроническим.
Напротив, когда передача вируса происходит между подростками или взрослыми – обычно через сексуальные контакты, зараженные шприцы и менее часто при переливании элементов крови – инфекция обычно разрешается, если только пациент не иммуносупрессирован (например, имеет ВИЧ-инфекцию или заболевание крови). Важную роль в профилактике инфекции имеет образование населения и знания о том, каким образом можно избегать рискованных поведенческих схем и предотвратить инфицирование гепатитом.
- Работники здравоохранения в Израиле представляют собой группу повышенного риска инфицирования HBV, следовательно, они проходят вакцинацию перед приемом на работу.
- Каждый человек с хронической HBV- инфекцией должен думать о предотвращения новых случаев заболевания, поэтому необходимо уделять внимание образованию пациентов.
- Беременные женщины должны проходить скрининг на наличие гепатита В до родов, поскольку это помогает предотвратить появление следующего поколения, с хронической инфекцией HBV
Гепатит и цирроз
Пациенты с хронической HBV — инфекцией обладают повышенным риском развития цирроза печени, приводящего к декомпенсации функции печени и гепатоцеллюлярной карциноме (ГЦК), хотя у большинства пациентов она протекает благоприятно.
Мутации вируса гепатита
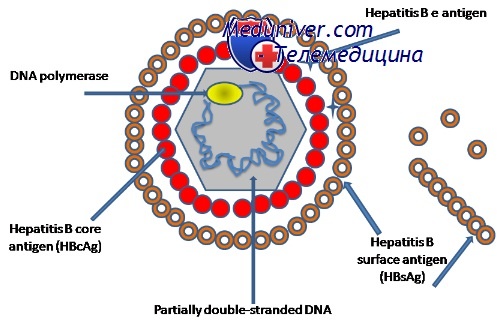
Увеличивающееся количество пациентов с хронической инфекцией приводит к развитию вариантов гепатита HBV (связанных с мутациями экспрессируют корового гена гепатита), которые не экспрессируют, или в малых количествах экспрессируют e-антиген (HBeAg). HBeAg-негативный гепатит В может потребовать длительной терапии в целях уменьшения прогрессирования заболевания, кроме того он характеризуется частыми рецидивами у не получающих лечение пациентов.
Существует различие между прекоровой мутацией и мутацией корового промотера. Распространение прекоровых мутаций наиболее выражено в Средиземноморских странах, часто встречается при генотипе D, в то время как мутации корового промотера чаще всего выявляются при генотипе С (на Дальнем Востоке и в Юго-Восточной Азии). Тем не менее, их клинические проявления одинаковы.
Лечение и вакцинация
В настоящее время идентифицировано семь генотипов вируса гепатита В, поэтому наши пациенты перед началом курса лечения при выявленом гепатите, проходят специфические тесты для выявления не только его серотипа, но и точного подвида гепатита B. В соответствии с полученными результатами назначается дальнейшее лечение — как правило, продолжительностью около года.
Сочетание таких факторов как распространенность инфекции, пути ее передачи и характеристики вируса имеет значение для стратегии вакцинации – группы риска, детская или подростковая популяция. Проведенные исследования позволяют предположить, что универсальная вакцинация сразу после рождения ребенка обладает хорошим коэффициентом «стоимости – эффективности». В Израиле вакцинация против гепатита В является обязательной и выполняется поэтапно у новорожденных.
Получить прайс клиники
Просто заполните форму, и наш медицинский консультант отправит вам персональное предложение!
Преимущества лечения в Израиле
Множество пациентов выбирают медицину Израиля за наши навыки, опыт, скорость обработки запроса и новейшие технологии. Наши пациенты получают лучшее лечение, потому что:
- Ежедневный консилиум, где хирурги, онкологи и другие эксперты обсуждают пациентов один за другим. Таким образом, каждый пациент получает персональные рекомендации, основанные на мнении нескольких врачей.
- Каждый пациент может попросить «второе мнение» — рассмотрение его документации врачом другой клиники.
- Новейшие компьютерные технологии 3D для замены костей, робот-ассистируемые операции, малоинвазивная хирургия и новейшие протоколы лечения.
- ПЭТ КТ и ПЭТ МРТ сканирование, точнейшие УЗИ и лабораторные тесты, лучшее в мире оборудование и огромный опыт его применения.
- Персональная медицина, четкая логистика визита и связь с врачом после выздоровления.
- Доступ к новаторскому лечению через наши исследования и клинические испытания.
- Персональный менеджер-переводчик, прозрачная финансовая отчетность, приглашение и план лечения до прилета в Израиль.
Источник
До недавнего времени гепатит С был внесен в список неизлечимых смертельных заболеваний. Болезнь носит скрытый характер, протекая от ремиссий к рецидивам. Некоторые врачи утверждают, что можно умереть с гепатитом С, а не от него. Но все же, стоит ли играть в русскую рулетку, и ждать сложнейших патологий, а именно ими грешит злосчастный вирус. Для борьбы с вирусом в наши дни предназначены специальные противовирусные препараты прямого действия – ингибиторы. За последние три года протоколы их лечения действительно показывают высокую эффективность лечения и практически отсутствие побочных действий.
Но спешить утверждать, что абсолютно все пациенты, принимающие дженерики, достигнут УВО (устойчивого вирусологического ответа) не стоит. Из 97% пациентов у 3% больных наблюдается мутация вируса и как следствие возврат вируса. Почему так происходит? Об этом ниже.
С чем связаны мутации вируса гепатита С
Учеными доказано, что официально в мире зарегистрировано 7 генотипов ВГС и 67 его подтипов. Но это далеко не все, из-за генетической мутации вируса не только нет возможности создать вакцину для борьбы с ним, а и в некоторых случаях добиться успешного протокола лечения.
Уже зафиксировано, что 3% случаев неэффективной терапии противовирусными препаратами нового поколения связаны с клиническими мутациями вируса. Чаще всего генетические мутации наблюдаются у следующих генотипов:
- 1а;
- 2а;
- 3а;
- 3b.
Наличие такого мутирующего гена приводит к резистентности препаратов, и даже если пациент впервые получает лечение, неудача не исключена. Исходя из клинических исследований обнаружена следующая закономерность генетических мутаций:
- генотип 2 – 58% случаев;
- генотип 3 – 34% случаев.
Исходя из этой информации необходимо подбирать адекватный протокол лечения. Именно поэтому пациентам не рекомендуют самостоятельно подбирать препараты для лечения гепатита С, опираясь на высказывания на форумах и советы других пациентов. Крайне опасна такая самодеятельность для пациентов с формированным циррозом печени, ведь времени на перелечивание попросту может не остаться.
Есть также случаи неудачной терапии ввиду сомнительного состава препаратов, приобретенных посредством интернета. К выбору поставщика также необходимо отнестись со всей ответственностью.
Принципы перелечивания гепатита С у пациентов с мутацией вируса
Итак, благодаря появлению на рынке новых препаратов позволяет пациентам с резистентностью к предыдущему протоколу лечения получит эффективное лечение и уничтожить вирус гепатита С.
Сменить протокол лечения позволяют следующие препараты:
- «Мавирет» — комбинация действующих веществ пибрентасвира и глекапревира;
- «Восеви» — комбинация веществ софосбувир+воксилапревир+велпатасвир.
Исходя из проведенных клинических испытаний данных препаратов, процент эффективности следующий:
- генотип 2 – 100%;
- генотип 3 – 98%.
Как видно из процентного соотношения, пациентам с мутациями генотипа 3 все же не удается добиться 100% эффективности терапии. Однако, не стоит отчаиваться, для достижения УВО таким пациентам рекомендуется следующее:
- добавить в протокол лечения «Рибавирин»;
- продлить протокол лечения до полугода, вместо положенных 3 месяцев.
Источник