Тромбоцитопения у больных гепатитом с
ТРОМБОЦИТОПЕНИЯ У БОЛЬНЫХ ХРОНИЧЕСКИМ ГЕПАТИТОМ С, ПОЛУЧАЮЩИХ КОМБИНИРОВАННУЮ ПРОТИВОВИРУСНУЮ ТЕРАПИЮ. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ. ОСОБЕННОСТИ ПАТОГЕНЕЗА
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Донцов Д.В.
1
Амбалов Ю.М.
1
Пройдаков М.А.
1
Коваленко А.П.
1
Усаткин А.В.
1
Левина Л.Д.
1
1 Ростовский государственный медицинский университет
Применение комбинированной противовирусной терапии позволяет добиться устойчивого вирусологического ответа у больных хроническим гепатитом С, однако у некоторых пациентов на фоне лечения развиваются побочные эффекты. Особое место среди нежелательных проявлений специфической терапии хронического гепатита С занимают гематологические синдромы. Формирование данных синдромов зависит от целого ряда факторов. В данной работе изучены некоторые особенности патогенеза тромбоцитопении, развивающейся у больных хроническим гепатитом С на фоне приема противовирусных препаратов. С этой целью нами был выполнен ряд высокоспециализированных исследований: автоматический гематологический анализ, электронная микроскопия клеток крови, определение уровня антитромбоцитарных ауто-IgG, концентрации эндогенного тромбопоэтина и ДНК полиморфизмов гена MPL. В общей сложности, в исследование было включено 228 пациентов, получающих комбинированную противовирусную терапию хронического гепатита С. Работа проводилась на базе кафедры инфекционных болезней РостГМУ.
хронический гепатит С
противовирусная терапия
тромбоцитопения
1. Adinolfi L.E., Giordano М.G., Аndгеаnа А. Hepatic fibrosis plays а central rоlе in the pathogenesis of thrombocytopenia in patients with chгonic viral hepatitis // Вr. Journal Наеmаtоlogy. – 2001. – Vol. 113. – pp. 590–595.
2. Afdhal N., McHutchison J., Brown R. Тhrombocytopenia associated with chronic liver disease // Journal Нераtоlogy. – 2008. – Vol. 48. – pp. 1000–1007.
3. Berry L., Irving W. Predictors of hepatitis C treatment response: what’s new? // Expert Review of Anti-infective Therapy. – 2014. – Vol. 12, no. 2. – pp. 183–191.
4. Flisiak R., Jaroszewicz J., Parfieniuk-Kowerda A. Emerging treatments for hepatitis C // Expert Opinion on Emerging Drugs. – 2013. – Vol. 18, no. 4. – pp. 461–475.
5. Hashemi N., Rossi S., Navarro V.J. Safety of peginterferon in the treatment of chronic hepatitis C // Expert Opinion on Drug Safety. – 2008. – Vol. 7, no. 6. – pp. 771–781.
6. Suarez A., Redmond D. Desired Social Distance From People Who Have Hepatitis C Virus: An Exploration Among Staff in Health Care, Dentistry, Drug Treatment, and Tattoo/Body Piercing // Substance Use & Misuse. – 2014. – Vol. 49, no. 4. – pp. 466–474.
7. Toyoda H., Kumada T. Pharmacotherapy of chronic hepatitis C virus infection – the IDEAL trial: ‘2b or not 2b (=2a), that is the question’ // Expert Opinion on Pharmacotherapy. – 2009. – Vol. 10, № 17. – pp. 2845–2857.
Хронический гепатит С (ХГС) является одним из наиболее распространенных инфекционных заболеваний человека [6]. Применение современной комбинированной противовирусной терапии (КПТ) ХГС позволяет добиться у многих пациентов полной элиминации возбудителя [3, 4, 5], однако, актуальной проблемой при этом остается развитие нежелательных явлений (НЯ), среди которых особое место занимают гематологические осложнения [1, 7]. Одним из наиболее серьезных гематологических синдромов у больных ХГС является КПТ-ассоциированная тромбоцитопения, развитие которой значительно увеличивает риск возникновения состояний, угрожающих жизни пациентов [1, 2]. К сожалению, многие стороны патогенеза данного НЯ этиотропного лечения хронической HCV-инфекции остаются практически не изученными.
Цель исследования – детально изучить патогенез и клинические проявления КПТ-ассоциированной тромбоцитопении у больных ХГС.
Материалы и методы исследования
В исследование было включено 228 больных ХГС, имевших показания к КПТ. Генотип HCV 1a встречался у 3,5 %, 1b – 51,3 %, 3а – 28,9 % и 2а – 16,2 % человек. Уровень вирусной нагрузки (ВН) у 30,3 % пациентов составил < 3×105 МЕ/мл, у 46,1 % – 3×105 – 6×105 МЕ/мл и у 23,7 % > 6×105 МЕ/мл. Всем испытуемым была назначена КПТ согласно современным международным стандартам. 51,3 % пациентов получали рибавирин в сочетании с пегилированными α-интерферонами (пег-ИНФ-α), 48,7 % – в сочетании с «короткими». В ходе работы наблюдаемым лицам был выполнен ряд высокоспециализированных исследований. Определение показателей гемограммы проводилось методом автоматического гематологического анализа («Advia 2120i» (Siemens)) непосредственно перед началом КПТ, через 4, 8, 12, 24 и 48 (лица, инфицированные 1-м генотипом HCV) недель КПТ. Внутриклеточная ультраструктура тромбоцитов ПК изучалась с помощью трансмиссионной электронной микроскопии на просвечивающем электронном микроскопе «Tecnai G2 Spirit BioTWIN» (Philips, Нидерланды). Уровень человеческого тромбопоэтина (THPO) исследовали методом твердофазного ИФА с использованием набора реактивов Human Thrombopoietin Quantikine ELISA Kit (R&D Systems, США) на спектрофотометре xMark (Bio-Rad, США). Определение антител к поверхностным антигенам (GP IIa-IIIb) базальной мембраны тромбоцитов в сыворотке крови осуществляли путем постановки реакции непрямой иммунофлюоресценции. При этом использовались диагностические наборы «Thrombocytes IIFT» (EUROIMMUN AG, Германия) с меченными ФИТЦ вторичными антителами к антитромбоцитарным IgG человека. Характер флуоресцентного свечения оценивался на микроскопе Olympus СХ41 (Япония). Результат реакции выражался в титрах. Перечисленные выше методы исследования проводились дважды: перед началом и сразу после завершения или вынужденного прекращения КПТ. Помимо этого у испытуемых лиц методом «ПЦР в реальном времени» было выполнено изучение однонуклеотидных ДНК-полиморфизмов (SNP) гена рецептора тромбопоэтина MPL, в частности частота точковых мутаций W515L/K (rs121913615/121913616). Для генотипирования SNP использовали аллель-специфичные зонды наборов реагентов «SNP-Скрин» (Синтол, РФ). Заключительным этапом явился тщательный статистический анализ полученных результатов, который был выполнен после полного завершения клинико-лабораторно-инструментального мониторинга всех пациентов.
Результаты исследования и их обсуждение
В результате проведенного лечения УВО в общей сложности был достигнут у 155 (68,0 %) пациентов, из них 64 (41,3 %) были инфицированы 1-м; 34 (21,9 %) – 2-м и 57 (36,8 %) – 3-м генотипами HCV. Среди получавших пег-ИФН-α-2а (n = 117) частота УВО составила 54,7 % (n = 64); получавших «короткие» ИФН-α (n = 111) – 82,0 % (n = 91). У больных, инфицированных 1-м генотипом HCV (n = 125), УВО отмечался в 51,2 % (n = 64) случаев; у инфицированных 2-м (n = 37) и 3-м (n = 66) генотипами HCV – в 91,9 % (n = 34) и 86,4 % (n = 57) случаев соответственно. Проведение КПТ прекращалось при отсутствии через 12 недель лечения РВО и/или развитии у пациентов тяжелых НЯ противовирусной терапии. В итоге, из 228 больных ХГС полностью закончили курс КПТ 163 человека (71,5 %). У 8 пациентов (3,5 %) терапия была отменена уже через 8 недель лечения исключительно по причине развития тяжелых гематологических осложнений КПТ. У 57 больных ХГС (25,0 %) было зафиксировано отсутствие РВО, причем у 9 из них (3,9 %) параллельно наблюдалось развитие к 12-й неделе КПТ тяжелых осложнений со стороны системы крови, также требовавших отмены терапии.
При изучении степени тяжести КПТ-ассоциированной тромбоцитопении нами была использована классификация Всемирной организации здравоохранения, согласно которой выделяют легкую (Тр 150–75×109/л), умеренную (Тр 74–50×109/л) и тяжелую (Тр < 50×109/л) степени тромбоцитопении. В результате было установлено, что на разных этапах КПТ тромбоцитопения в общей сложности развилась у 30,3 % пациентов, при этом легкая степень отмечалась у 16,2 %; умеренная – у 10,5 % и тяжелая – у 3,5 % больных ХГС.
Объективные изменения в виде геморрагий в местах инъекций, появления петехиальной сыпи на нижних конечностях, частых носовых кровотечений, гематурии были выявлены исключительно у лиц с умеренной и тяжелой степенью тромбоцитопении. У 21,4 % пациентов, начиная с 20 недели КПТ, было зафиксировано развитие спленомегалии.
Легкая степень тромбоцитопении через 4 недели КПТ была зафиксирована у 8,3 %, через 8 недель – у 11,8 %, через 12 – у 15,0 %, через 24 – у 29,4 % и через 48 (пациенты с 1-м генотипом HCV) – у 34,8 % больных ХГС. Умеренная степень тромбоцитопении через 12 недель КПТ отмечалась у 1,4 % больных ХГС, через 24 недели – у 8,0 % и через 48 недель – у 11,1 % пациентов. Развитие тромбоцитопении тяжелой степени было выявлено у 3,6 % больных ХГС через 12 недель лечения, совпав при этом с отсутствием РВО у данной категории лиц (табл. 1).
Все участники исследования в зависимости от минимального количества тромбоцитов, зафиксированного у каждого пациента за весь период КПТ (Трmin), были разделены на три группы. В 1-ю группу (n = 159) вошли лица, у которых Трmin на протяжении КПТ оставался в пределах допустимой нормы, т.е. > 150×109/л. 2-я группа (n = 37) включала больных ХГС с легкой степенью КПТ-ассоциированной тромбоцитопении: Трmin в пределах 75–150×109/л. 3-ю группу (n = 32) составили лица с умеренной и тяжелой степенью тромбоцитопении: Трmin < 75×109/л. Средний показатель Трmin в 1-й группе оказался равен 176,03 ± 2,77; во 2-й – 127,89 ± 3,45 и в 3-й – 64,69 ± 2,03×109/л.
Проведенный корреляционный анализ позволил установить наличие умеренной обратной ассоциативной связи между Трmin и такими исходными показателями пациентов как возраст, индекс массы тела (ИМТ), величина ВН и индекс фиброза (ИФ), что же касается количества Тр перед началом КПТ, то в данном случае была получена сильная прямая ассоциативная связь (табл. 2).
Таблица 1
Характер распределения больных ХГС в зависимости от количества тромбоцитов перед началом КПТ, через 4, 8, 12, 24, 48 недель от начала КПТ и через 24 недели после окончания КПТ
Тр. (×109/л) | Абсолютное (n) и относительное (%) число больных ХГС | ||||||
перед КПТ (n = 228) | 4 недели КПТ (n = 228) | 8 недель КПТ (n = 228) | 12 недель КПТ (n = 220) | 24 недели КПТ (n = 163) | 48 недель КПТ (n = 72) | 24 недели после КПТ (n = 221) | |
> 150 | 225 (98,7 %) | 209 (91,7 %) | 201 (88,2 %) | 176 (80,0 %) | 102 (62,6 %) | 39 (54,1 %) | 209 (94,6 %) |
150–75 | 3 (1,3 %) | 19 (8,3 %) | 27 (11,8 %) | 33 (15,0 %) | 48 (29,4 %) | 25 (34,8 %) | 12 (5,4 %) |
75–50 | 3 (1,4 %) | 13 (8,0 %) | 8 (11,1 %) | ||||
< 50 | 8 (3,6 %) | ||||||
Таблица 2
Характер корреляционных связей Трmin с возрастом, ИМТ, количеством Тр, величиной ВН и ИФ перед КПТ у наблюдаемых нами больных ХГС
Исследуемый показатель | Возраст пациентов | ИМТ перед КПТ | Количество Тр перед КПТ | ВН перед КПТ | ИФ перед КПТ | |||||
r | p | r | p | r | p | r | p | r | р | |
Трmin | -0,28 | < 0,01 | -0,31 | < 0,01 | 0,65 | < 0,01 | -0,35 | < 0,01 | -0,27 | < 0,01 |
На старте КПТ среди пациентов 3-й группы в сравнении с 1-й и 2-й преобладали лица старше 40 лет, имеющие ИМТ > 25 и ИФ F2-3 (р < 0,05). Перед началом КПТ средний показатель количества Тр в 1-й группе больных ХГС составил 260,83 ± 3,96; во 2-й – 218,46 ± 5,73 и в 3-й – 180,78 ± 3,76 ×109/л (во всех случаях р > 0,05). Уже через 4 недели терапии отмечалось достоверное снижение среднего показателя количества Тр у пациентов всех групп (р > 0,05), минимальные же значения данного показателя были зафиксированы в период с 24-й по 48-ю недели КПТ. В целом же, наиболее выраженные изменения на всех этапах лечения отмечались в 3-й группе больных ХГС (р < 0,05). Что касается среднего объема Тр, то в процессе КПТ отмечалось статистически значимое (р < 0,05) повышение среднего показателя MPV, наиболее выраженного опять-таки у пациентов 3-й группы.
В ходе исследования во всех сравниваемых группах были выявлены пациенты с разнообразными структурными дефектами как цитоплазматической мембраны тромбоцитов (участки локального разрыхления, патологические выпячивания, микро- и макровезикулобразование), так и их стромы (образование полостей и эндовезикул, гипертрофия грануломера, отек и набухание митохондрий) (рис. 1, 2).
Как показал сравнительный анализ, на старте лечения в 3-й группе пациентов гораздо чаще встречались лица с вышеуказанными дефектами. После завершения КПТ удельный вес больных ХГС с выявленными структурными изменениями тромбоцитов либо имел тенденцию к снижению, либо достоверно снижался во всех группах (р < 0,05), оставаясь, тем не менее, наиболее высоким в 3-й группе.
Что касается уровня антитромбоцитарных антител, то в 1-й и 2-й группе пациентов перед началом КПТ были обнаружены лица с отсутствием, а также с низким и умеренным уровнем IgG к поверхностным антигенам GP IIa-IIIb, при этом существенных отличий их удельного веса между данными группами зафиксировано не было. В 3-й же группе больных ХГС статистически более высоким оказалось относительное количество пациентов с низким и умеренным уровнем антитромбоцитарных IgG. После КПТ в 1-й группе удельный вес пациентов с выявленным уровнем антитромбоцитарных IgG существенно не изменился, во 2-й – достоверно повысился удельный вес больных с умеренным, а в 3-й – с высоким уровнем антитромбоцитарных IgG, кроме того, в 3-й группе отмечалось появление пациентов с крайне высоким уровнем антитромбоцитарных IgG.
Средний показатель уровня THPO перед началом КПТ в 1-й группе наблюдаемых нами лиц составил 24,43 ± 1,1 пг/мл, во 2-й – 25,77 ± 0,97 пг/мл, в 3-й же группе данный показатель оказался достоверно выше – 29,08 ± 1,01 пг/мл (р < 0,05). После окончания КПТ средний уровень THPO статистически значимо повысился лишь в 1-й и 2-й группах, тем самым достоверно превысив таковой у пациентов 3-й группы.
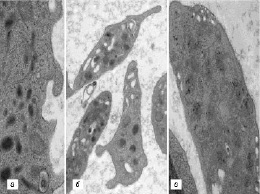
Рис. 1. Признаки деструкции плазмолеммы тромбоцитов, выявленные у наблюдаемых пациентов. Трансмиссионная электронная микроскопия: а – локальные участки истончения и разрыхления (×58 000); б – патологические выпячивания плазмолеммы (×22 000); в – образование микро- и макровезикул (×36 000)
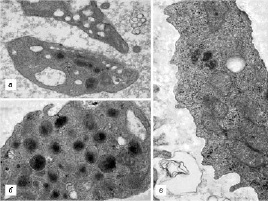
Рис. 2. Признаки деструкции цитоплазмы тромбоцитов, выявленные у наблюдаемых пациентов. Трансмиссионная электронная микроскопия: а – тромбоциты с множественными эндовезикулами (×22 000); б – гипертрофия грануломера (×44 000); в – отек и набухание митохондрий (×38 000)
Частота встречаемости точковой мутации W515L (rs121913615) гена MPL в 1-й группе больных ХГС составила 27,8 ± 7,5 % пациентов, во 2-й группе – 22,6 ± 7,5 % и наконец в 3-й – 71,9 ± 7,9 % человек, что оказалось значительно выше нежели у пациентов первых двух групп (р < 0,001). Совсем иная ситуация складывалась с мутацией W515K (rs121913616), в данном случае «мутантный» генотип был зафиксирован в 1-й и во 2-й группах больных ХГС в 16,7 ± 6,2 %, и 16,1 ± 6,6 % случаев соответственно (р > 0,05), в 3-й же группе данная мутация выявлена не была.
Выводы
- Степень выраженности КПТ-ассоциированной тромбоцитопении у больных ХГС определена целым рядом факторов, среди которых можно выделить как непосредственное действие HCV, так и индивидуальные характеристики самого пациента.
- Перед началом противовирусного лечения у больных ХГС имеются разнообразные ультраструктурные дефекты мембраны и стромы эритроцитов, которые, вполне возможно, могут играть важную роль в развитии КПТ-ассоциированной тромбоцитопении.
- В патогенезе КПТ-ассоциированной тромбоцитопении существенное место занимает повышение уровня антитромбоцитарных аутоантител к поверхностным антигенам GP IIa-IIIb.
- В процессе антивирусной терапии у лиц с отсутствием или же легкой степенью КПТ-ассоциированной тромбоцитопении происходит компенсаторное увеличение выработки эндогенного THPO, что вполне обеспечивает адекватный уровень тромбоцитопоэза у данной категории лиц.
- Развитие у больных ХГС средней и тяжелой степени КПТ-ассоциированной тромбоцитопении ассоциируется с высокой частотой точковой мутации W515L (rs121913615), происходящей в структуре гена MPL, ответственного, как известно, за синтез R эндогенного THPO.
Рецензенты:
Николаев Б.Ф., д.м.н., МЛПУЗ «ГБ № 1 им. Н.А. Семашко», г. Ростов-на-Дону;
Яговкин Э.А., д.м.н., Ростовский научно-исследовательский институт микробиологии и паразитологии министерства здравоохранения РФ, г. Ростов-на-Дону.
Работа поступила в редакцию 07.08.2014.
Библиографическая ссылка
Донцов Д.В., Амбалов Ю.М., Пройдаков М.А., Коваленко А.П., Усаткин А.В., Левина Л.Д. ТРОМБОЦИТОПЕНИЯ У БОЛЬНЫХ ХРОНИЧЕСКИМ ГЕПАТИТОМ С, ПОЛУЧАЮЩИХ КОМБИНИРОВАННУЮ ПРОТИВОВИРУСНУЮ ТЕРАПИЮ. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ. ОСОБЕННОСТИ ПАТОГЕНЕЗА // Фундаментальные исследования. – 2014. – № 10-1. – С. 59-63;
URL: https://fundamental-research.ru/ru/article/view?id=35214 (дата обращения: 23.05.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Cтатьи и Публикации Инфекционные заболевания ТРОМБОЦИТОПЕНИИ ПРИ ВИРУСНОМ ГЕПАТИТЕ С И ВОЗМОЖНОСТИ ЕЁ КОРРЕКЦИИ МНФК “ГРИНИЗАЦИЯ”
ТРОМБОЦИТОПЕНИИ
ПРИ ВИРУСНОМ ГЕПАТИТЕ С
И
ВОЗМОЖНОСТИ ЕЁ КОРРЕКЦИИ МНФК “ГРИНИЗАЦИЯ”
© Печенка
А.М., Голубовская О.А.
Контакт с автором: ppsss@i.ua
Национальный
медицинский институт им. А.А. Богомольца
МОЗ Украины, г.
Киев
Аннотация
В
статье приведены данные о возможных
механизмах развития тромбоцитопении у
больных вирусным гепатитом С и связанные с
этим трудности лечения таких пациентов.
Сделан акцент на отсутствие в настоящее
время препаратов для повышения уровня
тромбоцитов, что делает невозможной
специфическую противовирусную терапию, или
очень снижает её эффективность. Приведены
данные наблюдения стабилизации уровня
тромбоцитов у некоторых больных вирусным
гепатитом С с помощью МНФК “Гринизация”.
______________________________________________________
Ключевые слова:
метаболический синдром, вирусный гепатит,
тромбоцитопения, Гринизация.
ВВЕДЕНИЕ
Тромбоцитопении
при вирусном гепатите С имеют несколько
механизмов развития, являются одним из
внепеченочных проявлений заболевания и
являютися серьезным препятствием к
назначению специфической противовирусной
терапии, либо причиной прерывания начатого
лечения. Последнее крайне нежелательно,
особенно у больных с 1 генотипом вируса, т.к.
несвоевремено прерванное лечение не только
снижает эффективность ПВТ, но и
способствует формированию новых, еще более
устойчивых к терапии квазивидов вируса (1,2).
На сегодняшний день в нашей стране
отсутствуют зарегистрированные
тромбопоэтины, а за рубежем имеющиеся
препараты этой группы только начинают
линические исследования, связанные с
гепатитом С.
Причина развития тромбоцитопении при ХВГС
до конца не изучена. В организме человека
тромбоциты выполняют ряд функций. Прежде
всего это участие в немедленном гемостазе,
местное выделение вазоконстрикторов,
катализ реакций гуморальной системы
свертывания крови, инициирование репарации
тканей, регуляция местной воспалительной
реакции и иммунитета, клиренс иммунных
комплексов (3).
Схематично
тромбоцитопоэз можно представить в
следующем виде:
промегакариоцит
мегакариоцит
тромбоцит
Таким образом, “гиганты
красного костного мозга (промегакариоцит и
мегакариоцит) дают карликов крови” —
тромбоциты представляют собой маленькие
безъядерные элементы крови.
Основные причины
возникновения тромбоцитопении у больных с
вирусным гепатитом С можно разделить на
следующие группы (2,3,4):
- Гиперспленизм —
- Уменьшение продукции
тромбопоэтинов. - Иммуноопосредованный
клиренс тромбоцитов. - Действие вируса на
клетки-предшественники тромбоцитопоэза,
в частности, мегакариоциты. - Тромбоцитопения,
связанная с лечением альфа-интерферонами.
повышение
функции селезенки, чаще на фоне ее
увеличения. Селезенка в организме
выполняет две основные функции –
тормозящее действие на костный мозг и
ускорение гибели старых кровяных клеток
путем их фагоцитоза. Основными
клиническими проявлениями гиперспленизма
являются различные цитопении (лейкопения
с нейтропенией, эритропения,
тромбоцитопения, реже – негемолитическая
анемия, панцитопения). Явления
гиперспленизма могут возникать как
следствие всех форм спленомегалии, однако
отсутствие увеличения селезенки не
является исключением гиперспленизма.
Диагноз устанавливается на основании
характерной клинической картины, а также
обнаружением в пунктате костного мозга
нормального либо чуть повышенного
количества мегакариоцитов (5).
.
При тяжелых
диффузных поражениях печени возможно
угнетение продукции стимуляторов
тромбоцитопоэза, в частности,
тромбопоэтина (4,5)
Хорошо
известна связь тромбоцитопении с
воздействием различных вирусов. Известна
ассоциация тромбоцитопении с ВИЧ, у детей
до 70% тромбоцитопений связано с
предшествующими инфекциями – ветряная
оспа, корь и т.д. Предполагается, что вирусы
изменяют антигенную структуру
тромбоцитов как в результате
взаимодействия с мембранными белками (гликопротеинами),
так и вследствие ненепосредственной
фиксации на поверхности тромбоцитов. В
результате происходит выработка антител
против измененных тромбоцитарных
гликопротеинов, либо перекрестное
взаимодействие собственно
противовирусных антител с фиксированными
на тромбоцитах вирусными частицами.
Впервые связь ВГС-инфекции с
тромбоцитопенией была обнаружена, когда
удалось в отмытых эритроцитах обнаружить
РНК ВГС. При этом связывание вируса с
тромбоцитами может индуцировать либо
формирование новых антигенов на
поверхности тромбоцита, либо изменять
конформацию тромбоцитарных
гликопротеинов. И то и другое приводит к
образованию антитромбоцитарных антител
(2,,5,6).
Доказана
репликация вируса в клетках-предшественниках
тромбоцитопоэза, в частности,
мегакариоцитах (5).
Лекарственная
тромбоцитопения может быть вызванасамыми
разными препаратами, в т.ч. интерферонами.
Основной механизм развития —
разрушение тромбоцитов комплементом,
который активируется реакцией препарата с
антителами против него. Препарат,
вызвавший тромбоцитопению, отменяют,
после чего уровень тромбоцитов
нормализуется за несколько суток (5,6)
Для коррекции
тромбоцитопении у больных ХВГС в Украине
предложены препараты мультинутриентного
функционально-пептидного комплекса (МНФК),
относящиеся к группе биологически активных
добавок. Получают препараты путем
переработки природного сырья (перепелиное
мясо, спирулина, кумыс, зародыши пшеницы и
др.) с помощью специальной технологии “Grinization”.
Это оригинальный принцип
низкотемпературной многоступенчатой
переработки, который позволяет разделять и
концентрировать пептидные фракции,
витамины, ферменты в природной
конфигурации. Они представлены двумя
формами – жидкой (Грин Микс) и сухой (Грин
Про).
МАТЕРИАЛЫ И
МЕТОДЫ ИССЛЕДОВАНИЯ
В клинике кафедры
инфекционных болезней Национального
медицинского университета в 2007-2008 году
находилось под наблюдением 31 больной с ХВГС,
имеющих тромбоцитопению до начала
проведения ПВТ, причем 12 из них – с
рецидивом заболевания после ПВТ. Уровень
тромбоцитов колебался от 28х10 6 /л до 141х10
6 /л (среднее значение тромбоцитов
составило 99,4 6±8,5).
РЕЗУЛЬТАТЫ И ИХ
ОБСУЖДЕНИЕ
Распределение
больных в зависимости от генотипа вируса
представлено на следующей диаграмме.
Рис.1. Удельный вес
больных ХВГС и тромбоцитопенией с
различными генотипами вируса, %.
1-генотип
наблюдался у 19 больных (61,3%), 3 генотип – у 10
(32,2%) больных и у 2 (6,5%) – 2 генотип вируса. У
7(22,6%) больных наблюдались клинические
признаки компенсированного цирроза печени.
Все пациенты до проведения ПВТ получали
препарат Грин-Микс и Грин-Про в стандартных
дозировках с целью стабилизации уровня
тромбоцитов. Курс лечения препаратом в
среднем составил 12 недель.
Повышение уровня
тромбоцитов наблюдалось у всех больных без
признаков цирроза печени и у 4(57,2%) больных с
признаками цирроза печени. Максимальный
клинический эффект наблюдался в течение
первых 2-х недель от начала приема препарата.
После проведения курса терапии уровень
тромбоцитов оставался в пределах
нормальных величин в течение 24 недель
наблюдения.
У больных с
признаками компенсированного цирроза
печени эффект был достигнут более чем в
половине случаев, однако после прекращения
применения препарата отмечалась вновь
склонность к тромбоцитопении.
При применении
препаратов отмечены следующие
закономерности:
- чем ниже изначальное
количество тромбоцитов, тем более
выраженное было их повышение при приеме
препаратов группы “Гринизация” (например,
27 х10 6 /л → 280 х10 6 /л); - у больных с
клиническими признаками цирроза печени
наблюдался менее выраженный
клинический эффект; - полученный эффект не
зависел от генотипа вируса гепатита С.
ВЫВОДЫ
●
Тромбоцитопения является важным фактором,
препяствующим начать ПВТ у больныхс ХВГС.
● Для
стабилизации уровня тромбоцитов до начала
ПВТ хорошо зарекомендовали препараты
группы “Гринизация.
● Действие
препарата не зависит от генотипа вируса
гепатита С, но зависит от наличия цирроза
печени.
● Действие
препарата на фоне ПВТ требует дальнейшего
изучения.
Литература.
- Т.М. Игнатова, З.Г.
Апросина, В.В. Серов, и др.
Внепеченочные проявления хронической HCV-инфекции
// РМЖ. — 2001. — № 2: — С. 13—18. - М.В. Маевская
- Ш. Шерлок, Дж. Дули
- Freeman AJ, Marinos G, Ffrench RA, Lloyd
AR
– Тромбоцитопения на старте
противовирусной терапии хронического
гепатита С. – Материалы конференции “Гепатология
сегодня”, Москва, 19-22 апреля 2007 года.
.
Заболевания печени и желчных путей. М.,
Гэотар Медицина, 1999
.
Immunopathogenesis of hepatitis C virus infection. Immunol
Cell Biol 2001;79:515-536
Дополнение к
статье
Выдержка из
Методических рекомендаций МОЗ Украины,
“Мультинутриентный
функционально-пептидный
комплекс “Гринизация” в клинической
практике”, с. 23, 2010г.
Алгоритм
применения
МНФК
“Гринизация” (Грин Микс и Грин
Про) у больных ХВГС
при проведении противовирусной терапии
Вариант 1.
Больным
при отсутствии изменений количества
тромбоцитов во время проведения
противовирусной терапии рекомендуют
профилактические дозы Гринизации. При
умеренном уменьшении количества
тромбоцитов дозу Гринизации увеличивают.
Вариант 2. Больным
при незначительном уменьшении количества
тромбоцитов в крови (не меньше 100х109 в 1 в л)
во время проведения противовирусной
терапии рекомендуют средние дозы
Гринизации. При отсутствии тенденции к
уменьшению количества тромбоцитов дозу
уменьшают до профилактической.
Вариант 3. Больным
при значительном уменьшении количества
тромбоцитов в крови (70 — 90х109 в 1 в л) перед
проведением противовирусной терапии в
течение 14 суток рекомендуют применение
высоких доз Гринизации до увеличения
количества тромбоцитов к 100х109 в 1 в л и
больше. На весь период проведения
противовирусной терапии рекомендуют
назначать Гринизацию в средней дозе. При
условии стабилизации количества
тромбоцитов можно перейти на
профилактические дозы.
Вариант 4. Больным,
у которых количество тромбоцитов
уменьшилось до 80х109 в 1 в л и меньше, не
отменяя противовирусную терапию, назначают
Гринизацию в высокой дозе. При увеличении
количества тромбоцитов продолжают лечение
на фоне применения Гринизации в высоких
дозах. При стабильно допустимом количестве
тромбоцитов (в пределах 100-150х109 в 1 в л) дозу
Гринизации уменьшают до средней. При
появлении тенденции к уменьшению
количеству тромбоцитов — дозу увеличивают.
Положительное
влияние Гринизации на количество
тромбоцитов предопределено,
иммуномодулирующим, цитопротекторным,
антиоксидантным и апоптозмодулирующим
действием биологически активных
компонентов мультинутриентного комплекса.
ДОЗЫ И РЕЖИМ
УПОТРЕБЛЕНИЯ МУЛЬТИНУТРИЕНТНОГО
ФУНКЦИОНАЛЬНО-ПЕПТИДНОГО КОМПЛЕКСА
ГРИНИЗАЦИЯ
Дозы и
длительность применения “Гринизация Микс”
и “Гринизация Про” зависит от цели
назначения, нозологии, массы тела, пола и
возраста.
Минимальная доза
Грин Микс — от 5 до
10 мл
в
сутки
Грин Про — от 3-4 до 7
или от 2,5 до 5 г порошка
в
сутки.
Средняя доза
Грин Микс — 15 мл
в
сутки
Грин Про — 10 капсул
или 7 г порошка
в
сутки.
Высокая доза
(Как правило,
используется порошковая форма Грин Про)
Как лечебное
питание при тяжелых инфекциях, истощени
и,
ожогах, травмах
и других тяжелых состояниях,
а также при проведении лучевой терапии,
химиотерапии: Грин Микс — от 25 до 33 мл, Грин
Про — от 12 до 16 г в
сутки.
При тяжел
ых
состояниях дозу можно увеличивать Грин
Микс — до 50 мл на сутки, Грин Про — до 25 г в
сутки. Длительность применения 1-2 месяца с
дальнейшим уменьшением дозы на 1-2 мес.
При
значительном истощении, высоких
показателях активности воспалительного
процесса в печени, тяжелой интоксикации во
время проведения химиотерапии дозу Грин
Микс можно увеличить до 100 мл в сутки, Грин
Про — до 50 г в сутки (т. е., практически
до
суточной потребности организма в белках).
Медико-биологическое
сопровождение программы “GRINIZATION”® в
Украине осуществляет Институт Здоровья
Нации. Подробнее о методе “ГРИНИЗАЦИЯ”®
можно узнать на веб-сайте www.izn.com.ua
Дата публикации: 7 ноября 2010
Источник: SciTecLibrary.ru
Вы можете оставить свой комментарий по этой статье или прочитать мнения других в
следующих разделах ФОРУМА:
Точные науки и дисциплины |
Дебаты по Теории Относительности Эйнштейна. Все кому не лень хотят опровергнуть Теорию Относительности Эйнштейна. Вам предоставляется слово для аргументации. |
| Физика, астрономия, математические решения. Физико-математические вопросы, наблюдения, исследования, теории и их решение. |
| Физика альтернативная. Новые взгляды на физические законы, теории, эксперименты, не вписывающиеся в общепринятые законы физики. |
Teхника, узлы, механизмы, электроника и аппаратура. Все про технику, приборы, детали, узлы и механизмы. Электроника, компьютеры, программное обеспечение. Новые технические решения в самых разных областях. |
| Биология, Генетика, Все о жизни. Генетика и другие вопросы биологии. Их развитие. Медицина. Биотехнологии, агротехника и сельское хозяйство. Эволюционные теории и альтернативные им. |
| Химия. Вопросы по химическим технологиям, разработкам и применению химических материалов. Химические элементы и их свойства. |
| Геология, все о Земле и ее обитателях. Геология, метеорология, антропология, сейсмология, атмосферные явления и непознанные эффекты природы. |
Хотите разместить свою статью или публикацию, чтобы ее читали все?
Как это сделать — узнайте здесь.
Назад
| О проекте | Контакты | Архив старого сайта | Copyright © SciTecLibrary © 2000-2017 Агентство научно-технической информации Научно-техническая библиотека SciTecLibrary. Свид. ФС77-20137 от 23.11.2004. |
Источник


