Жизненный цикл вируса гепатит в
Âèðóñíûé ãåïàòèò Â
Ãåïàòèò  èíôåêöèîííîå çàáîëåâàíèå ÷åëîâåêà, õàðàêòåðèçóþùååñÿ èçáèðàòåëüíûì ïîðàæåíèåì ïå÷åíè âèðóñîì. Ýòà ôîðìà ãåïàòèòà ÿâëÿåòñÿ íàèáîëåå îïàñíîé ïî ñâîèì ïîñëåäñòâèÿì ñðåäè âñåõ èçâåñòíûõ ôîðì âèðóñíûõ ãåïàòèòîâ. Åãî âîçáóäèòåëåì ÿâëÿåòñÿ âèðóñ ãåïàòèòà  (HBV).
Âïåðâûå àíòèãåí âèðóñà ãåïàòèòà  áûë îáíàðóæåí Á. Áëþìáåðãîì â 1964 ã. â ñûâîðîòêå êðîâè àâñòðàëèéñêîãî àáîðèãåíà, à ñàì âîçáóäèòåëü áûë îáíàðóæåí â 1970 ã. Ä. Äåéíîì [è äð.] è ïîëó÷èë íàçâàíèå ÷àñòèö Äåéíà, ïîñêîëüêó íå áûëî ïîëíîé óâåðåííîñòè â òîì, ÷òî ýòî äåéñòâèòåëüíî âèðóñ, à íå åãî êîìïîíåíòû.  ïîñëåäóþùåì âñå ñîìíåíèÿ îòïàëè, òàê êàê â ñîñòàâå ÷àñòèö Äåéíà áûëè îáíàðóæåíû ãåíîìíàÿ ÄÍÊ è âèðóñíàÿ ÄÍÊ-çàâèñèìàÿ ÄÍÊ-ïîëèìåðàçà.  ñîñòàâå âèðèîíà èìåþòñÿ òðè îñíîâíûõ àíòèãåíà, äëÿ êîòîðûõ â 1974 ã. áûëè ââåäåíû ñëåäóþùèå îáîçíà÷åíèÿ:
1. HBsAg ïîâåðõíîñòíûé (superficial), èëè ðàñòâîðèìûé (soluble), èëè àâñòðàëèéñêèé àíòèãåí.
2. HBcAg ñåðäöåâèííûé àíòèãåí (ñor-àíòèãåí).
3. HBeAg àíòèãåí e, ëîêàëèçîâàí â ñåðäöåâèíå âèðèîíà è, â îòëè÷èå îò HBcAg, íå òîëüêî ïðèñóòñòâóåò â ñîñòàâå âèðèîíà, íî è öèðêóëèðóåò â êðîâè â ñâîáîäíîì âèäå èëè â âèäå êîìïëåêñà ñ àíòèòåëîì àíòè-HBeAg. Îí âûäåëÿåòñÿ â êðîâü èç ãåïàòîöèòîâ ïðè àêòèâíîé ðåïëèêàöèè HBV.
Ïîâåðõíîñòíûé àíòèãåí HBsAg ñóùåñòâóåò â âèäå òðåõ ìîðôîëîãè÷åñêè ðàçëè÷íûõ âàðèàíòîâ: 1) ïðåäñòàâëÿåò ñóïåðêàïñèä öåëüíîãî âèðèîíà; 2) â áîëüøîì êîëè÷åñòâå âñòðå÷àåòñÿ â âèäå ÷àñòèö äèàìåòðîì 20 íì, èìåþùèõ ñôåðè÷åñêóþ ôîðìó; 3) â âèäå íèòåé äëèíîé 230 íì. Õèìè÷åñêè îíè èäåíòè÷íû.  ñîñòàâå HBsAg èìååòñÿ îäèí îáùèé àíòèãåí à è äâå ïàðû âçàèìîèñêëþ÷àþùèõ òèïîñïåöèôè÷åñêèõ äåòåðìèíàíòîâ: d/y è w/r, ïîýòîìó ñóùåñòâóþò ÷åòûðå îñíîâíûõ ñóáòèïà HBsAg (è ñîîòâåòñòâåííî HBV): adw, adr, ayw è ayr. Àíòèãåí à îáåñïå÷èâàåò ôîðìèðîâàíèå îáùåãî ïåðåêðåñòíîãî èììóíèòåòà êî âñåì ñóáòèïàì âèðóñà.
Ñîáñòâåííî âèðèîí ÷àñòèöà Äåéíà èìååò ñôåðè÷åñêóþ ôîðìó è äèàìåòð 42 íì. Ñóïåðêàïñèä âèðèîíà ñîñòîèò èç òðåõ áåëêîâ: ãëàâíîãî (îñíîâíîãî), áîëüøîãî è ñðåäíåãî (ðèñ. 88, 1). Ãåíîì çàêëþ÷åí â êàïñèä è ïðåäñòàâëåí äâóíèòåâîé êîëüöåâèäíîé ÄÍÊ ñ ì. ì. 1,6 ÌÄ. ÄÍÊ ñîñòîèò ïðèáëèçèòåëüíî èç 3200 íóêëåîòèäîâ, îäíàêî åå «ïëþñ» íèòü íà 20 50 % êîðî÷å «ìèíóñ» íèòè. Ñ 5′-êîíöîì äëèííîé íèòè êîâàëåíòíî ñâÿçàí âèðóññïåöèôè÷åñêèé áåëîê. 5′-êîíöû îáåèõ íèòåé êîìïëåìåíòàðíû è îáðàçóþò «ëèïêèå» ïîñëåäîâàòåëüíîñòè äëèíîé â 300 íóêëåîòèäîâ, áëàãîäàðÿ ÷åìó íèòè çàìûêàþòñÿ â êîëüöî. Ñîäåðæàíèå à + Ö â âèðèîííîé ÄÍÊ 48 49 ìîë %.  ñåðäöåâèíå âèðèîíà íàõîäèòñÿ êðîìå ãåíîìíîé ÄÍÊ-âèðóñíàÿ ÄÍÊ-çàâèñèìàÿ ÄÍÊ-ïîëèìåðàçà. «Ìèíóñ» íèòü ÄÍÊ HBV ñîäåðæèò âñåãî ÷åòûðå ãåíà (S, C, P è X), íî îíè îðãàíèçîâàíû î÷åíü êîìïàêòíî (ðèñ. 88, 2). Ãåíû S, C, P, X ñèëüíî ïåðåêðûâàþòñÿ è êîíòðîëèðóþò ñèíòåç ñëåäóþùèõ ïðîäóêòîâ. Ãåí S êîäèðóåò ñèíòåç ãëàâíîãî áåëêà îáîëî÷êè è ñîäåðæèò âñþ èíôîðìàöèþ î ïîâåðõíîñòíîì àíòèãåíå HBsAg. Êðîìå òîãî, îí êîäèðóåò ñèíòåç ñðåäíåãî è áîëüøîãî áåëêîâ îáîëî÷êè. Áåëêè ñîäåðæàò îáùèé ÑÎÎÍ-êîíåö, íî èõ òðàíñëÿöèÿ íà÷èíàåòñÿ ñ òðåõ ðàçëè÷íûõ èíèöèàòîðíûõ êîäîíîâ. Ãåí Ñ êîäèðóåò ñèíòåç êàïñèäíûõ áåëêîâ (HBcAg è HBeAg); õîòÿ ýòè áåëêè êîäèðóþòñÿ îäíèì ãåíîì, ïóòè èõ òðàíñëÿöèè ðàçëè÷íû. Ãåí Ð ñàìûé áîëüøîé. Îí âêëþ÷àåò â ñåáÿ ÷àñòü âñåõ òðåõ äðóãèõ ãåíîâ è êîäèðóåò ôåðìåíòû, íåîáõîäèìûå äëÿ ðåïëèêàöèè âèðóñà.  ÷àñòíîñòè, îí êîäèðóåò îáðàòíóþ òðàíñêðèïòàçó, äîìåí ôåðìåíòà ÐÍÊ-àçû Í, 5′-êîíöåâîé áåëîê «ìèíóñ» öåïè. Ãåí X êîäèðóåò áåëêè, ðåãóëèðóþùèå ýêñïðåññèþ (âûðàæåíèå) âñåõ âèðóñíûõ ãåíîâ, â ÷àñòíîñòè áåëîê ñ ì. ì. 17 êÄ, êîòîðûé ÿâëÿåòñÿ òðàíñàêòèâàòîðîì òðàíñêðèïöèè ãåíîâ.
Áåëêè, îáðàçóþùèå ïîâåðõíîñòíûé àíòèãåí, ñóùåñòâóþò â ãëèêîçèëèðîâàííîé (gp) è íåãëèêîçèëèðîâàííîé ôîðìå. Ãëèêîçèëèðîâàííûìè ÿâëÿþòñÿ gp27, gp33, gp36 è gp42 (öèôðû îáîçíà÷àþò ì. ì. â êÄ). Ñóïåðêàïñèä HBV ñîñòîèò èç ãëàâíîãî, èëè îñíîâíîãî, S-áåëêà (92 %); ñðåäíåãî Ì-áåëêà (4 %) è áîëüøîãî, èëè äëèííîãî, L-áåëêà (1 %).
Ãëàâíûé áåëîê p24/gp27, èëè îñíîâíîé áåëîê (áåëîê S), ÿâëÿåòñÿ îñíîâíûì êîìïîíåíòîì îáîëî÷êè HBV.  îòñóòñòâèå äðóãèõ îáîëî÷å÷íûõ áåëêîâ îí ïîëèìåðèçóåòñÿ è îáðàçóåò ñôåðè÷åñêèå ÷àñòèöû äèàìåòðîì 20 íì, êîòîðûå ñîñòîÿò èç 100 ïîëèïåïòèäíûõ ìîëåêóë.
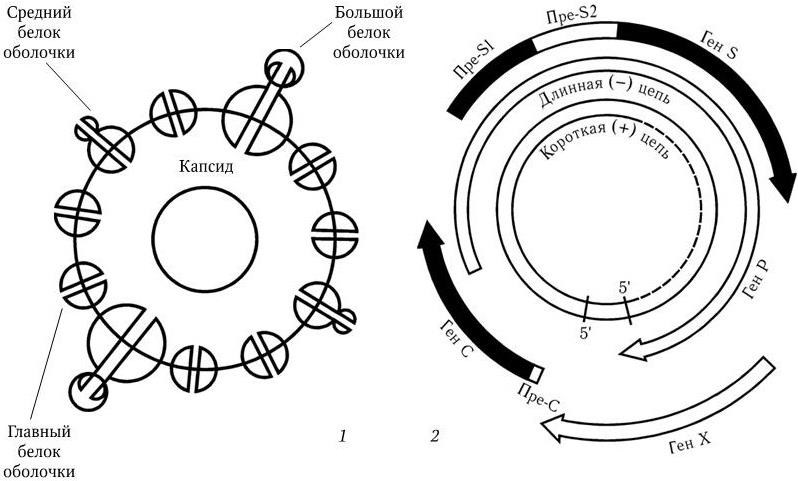
Ðèñ. 88. Ñòðóêòóðà âèðèîíà HBV (1) è åãî ãåíîìà (2)
Áîëüøîé áåëîê p39/gp42, èëè äëèííûé áåëîê (áåëîê L), ïðèñóòñòâóåò âî âñåõ òðåõ ôîðìàõ HBsAg. Îí èãðàåò âàæíóþ ðîëü â ìîðôîãåíåçå âèðèîíîâ è â âûõîäå èõ èç êëåòêè. L-áåëîê ñîäåðæèò ïîñëåäîâàòåëüíîñòü áåëêà Ì, êîòîðàÿ íà N-êîíöå äîïîëíåíà ïîñëåäîâàòåëüíîñòÿìè èç 108 (ayw) èëè 119 (adw, adr, ayr) àìèíîêèñëîòíûõ îñòàòêîâ, êîäèðóåìûõ ïðå-S1-îáëàñòüþ S-ãåíà.
Ñðåäíèé áåëîê gp33/gp36, èëè áåëîê Ì, òàêæå ïðèñóòñòâóåò âî âñåõ òðåõ ìîðôîëîãè÷åñêèõ ôîðìàõ HBsAg. Áåëîê Ì ñîäåðæèò íà N-êîíöå ó÷àñòîê èç 55 àìèíîêèñëîòíûõ îñòàòêîâ, êîäèðóåìûõ ïðå-S2-îáëàñòüþ S-ãåíà. Ïðåäïîëàãàåòñÿ, ÷òî ýòîò ó÷àñòîê èãðàåò âàæíóþ ðîëü â ðàñïîçíàâàíèè âèðóñîì ãåïàòèòà  êëåòîê ïå÷åíè îãðàíè÷åííîãî êðóãà õîçÿåâ (÷åëîâåê, îáåçüÿíà øèìïàíçå). Ïîñëåäîâàòåëüíîñòè áåëêîâ, êîäèðóåìûõ ïðå-S-îáëàñòÿìè S-ãåíà, îáëàäàþò âûñîêîé èììóíîãåííîñòüþ, à èõ äåòåðìèíàíòû ðàñïîëîæåíû íà ïîâåðõíîñòè âèðèîíà. Ïîýòîìó àíòèòåëà ïðîòèâ ýòèõ àíòèãåíîâ èãðàþò âàæíóþ ðîëü â ôîðìèðîâàíèè èììóíèòåòà ïðîòèâ ãåïàòèòà Â.
Ñèíòåç âèðóñíûõ áåëêîâ æåñòêî êîíòðîëèðóåòñÿ íà óðîâíå òðàíñêðèïöèè è òðàíñëÿöèè. Ïðè òðàíñêðèïöèè âèðóñíîãî ãåíîìà ñèíòåçèðóþòñÿ äâà òèïà ìÐÍÊ: à) ìåíüøàÿ 2100 íóêëåîòèäîâ êîäèðóåò ãëàâíûé è ñðåäíèé áåëêè îáîëî÷êè;
á) áî?ëüøàÿ 3500 íóêëåîòèäîâ, ò. å. äëèííåå ñàìî?é ãåíîìíîé ÄÍÊ; îíà ñîäåðæèò êîíöåâûå ïîâòîðû äëèíîé 100 íóêëåîòèäîâ. Ýòîò âèä ìÐÍÊ êîäèðóåò áåëîê êàïñèäà è ïðîäóêòû ãåíà Ð. Îíà òàêæå ÿâëÿåòñÿ ìàòðèöåé äëÿ ðåïëèêàöèè âèðóñíîé ÄÍÊ.  ñîñòàâå ãåíîìà åñòü ýíõàíñåðû (óñèëèòåëè òðàíñêðèïöèè) ðåãóëÿòîðíûå ýëåìåíòû, êîòîðûå àêòèâèðóþò ýêñïðåññèþ âñåõ âèðóñíûõ ãåíîâ è äåéñòâóþò ïðåèìóùåñòâåííî â êëåòêàõ ïå÷åíè.  ÷àñòíîñòè, ãåí S ýêñïðåññèðóåòñÿ íà î÷åíü âûñîêîì óðîâíå òîëüêî â êëåòêàõ ïå÷åíè è ïîä âëèÿíèåì ñòåðîèäíûõ ãîðìîíîâ. Ýòî îáñòîÿòåëüñòâî è îáúÿñíÿåò, ïî÷åìó õðîíè÷åñêèé ãåïàòèò  è ðàê ïå÷åíè (ãåïàòîìà) íàáëþäàþòñÿ ó ìóæ÷èí ÷àùå, ÷åì ó æåíùèí, ó êîòîðûõ óðîâåíü ñòåðîèäíûõ ãîðìîíîâ íèæå.
Äðóãèå ðåãóëÿòîðíûå ýëåìåíòû âèðóñà ãåïàòèòà  ìîäóëèðóþò (êîíòðîëèðóþò) óðîâíè ñèíòåçà îòäåëüíûõ áåëêîâ. Íàïðèìåð, áîëüøîé áåëîê ñèíòåçèðóåòñÿ ëèøü â ìàëîì êîëè÷åñòâå. Áîëüøå âñåãî åãî íà ïîâåðõíîñòè èíôåêöèîííûõ âèðèîíîâ. À ãëàâíûé áåëîê è, â ìåíüøåé ñòåïåíè, ñðåäíèé áåëîê ñèíòåçèðóþòñÿ â îãðîìíîì êîëè÷åñòâå è ïîêèäàþò êëåòêè â ñîñòàâå ÷àñòèö ïîâåðõíîñòíîãî àíòèãåíà, êîòîðûõ â ñûâîðîòêå êðîâè ñîäåðæèòñÿ âî ìíîãî ðàç áîëüøå, ÷åì çðåëûõ âèðèîíîâ. Êîëè÷åñòâî ÷àñòèö ïîâåðõíîñòíîãî àíòèãåíà ìîæåò ñîñòàâëÿòü 1011 1013 íà 1 ìë êðîâè (íåñêîëüêî ñîòåí ìêã).
Âèðóñ ãåïàòèòà  âûäåëåí â íîâîå ñåìåéñòâî âèðóñîâ Hepadnaviridae, ðîä Orthohepadnavirus. Ñõîäíûå ñ íèì ãåïàäíàâèðóñû îáíàðóæåíû ó ðàçëè÷íûõ æèâîòíûõ (çåìëÿíûõ áåëîê, ñóðêîâ, áóðóíäóêîâ, ïåêèíñêèõ óòîê).
Ðåïðîäóêöèÿ ãåïàäíàâèðóñîâ ïðîèñõîäèò íåñêîëüêî íåîáû÷íûì îáðàçîì.  ÷àñòíîñòè, ðåïëèêàöèÿ ãåíîìíîé ÄÍÊ ïðîèñõîäèò ÷åðåç ïðîìåæóòî÷íîå çâåíî ÐÍÊ, ò. å. ñ ìåõàíèçìîì îáðàòíîé òðàíñêðèïöèè.
Æèçíåííûé öèêë âèðóñà ãåïàòèòà Â.
1. Àäñîðáöèÿ íà êëåòêå.
2. Ïðîíèêíîâåíèå â êëåòêó ñ ïîìîùüþ ìåõàíèçìà ðåöåïòîðîïîñðåäîâàííîãî ýíäîöèòîçà (îêàéìëåííàÿ ÿìêà ? îêàéìëåííûé ïóçûðåê ? ëèçîñîìà ? âûõîä íóêëåîêàïñèäà è ïðîíèêíîâåíèå âèðóñíîãî ãåíîìà â ÿäðî ãåïàòîöèòà).
3. Âíóòðèêëåòî÷íîå ðàçìíîæåíèå.
 õîäå ïðîíèêíîâåíèÿ â êëåòêó ïðîèñõîäèò óäëèíåíèå (äîñòðàèâàíèå) êîðîòêîé («ïëþñ») öåïè ÄÍÊ.  ÿäðå êëåòî÷íàÿ ÄÍÊ-çàâèñèìàÿ ÐÍÊ-ïîëèìåðàçà ñèíòåçèðóåò ÐÍÊ ðàçìåðîì 3500 íóêëåîòèäîâ (ïðåãåíîì) è ìÐÍÊ, ìåíüøèå ïî ðàçìåðàì, äëÿ ñèíòåçà âèðóñíûõ áåëêîâ. Çàòåì ïðåãåíîì è âèðóñíàÿ ÄÍÊ-ïîëèìåðàçà óïàêîâûâàþòñÿ âî âíîâü ñèíòåçèðîâàííûé êàïñèä, êîòîðûé ïåðåíîñèòñÿ â öèòîïëàçìó. Çäåñü è ïðîèñõîäèò îáðàòíàÿ òðàíñêðèïöèÿ ïðåãåíîìà. Íà íåì ñèíòåçèðóåòñÿ íîâàÿ «ìèíóñ» íèòü ÄÍÊ. Ïîñëå çàâåðøåíèÿ ñèíòåçà «ìèíóñ» íèòè ÄÍÊ ïðåãåíîìíàÿ ÐÍÊ ðàçðóøàåòñÿ. Âèðèîííàÿ ÄÍÊ-ïîëèìåðàçà íà «ìèíóñ» öåïè ñèíòåçèðóåò «ïëþñ» öåïü. Âèðóñíàÿ ÄÍÊ, òåïåðü óæå äâóõöåïî÷å÷íàÿ, ìîæåò ñóùåñòâîâàòü â êëåòêå äîâîëüíî äîëãî è âîçâðàùàòüñÿ â ÿäðî äëÿ ñëåäóþùåãî öèêëà ðåïëèêàöèè. Åñëè íîâàÿ âèðóñíàÿ ÷àñòèöà íå ïîäâåðãàåòñÿ äàëüíåéøåé ðåïëèêàöèè, òî ñôîðìèðîâàâøèéñÿ íóêëåîêàïñèä, ïðîõîäÿ ÷åðåç ìåìáðàíó êëåòêè, ïîêðûâàåòñÿ ñóïåðêàïñèäîì, îòïî÷êîâûâàåòñÿ îò êëåòêè, è â íåì íåìåäëåííî ïðåêðàùàåòñÿ óäëèíåíèå êîðîòêîé «ïëþñ» öåïè ÄÍÊ. Âîò ïî÷åìó äëèíà ýòîé íèòè âàðüèðóåò. Ïðè òèïè÷íîé îñòðîé ôîðìå ãåïàòèòà  â êðîâè ïîñëåäîâàòåëüíî ïîÿâëÿþòñÿ ñëåäóþùèå ñåðîëîãè÷åñêèå ìàðêåðû: HBsAg, HBeAg è àíòèòåëà (IgM, IgG): àíòè-HBcAg, àíòè-HBeAg è àíòè-HBsAg.
 ñîñòàâå âèðóñà ãåïàòèòà  íåò îíêîãåíà, îäíàêî óñòàíîâëåíî, ÷òî, âíåäðÿÿñü â êëåòî÷íóþ õðîìîñîìó (â ðàçíûå åå ó÷àñòêè), âèðóñíàÿ ÄÍÊ ìîæåò èíäóöèðîâàòü â íèõ ðàçëè÷íûå ãåíåòè÷åñêèå ïåðåñòðîéêè äåëåöèè, òðàíñëîêàöèè, àìïëèôèêàöèè, êîòîðûå è ìîãóò ñòàòü ïðè÷èíîé ðàçâèòèÿ ðàêà ïå÷åíè îäíîãî èç ñàìûõ òÿæêèõ ïîñëåäñòâèé âèðóñíîãî ãåïàòèòà Â.
Ðåçèñòåíòíîñòü. Âèðóñ ãåïàòèòà  îáëàäàåò âûñîêîé óñòîé÷èâîñòüþ. Ïðè êîìíàòíîé òåìïåðàòóðå ñîõðàíÿåò æèçíåñïîñîáíîñòü â òå÷åíèå 3 ìåñ., â çàìîðîæåííîì ñîñòîÿíèè íåñêîëüêî ëåò. Âèðóñ ïîëíîñòüþ èíàêòèâèðóåòñÿ ïðè àâòîêëàâèðîâàíèè (120 °C), ïðè êèïÿ÷åíèè â òå÷åíèå 30 ìèí, ñóõèì æàðîì ïðè òåìïåðàòóðå 180 °C â òå÷åíèå 60 ìèí, ïðè 60 °C â òå÷åíèå 10 ÷. Óñòîé÷èâ â êèñëîé ñðåäå, íî ðàçðóøàåòñÿ â ùåëî÷íîé. Âèðóñ ïîãèáàåò ïðè îáðàáîòêå Í2Î2, õëîðàìèíîì, ôîðìàëèíîì, ôåíîëîì è ïðè ÓÔ-îáëó÷åíèè.
Ýïèäåìèîëîãèÿ. Èñòî÷íèêîì çàðàæåíèÿ âèðóñîì ãåïàòèòà  ÿâëÿåòñÿ òîëüêî ÷åëîâåê. Âîïðåêè ïðîøëûì ïðåäñòàâëåíèÿì î òîì, ÷òî çàðàæåíèå âèðóñîì ãåïàòèòà Â
ïðîèñõîäèò èñêëþ÷èòåëüíî ïàðåíòåðàëüíûì ïóòåì, òåïåðü äîêàçàíî, ÷òî îí îáíàðóæèâàåòñÿ â ðàçëè÷íûõ ñåêðåòàõ è ýêñêðåòàõ: â ñëþíå, íîñîãëîòî÷íûõ âûäåëåíèÿõ, èñïðàæíåíèÿõ, ñëåçíîé æèäêîñòè, â ñïåðìå, ìåíñòðóàëüíîé êðîâè è ïð. Òàêèì îáðàçîì, çàðàæåíèå ïðîèñõîäèò íå òîëüêî ïàðåíòåðàëüíûì ïóòåì, íî è ïîëîâûì, è âåðòèêàëüíûì (îò ìàòåðè ïëîäó), ò. å. ïðàêòè÷åñêè çàðàæåíèå âèðóñîì ãåïàòèòà  âîçìîæíî ðàçíûìè ñïîñîáàìè.
Îò ãåïàòèòà B â ìèðå ïîãèáëî ñòîëüêî æå ëþäåé, ñêîëüêî çà âñå ãîäû Âòîðîé ìèðîâîé âîéíû. ×èñëî íîñèòåëåé HBV, ïî äàííûì ÂÎÇ, ñîñòàâëÿåò îò 0,1 äî 20 % íàñåëåíèÿ ðàçíûõ ñòðàí èëè ðåãèîíîâ.
Ïàòîãåíåç è êëèíèêà. Âèðóñ ãåìàòîãåííûì ïóòåì çàíîñèòñÿ íåïîñðåäñòâåííî â ïå÷åíü.  ïàòîãåíåçå ãåïàòèòà âàæíóþ ðîëü èãðàþò àóòîèììóííûå ãóìîðàëüíûå è êëåòî÷íûå ðåàêöèè. Ïðåäïîëàãàåòñÿ, ÷òî ïîðàæåíèå ãåïàòîöèòîâ ñâÿçàíî íå ñòîëüêî ñ íåïîñðåäñòâåííûì äåéñòâèåì ñàìîãî âèðóñà, ñêîëüêî ñ èììóíîëîãè÷åñêèìè ðåàêöèÿìè õîçÿèíà, âîçíèêàþùèìè â ñâÿçè ñ ìîäèôèêàöèåé êëåòî÷íîé ìåìáðàíû âèðóñíûìè áåëêàìè, êîòîðûå èíäóöèðóþò ïîÿâëåíèå àóòîàíòèòåë ê êëåòêàì ïå÷åíè. Ïîýòîìó ðàçâèâàþùèéñÿ õðîíè÷åñêèé ãåïàòèò è öèððîç ïå÷åíè ìîæíî ðàññìàòðèâàòü êàê àóòîèììóííîå çàáîëåâàíèå.
Êëåòî÷íûå àóòîèììóííûå ðåàêöèè ê âèðóñíûì áåëêàì, ñîäåðæàùèìñÿ â ìåìáðàíå ãåïàòîöèòîâ, îïîñðåäóþòñÿ Ò-öèòîòîêñè÷åñêèìè ëèìôîöèòàìè è äðóãèìè êèëëåðíûìè êëåòêàìè ïå÷åíè. Ïîýòîìó îñòðóþ äèñòðîôèþ ïå÷åíè ìîæíî ðàññìàòðèâàòü êàê ðåàêöèþ îòòîðæåíèÿ ñâîåîáðàçíîãî ãåòåðîòðàíñïëàíòàòà.
Èíêóáàöèîííûé ïåðèîä äëèòñÿ îò 45 äî 180 äíåé, â ñðåäíåì ñîñòàâëÿåò 60 90 äíåé. Êëèíè÷åñêîå òå÷åíèå ãåïàòèòà  õàðàêòåðèçóåòñÿ áîëüøèì ðàçíîîáðàçèåì;
áîëåçíü ìîæåò ïðîòåêàòü: â ëàòåíòíîé ôîðìå, âûÿâëÿåìîé ëèøü ëàáîðàòîðíûìè ìåòîäàìè, â òèïè÷íîé æåëòóøíîé ôîðìå è â çëîêà÷åñòâåííîé ôîðìå, çàêàí÷èâàþùåéñÿ ëåòàëüíî. Ïðîäîëæèòåëüíîñòü ïðåäæåëòóøíîé ñòàäèè ñîñòàâëÿåò îò îäíîãî äíÿ äî íåñêîëüêèõ íåäåëü. Æåëòóøíûé ïåðèîä, êàê ïðàâèëî, äëèòåëüíûé è õàðàêòåðèçóåòñÿ õîðîøî âûðàæåííûìè ñèìïòîìàìè (æåëòóõà, ãèïåðáèëèðóáèíåìèÿ, ïîòåìíåíèå ìî÷è, æåëòóøíîñòü ñêëåð). Çàòÿæíàÿ ôîðìà íàáëþäàåòñÿ ó 15 20 % áîëüíûõ, à ó 90 % èç íèõ ðàçâèâàåòñÿ õðîíè÷åñêèé ãåïàòèò Â. Ó áîëüíûõ ñ çàòÿæíîé ôîðìîé íåðåäêî íàáëþäàþòñÿ àóòîèììóííûå ïðîöåññû, ñîïðîâîæäàþùèåñÿ ïîâûøåííûì ñîäåðæàíèåì ïðîòèâîïå÷åíî÷íûõ àíòèòåë, êîòîðûå âûÿâëÿþòñÿ ñ ïîìîùüþ èììóíîñîðáåíòíîãî àíàëèçà (ÈÔÌ). Ó äåòåé ãåïàòèò  ïðîòåêàåò â áîëåå ëåãêîé ôîðìå è ÷àñòî áåç ðàçâèòèÿ æåëòóõè, ó äåòåé ìëàäøåãî âîçðàñòà ïðåèìóùåñòâåííî áåññèìïòîìíî.
Ïîñòèíôåêöèîííûé èììóíèòåò (ãóìîðàëüíûé è êëåòî÷íûé) äëèòåëüíûé, ïîæèçíåííûé, îáóñëîâëåí âèðóñíåéòðàëèçóþùèìè àíòèòåëàìè (àíòè-HBsAg) ïðè îòñóòñòâèè â êðîâè ïîâåðõíîñòíîãî àíòèãåíà. Íåðåäêî íàáëþäàåòñÿ ñêðûòàÿ èììóíèçàöèÿ âñëåäñòâèå ïîâòîðíîãî êîíòàêòà ñ HBV, êîòîðàÿ ÿâëÿåòñÿ ïðè÷èíîé øèðîêîãî ðàñïðîñòðàíåíèÿ èììóíèòåòà ê âèðóñó ñðåäè íàñåëåíèÿ. Îáû÷íî áîëüíûå ñ îñòðîé ôîðìîé ãåïàòèòà  âûçäîðàâëèâàþò ïîëíîñòüþ ïî ìåðå íàêîïëåíèÿ àíòèòåë ê íåìó. Îäíàêî â íåêîòîðûõ ñëó÷àÿõ, íåñìîòðÿ íà âûñîêèé óðîâåíü âèðóñíîãî àíòèãåíà â êðîâè (îáñòîÿòåëüñòâî, îáúÿñíÿþùåå, ïî÷åìó ïàðåíòåðàëüíîå çàðàæåíèå ïðîèñõîäèò íàèáîëåå ÷àñòî), àíòèòåëà ê íåìó íå âûðàáàòûâàþòñÿ. Âèðóñ ñîõðàíÿåòñÿ â ïå÷åíè, è ÷åëîâåê íà äîëãîå âðåìÿ, èíîãäà ïîæèçíåííî, ñòàíîâèòñÿ õðîíè÷åñêèì íîñèòåëåì. Ýòî îáñòîÿòåëüñòâî ñâÿçàíî, î÷åâèäíî, ñî ñëàáûì èììóííûì îòâåòîì. Îäíèì èç íàèáîëåå ÷àñòûõ èñõîäîâ õðîíè÷åñêîãî ãåïàòèòà  ÿâëÿåòñÿ öèððîç ïå÷åíè è ðàê ïå÷åíè, êîòîðûé ðàçâèâàåòñÿ ïî èñòå÷åíèè ëàòåíòíîãî ïåðèîäà ïðîäîëæèòåëüíîñòüþ äî 30 50 ëåò.
Ìåòîäû äèàãíîñòèêè ãåïàòèòà Â.  íàñòîÿùåå âðåìÿ îñíîâíûì ìåòîäîì äèàãíîñòèêè ãåïàòèòà  ÿâëÿåòñÿ èñïîëüçîâàíèå ðåàêöèè îáðàòíîé ïàññèâíîé ãåìàããëþòèíàöèè (ÐÎÏÃÀ) äëÿ îáíàðóæåíèÿ âèðóñà èëè åãî ïîâåðõíîñòíîãî àíòèãåíà HBsAg. Êàê óæå îòìå÷àëîñü, â êðîâè ïîâåðõíîñòíîãî àíòèãåíà ñîäåðæèòñÿ âî ìíîãî ðàç áîëüøå, ÷åì ñàìîãî âèðóñà (â 100 1000 ðàç). Äëÿ ðåàêöèè ÐÎÏÃÀ èñïîëüçóþò ñåíñèáèëèçèðîâàííûå àíòèòåëàìè ïðîòèâ âèðóñà ãåïàòèòà  ýðèòðîöèòû. Ïðè íàëè÷èè àíòèãåíà â êðîâè ïðîèñõîäèò ðåàêöèÿ ãåìàããëþòèíàöèè. ÐÎÏÃÀ ïðîñòà, óäîáíà, î÷åíü ñïåöèôè÷íà. Äëÿ îáíàðóæåíèÿ àíòèòåë ê âèðóñíîìó àíòèãåíó HBsAg èñïîëüçóþò ðàçëè÷íûå èììóíîëîãè÷åñêèå ìåòîäû (ÐÑÊ, ÐÏÃÀ, ÈÔÌ, ÐÈÌ è äð.). Êðîìå òîãî, äëÿ îáíàðóæåíèÿ HBV è åãî àíòèãåíîâ èñïîëüçóþò âàðèàíòû ÏÖÐ.
Äëÿ îáíàðóæåíèÿ â ñûâîðîòêå áîëüíîãî àíòèòåë ê âèðóñíîìó àíòèãåíó (HBsAg) ìîãóò áûòü èñïîëüçîâàíû ðàçëè÷íûå èììóíîëîãè÷åñêèå ìåòîäû (ÐÑÊ, ÐÏÃÀ, ðåàêöèÿ ïðåöèïèòàöèè, ÈÔÌ, ÐÈÌ è äð.).
Ñïåöèôè÷åñêàÿ ïðîôèëàêòèêà. Ïðèíèìàÿ âî âíèìàíèå âûñîêèé óðîâåíü çàáîëåâàåìîñòè ãåïàòèòîì Â, à òàêæå, ÷òî â ìèðå î÷åíü ìíîãî íîñèòåëåé HBV, ïî ðåêîìåíäàöèè ÂÎÇ ïðèâèâêè ïðîòèâ ãåïàòèòà  ÿâëÿþòñÿ îáÿçàòåëüíûìè è äîëæíû ïðîâîäèòüñÿ íà ïåðâîì ãîäó æèçíè. Äëÿ âàêöèíàöèè ïðåäëîæåíî äâà òèïà âàêöèí. Äëÿ ïðèãîòîâëåíèÿ îäíîé èç íèõ â êà÷åñòâå ñûðüÿ èñïîëüçóþò ïëàçìó âèðóñîíîñèòåëåé, ïîñêîëüêó â íåé âèðóñíûé àíòèãåí ñîäåðæèòñÿ â êîëè÷åñòâàõ, äîñòàòî÷íûõ äëÿ ïðèãîòîâëåíèÿ âàêöèíû. Ãëàâíîå óñëîâèå äëÿ ïðèãîòîâëåíèÿ ýòîãî òèïà âàêöèí èõ ïîëíàÿ áåçîïàñíîñòü, ò. å. ïîëíàÿ èíàêòèâàöèÿ âèðóñà, ÷òî è ïðåäóñìàòðèâàåòñÿ òåõíîëîãèåé ïðèãîòîâëåíèÿ âàêöèíû. Äëÿ èçãîòîâëåíèÿ âàêöèíû äðóãîãî òèïà ïðèìåíÿþò ìåòîäû ãåííîé èíæåíåðèè, â ÷àñòíîñòè, äëÿ ïîëó÷åíèÿ àíòèãåííîãî ìàòåðèàëà èñïîëüçóþò ðåêîìáèíàíòíûé êëîí äðîææåé, âûðàáàòûâàþùèõ ïîâåðõíîñòíûé àíòèãåí âèðóñà ãåïàòèòà Â. Î äèâàêöèíå ïðîòèâ ãåïàòèòîâ A è B ñì. ñ. 6.
Îáå âàêöèíû îáëàäàþò âûñîêîé ýôôåêòèâíîñòüþ (çàùèùàþò 95 % ïðèâèòûõ). Ïðîäîëæèòåëüíîñòü ïîñòâàêöèíàëüíîãî èììóíèòåòà íå ìåíåå 5 6 ëåò. Â Ðîññèè ñîçäàíû âàêöèíû êàê äëÿ âçðîñëûõ ëþäåé, òàê è äëÿ íîâîðîæäåííûõ è äåòåé ðàííåãî âîçðàñòà íàèáîëåå âàæíûé êîìïîíåíò áîðüáû ñ ãåïàòèòîì Â â ãëîáàëüíîì ïëàíå. Ïîëíûé êóðñ ïðèâèâêè ñîñòîèò èç òðåõ èíúåêöèé:
I äîçà ñðàçó ïîñëå ðîæäåíèÿ; II äîçà ÷åðåç 1 2 ìåñ.; III äîçà äî êîíöà 1-ãî ãîäà æèçíè.
Ýòè ïðèâèâêè âêëþ÷åíû â ðàñøèðåííóþ ïðîãðàììó èììóíèçàöèè ÂÎÇ è ñîâìåùàþòñÿ ñ êàëåíäàðåì åå ïðîâåäåíèÿ (ïî ðåêîìåíäàöèè ÂÎÇ, íà 1-ì ãîäó æèçíè ïðîâîäÿò ïðèâèâêè ïðîòèâ òóáåðêóëåçà, ïîëèîìèåëèòà, ãåïàòèòà Â, êîðè, ñòîëáíÿêà, äèôòåðèè, êîêëþøà).
Ãàììà-ãëîáóëèí, ñîäåðæàùèé àíòèòåëà ïðîòèâ HBV, ïðèìåíÿþò äëÿ ýêñòðåííîé ïàññèâíîé èììóíîïðîôèëàêòèêè ëèöàì, èìåâøèì êîíòàêò ñ áîëüíûì ãåïàòèòîì Â. Äëÿ ëå÷åíèÿ ãåïàòèòà B (îñòðîé è õðîíè÷åñêîé ôîðì) èñïîëüçóþò èíòåðôåðîí è àìèêñèí (äëÿ èíäóêöèè åãî ýíäîãåííîãî ñèíòåçà). Ïðè ëå÷åíèè õðîíè÷åñêîãî ãåïàòèòà B ýôôåêòèâåí íîâûé ïðåïàðàò ëàìèâóäèí (ñèíòåòè÷åñêèé íóêëåîçèä).
Источник
1. Адсорбция на клетке.
2. Проникновение в клетку с помощью механизма рецепторопосредованного эндоцитоза (окаймленная ямка —> окаймленный пузырек —> лизосома —> выход нуклеокапсида и проникновение вирусного генома в ядро гепатоцита).
3. Внутриклеточное размножение.
В составе вируса гепатита В нет онкогена, однако установлено, что, внедряясь в клеточную хромосому (в разные ее участки), вирусная ДНК может индуцировать в них различные генетические перестройки — делеции, транслокации, амплификации, которые и могут стать причиной развития рака печени — одного из самых тяжких последствий вирусного гепатита В.
Резистентность.Вирус гепатита В обладает высокой устойчивостью. При комнатной температуре сохраняет жизнеспособность в течение 3 мес, в замороженном состоянии — несколько лет. Вирус полностью инактивируется при автоклавировании (120 °С), при кипячении в течение 30 мин, сухим жаром при 180 °С в течение 60 мин, при 60 °С — в течение 10 час. Устойчив в кислой среде, но разрушается в щелочной. Вирус погибает при обработке Н2О2, хлорамином, формалином, фенолом и при УФ-облучении.
Эпидемиология. Источником заражения вирусом гепатита В является только человек. Вопреки прошлым представлениям о том, что заражение вирусом гепатита В происходит исключительно парентеральным путем, теперь доказано, что он обнаруживается в различных секретах и экскретах: в слюне, носоглоточных выделениях, испражнениях, слезной жидкости, в сперме, менструальной крови и прочих. Таким образом, заражение происходит не только парентеральным путем, но и половым и вертикальным (от матери плоду), т. е. практически заражение вирусом гепатита В возможно разными способами.
Распространению HBV способствует большое число вирусоносителей, которые, по данным ВОЗ, составляют от 0,1 до 20% населения страны или региона.
Патогенез и клиника.Вирус гематогенным путем заносится непосредственно в печень. В патогенезе гепатита важную роль играют аутоиммунные гуморальные и клеточные реакции. Предполагается, что поражение гепатоцитов связано не столько с непосредственным действием самого вируса, сколько с иммунологическими реакциями хозяина, возникающими в связи с модификацией клеточной мембраны вирусными белками, которые индуцируют появление аутоантител к клеткам печени. Поэтому развивающийся хронический гепатит и цирроз печени можно рассматривать как аутоиммунное заболевание.
Клеточные аутоиммунные реакции к вирусным белкам, содержащимся в мембране гепатоцитов, опосредуются Т-цитотоксическими лимфоцитами и другими киллерными клетками печени. Поэтому острую трофию печени можно рассматривать как реакцию отторжения своеобразного гетеротрансплантата.
Инкубационный период длится от 45 до 180 дней, в среднем составляет 60-90 дней. Клиническое течение гепатита В характеризуется большим разнообразием; болезнь может протекать: в латентной форме, выявляемой лишь лабораторными методами, в типичной желтушной форме и в злокачественной форме, заканчивающейся летально. Продолжительность преджелтушной стадии составляет от >го дня до нескольких недель. Желтушный период, как правило, длительный и характеризуется хорошо выраженными симптомами (желтуха, гипербилирубинемия, потемнение мочи, желтушность склер). Затяжная форма наблюдается у 15-20% больных, а у 90% из них развивается хронический гепатит В. У больных с затяжной формой нередко наблюдаются аутоиммунные процессы, сопровождающиеся повышенным содержанием противопеченочных антител, которые выявляются с помощью иммуносорбентного анализа (ИФМ). У детей гепатит В протекает в более легкой форме и часто без развития желтухи, у детей младшего возраста — преимущественно бессимптомно.
Постинфекционный иммунитет длительный, пожизненный, обусловлен вируснейтрализующими антителами (анти-HBsAg) при отсутствии в крови поверхностного антигена. Нередко наблюдается скрытая иммунизация вследствие повторного контакта с HBV, которая является причиной широкого распространения иммунитета к вирусу среди населения. Обычно больные с острой формой гепатита В выздоравливают полностью по мере накопления антител к нему. Однако в некоторых случаях, несмотря на высокий уровень вирусного антигена в крови (обстоятельство, объясняющее, почему парентеральное заражение происходит наиболее часто), антитела к нему не вырабатываются. Вирус сохраняется в печени, и человек на долгое время, иногда пожизненно, становится хроническим носителем. Это обстоятельство связано, очевидно, со слабым иммунным ответом. Одним из наиболее частых исходов хронического гепатита В является цирроз печени и рак печени, который развивается по истечении латентного периода продолжительностью до 30-50 лет.
Методы диагностики гепатита В. В настоящее время основным методом диагностики гепатита В является использование реакции обратной пассивной гемагглютинации (РОПГА) для обнаружения вируса или его поверхностного антигена. Как уже отмечалось, в крови поверхностного антигена содержится во много раз больше, чем самого вируса (в 100—1000 раз). Для реакции РОПГА используют сенсибилизированные антителами против вируса гепатита В эритроциты. При наличии антигена в крови происходит реакция гемагглютинации. Реакция проста и удобна и обладает высокой специфичностью. Кроме того, разработан метод зонда — ДНК-ДНК-гибридизации.
Для обнаружения в сыворотке больного антител к вирусному антигену (HBsAg) могут быть использованы различные иммунологические методы (РСК, РПГА, реакция преципитации, ИФМ, РИМ и др.).
Специфическая профилактика. Принимая во внимание, что последствия перенесенного гепатита В могут быть очень тяжелыми, а также то обстоятельство, что в мире очень много носителей HBV, по рекомендации ВОЗ прививки против гепатита В являются обязательными и должны проводиться на первом году жизни. Для вакцинации предложено два типа вакцин. Для приготовления одной из них в качестве сырья используют плазму вирусоносителей, поскольку в ней вирусный антиген содержится в количествах, достаточных для приготовления вакцины. Главное условие для приготовления этого типа вакцин — их полная безопасность, т. е. полная инактивация вируса, что и предусматривается технологией приготовления вакцины. Для изготовления вакцины другого типа применяют методы генной инженерии, в частности, для получения антигенного материала используют рекомбинантный клон дрожжей, вырабатывающих поверхностный антиген вируса гепатита В.
Обе вакцины обладают высокой эффективностью (защищают 95% привитых). Продолжительность поствакцинального иммунитета не менее 5-6 лет. К настоящему времени в мире привито несколько десятков миллионов детей.
Массовая иммунизация новорожденных и детей раннего возраста — наиболее важный компонент борьбы с гепатитом В в глобальном плане. Полный курс прививки состоит из 3 инъекций:
I доза — сразу после рождения; II доза — через 1-2 мес; III доза — до конца 1-го года жизни.
Эти прививки включены в расширенную программу иммунизации ВОЗ и совмещаются с календарем ее проведения (по рекомендации ВОЗ на 1-м году жизни проводят прививки против туберкулеза, полиомиелита, гепатита В, кори, столбняка, дифтерии, коклюша).
Гамма-глобулин, содержащий антитела против HBV, применяют для экстренной пассивной иммунопрофилактики лицам, имевшим контакт с больным гепатитом В.
Лечениегепатита В проводится так же, как и гепатита А, с учетом формы и тяжести заболевания.
Вирусный гепатит С
Гепатит С — инфекционное заболевание человека с парентеральным механизмом заражения, характеризующееся преимущественным поражением печени. Возбудитель — вирус гепатита С (HCV) — еще не выделен в чистом виде, но на основании изучения ряда его свойств отнесен к семейству Flaviviridae. Вирион имеет суперкапсид (чувствителен к хлороформу). Геном вируса гепатита С изучен с помощью сложных генно-инженерных исследований. Изучение геномной организации нескольких штаммов HCV показало, что геном вируса гепатита С не является близко родственным ни одному из известных РНК-содержащих вирусов, однако его ближайшими родственниками являются флавивирусы. Изучение свойств HCV затрудняется тем, что его пока не удается выращивать в культурах клеток. Экспериментальное заражение воспроизводят на шимпанзе.
Эпидемиология и клиника.Источником инфекции является только человек. Распространение вируса происходит трансфузионно при переливании крови и ее препаратов или инструментальным путем в результате занесения зараженной вирусом крови в организм здоровых людей, а также вертикально — от матери плоду. Восприимчивость населения к HCV очень высокая. По данным ВОЗ (1987 г.), на долю гепатита С в Африке приходится до 25% всех случаев вирусного гепатита, в ряде стран Америки — до 35%. В США около 90% посттрансфузионного вирусного гепатита вызывается вирусом гепатита С. Поддержанию эпидемического процесса способствует склонность гепатита С к хроническому течению. Вирус выделяется от больных в течение одной или нескольких недель до появления признаков болезни и до 10 нед после начала болезни. Инкубационный период по сравнению с гепатитом В короче примерно на один месяц и составляет в среднем 6-8 нед. Клиническая картина сходна с таковой при гепатите В, однако заболевание протекает легче и характеризуется относительно быстрым выздоровлением, нередко оно протекает без желтухи; последняя наблюдается примерно у 25% больных. Несмотря на относительно благоприятное течение, около 50% всех форм инфекции приводят к формированию хронического гепатита, а около 20% хронических поражений печени заканчивается циррозом и раком. Наряду с вирусом гепатита В, вирус гепатита С является одной из главных причин рака печени.
Диагностика.В крови HCV циркулирует в очень малых концентрациях, в связи с чем обнаружить его с помощью обычных скрининговых методов удается с большим трудом. Поэтому для диагностики вирусного гепатита С разработаны различные тест-системы, позволяющие определять антитела к специфическим вирусным белкам с помощью иммуноферментного метода.
Тестовые задания:
1.Вирусы полиомиелита относят к семейству:
1) калицивирусов
2) ретровирусов
3) поксвирусов
4) пикорнавирусов
2.Вирусы полиомиелита – это:
1) ДНК-содержащие вирусы
2) простые вирусы
3) РНК-содержащие вирусы
4) сложные вирусы
3.для диагностики энтеровирусных инфекций испольЗУЮТ:
1) РТГА
2) РПГА
3) ИФА
4) РИФ
5) ПЦР
4.об активности (остроте) процесса больного гепатитом свидетельствует:
1) Ig G
2) Ig A
3) Ig M
4) Ig E
5.для диагностики гепатита Е можно использовать реакции:
1) ИФА
2) РИА
3) ПЦР
4) РСК
6.Для специфической профилактики полиомиелита используют:
1) БЦЖ
2) АКДС
3) живую вакцину, полученную Смородинцевым А.А.и Чумаковым М.П.
4) антирабическую вакцину
7.КОЛИЧЕСТВО СЕРОТИПОВвирусы полиомиелита:
1) 5
2) 7
3) 3
4) 2
8.Основной путь передачи гепатита А:
1) парентеральный
2) воздушно-капельный
3) фекально-оральный
4) контактный
9.вирусы гепатитов А и Е содержат:
1) ДНК
2) РНК
3) ДНК и РНК
Источник