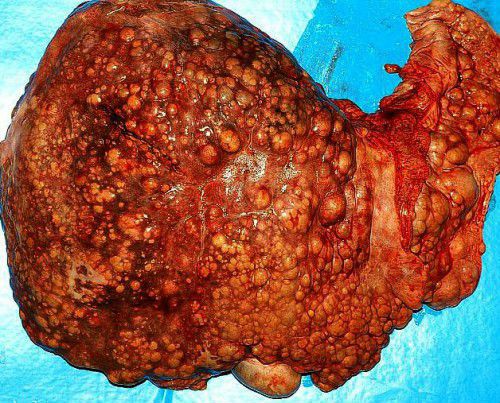
Цирроз печени научные статьи
Каждый из показателей оценивают в баллах (1,2 или 3). Интерпретация осуществляется по следующим критериям:
Асцит — это скопление жидкости в брюшной полости, которое, как правило, проявляется чувством вздутия, тяжести, полноты, иногда распиранием в животе. Визуально может определяться увеличение живота. Достаточно просто диагностируется при УЗИ и КТ органов брюшной полости.
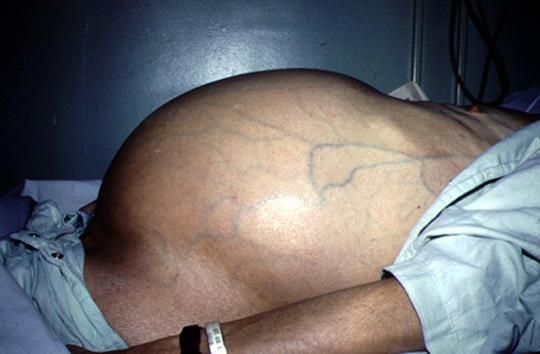
Средний и большой асцит (белее 4 л жидкости) проявляется увеличением массы тела на 5-6 кг. Первично диагностированный асцит требует выполнения пункции брюшной полости для исследования жидкости на микрофлору, определения уровня pH, микроскопического, цитологического и серологического анализа.
Спонтанный бактериальный перитонит (СБП) — осложнение асцита,возникающего при ЦП, которое проявляется в большинстве случаев положительными перитонельными синдромами и лихорадкой. При таком осложнении часто не удаётся выявить первичный инфекционный очаг.
Предполагается, что в развитии СБП важную роль играет условно-патогенная микробная флора кишечника: при возникновении лимфостаза (отёка конечностей) условно-патогенные кишечные бактерии проникают в брюшную полость и активизируются. Из асцитической жидкости чаще высевается кишечная палочка и другие грамотрицательные кишечные микроорганизмы, реже — стрептококки и пневмококки.
Энцефалопатия — осложнение, возникающее из-за печёночной депрессии в результате печёночно-клеточной и портально-печёночной недостаточности. Оба вида энцефалопатии требуют дифференциальной диагностики с передозировками лекарственных средств (в частности, седативных и наркотических средств), острыми цереброваскулярными заболеваниями (включая субдуральную гематому) и острым отравлением алкоголем с определением уровня этилового спирта в крови.
Гепаторенальный синдром — тяжёлая функциональная острая почечная недостаточность у пациентов, имеющих выраженную печёночную недостаточность, которая возникает в результате острого или хронического заболевания печени, чаще всего цирроза.
Диагностика гепаторенального синдрома основана на критериях International Ascites Club (1996 год). К большим критериям относятся:
- хроническое или острое заболевание печени с печёночной недостаточностью и портальной гипертензией;
- низкая клубочковая фильтрация — креатинин сыворотки более 225 мкмоль/л или скорость клубочковой фильтрации менее 40 мл/мин в течении суток при отсутствии противоотёчной терапии;
- отсутствие шока, текущей бактериальной инфекции мочевыводящих путей или нефротоксической терапии;
- отсутствие стойкого улучшения почечной функции при прекращении противоотёчной терапии диуретиками и в/в введении 1,5 л жидкости;
- протеинурия (> 500 мг/сутки) и отсутствие признаков обструкции мочевыводящих путей или заболеваний почек по данным УЗИ.
К методам диагностики ЦП относятся сбор анамнеза, лабораторные и инструментальные исследования, а также проводится дифференциальная диагностика.
Сбор анамнеза
При расспросе пациента уделяется особое внимание наличию в прошлом желтухи, зуда, острых, хронических или наследственных заболеваний печени, употреблению наркотиков, алкоголя, переливаниям препаратов крови и т. д.
Лабораторные исследования
Клинический анализ крови необходим для определения состояния клеток печени. У людей ЦП отмечается тромбоцитопения и тенденция к снижению количества лейкоцитов и нейтрофилов в крови при гиперспленизме. СОЭ часто увеличена. Анемия любой степени тяжести может свидетельствовать о недавно перенесённом кровотечении.
Биохимический анализ крови зависит от причины и выраженности цирроза. При подозрении на заболевание в сыворотке крови определяют уровень активности аминотрансфераз (АЛТ, АСТ), общего и прямого билирубина. Для оценки белково-синтетической функции печени используют протромбиновый индекс, устанавливают количество аммиака и уровень АФП и другое.
Специфические лабораторные тесты для установления причины цирроза предполагают определение наличия аутоантител и проводение серологической диагностики гепатотропных вирусов (HBsAg, HBeAg, Anti-HBc, anti-HCV).
При функциональном обследовании у 80-90% пациентов выявляется повышенная активность аминотрансфераз (обычно в 2-6 раз больше нормы), при аутоиммунных поражениях печени показатели могут быть выше.
Важное значение имеют гамма-глобулин сыворотки (повышен у 90% пациентов с ЦП), сулемовая проба (положительна у 85% пациентов), уровень билирубина (повышен в 2-5 раз у 80-90% пациентов) и содержание аммиака (увеличено у 80-85% людей с ЦП).
Сывороточные маркеры фиброза пока не позволяют точно определить стадию фиброза. Однако Французскими учёными был изобретён тест «ФиброМакс» – метод неинвазивной (без биопсии) структурной оценки состояния ткани печени. Он состоит из нескольких лабораторных исследований, результаты которых используются для расчёта пяти основных показателей состояния ткани печени:
- стадия фиброза по шкале METAVIR (Fibro test);
- степень некровоспалительной реакции (Acti test);
- степень стеатоза и жирового перерождения ткани печени (Steato test);
- диагностика неалкогольного стеатогепатита (Nash test);
- диагностика алкогольного повреждения печени с определением его активности (Ash test).
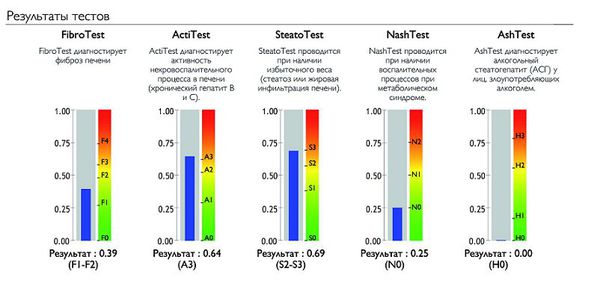
«ФиброМакс» является альтернативой биопсии печени. Он позволяет комплексно оценить изменения, вызванные заболеванием печени.[9][10][11]
Инструментальная диагностика
Ультразвуковое исследование органов брюшной полости (УЗИ) — высокоинформативный метод диагностики ЦП, который позволяет поставить предварительный диагноз. С его помощью можно выявить увеличение плотности печени, узловатую деформацию контуров, расширение внутрипечёночных ветвей воротной и селезёночной вен, а также размеры селезёнки. При высокоактивном ЦП с помощью УЗИ и УЗДГ выявляются чёткие изменения у 80% обследованных, при малоактивных формах ЦП — у 40-60%.
Компьютерная томография (КТ) по диагностической информативности превосходит УЗИ, поэтому она обязательно проводится в сомнительных случаях и при подозрении на онкологические заболевания.
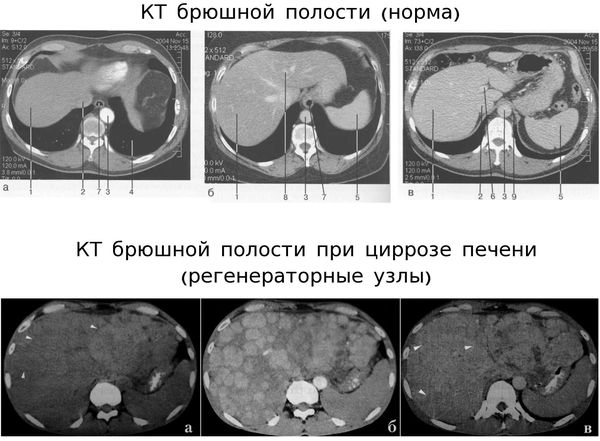
Магнитно-резонансная томография (МРТ) не обладает преимуществами по сравнению с КТ, но такую разновидность МРТ, как магнитно-резонансная холецистопанкреатография, необходимо проводить людям с первичным билиарным циррозом.
УЗДГ (допплерографию) проводят преимущественно для диагностики и оценки выраженности портальной гипертензии.
УЗ-эластография (эластометрия) представляет неинвазивное определение эластичности печени, взаимосвязанное со стадией фиброза по шкале METAVIR.
Видиоэзофагогастродуоденосскопия (ВЭГДС) в 60-70% случаев позволяет выявить узловое расширение вен пищевода (иногда вен кардиального отдела желудка), а в 15-20% — признаки разных стадий язвенной болезни.
Биопсия печени — это морфологическое инвазивное исследование, обладающее высокой информативностью и специфичностью. Оно является золотым стандартом в диагностике ЦП и других заболеваний печени.[17]
Дифференциальная диагностика
Дифференциальная диагностика ЦП проводится с нецирротическими причинами увеличения печени, асцита, портальной гипертензии и энцефалопатии.
При высокоактивных формах ЦП важно дифференцировать заболевание от острого (вирусного, алкогольного или лекарственного) гепатита. Для этого широко используются маркеры вирусов гепатита, ПЦР и иммунология.
Так же дифференциальную диагностику цирроза печени проводят с:
- обструкцией желчевыводящих путей;
- токсическими воздействиями различных веществ, тяжёлых металлов и лекарств;
- аутоиммунным гепатитом;
- первичным и вторичным билиарным циррозом;
- первичным склерозирующим холангитом;
- опухолью или метестазами в печени;
- неалкогольной жировой болезнью печени;
- врождённые патологии (наследованный гемохроматоз, болезнь Вильсона — Коновалова, недостаточность альфа 1 антитрипсина).
Для диагностики, профилактики и поиска оптимального лечения прибегают к помощи дополнительных специалистов: офтальмолога, кардиолога, психиатра, генетика и трансплантолга (для определения возможности и необходимости пересадки печени).[12][13][14]
Диета
Лечебные мероприятия начинаются с рациональной диеты. Она должна быть высококалорийной и высокобелковой (за исключением тяжёлых форм печёночной энцефалопатии), при асците — низкосолевой, с потреблением белка в определённом количестве (из расчёта на 1,5 г/кг массы тела и до 40 ккал/кг в день).
В качестве нутритивной поддержки рекомендуется дополнительные приёмы пищи в виде энтерального питания смесями, обогащёнными пищевыми волокнами, с низким содержанием ароматических аминокислот.
Этиотропное лечение
Этиотропная терапия предполагает лечение основного заболевания, на фоне которого развился цирроз:
- при вирусных гепатитах — противовирусная терапия аналогами нуклеозидов;
- при алкогольном стеатогепатите — исключение приёма алкоголя;
- при лекарственных стеатогепатитах в результате одновременного назначения множества лекарств — ограничение гепатотоксичных и нефротоксичных лекарственных препаратов с сохранением лекарства только по жизненным показаниям;
- при гемохроматозе — отмена препаратов железа.
Патогенетическая терапия
Лечение проводится в зависимости от механизмов развития ЦП, лечения обострений и наличия у пациента хронических заболеваний.
У пациентов с алкогольным циррозом печени (АЦП) возникает дефицит витаминов группы В. Поэтому в этих случаях необходимо принимать 100 мг тиамина, 30 мг пиридоксина и 1 мг фолиевой кислоты в сутки. Для восстановления нарушенной структуры мембран гепатитов используют эссенциальные фосфолипиды, разведённые с кровью пациента по 10 мл на 500 мг в сутки в течение не более 14 дней. Также можно использовать препараты селимарина («Силибинин», «Легалон») и адеметионина («Гептор», «Гептрал») по 800 мг в сутки в/в струйно, метионин и липовую кислоту.
При стойком холестазе и нехватке жирорастворимых витаминов в отсутствии признаков острой печёночной недостаточности в/в водят ретинол (витамин А), эргокальциферол (витамин D), токоферол (витамин Е), викасол (витамин К) и препараты кальция. Для купирования холестаза, развившегося на фоне АЦП, часто назначают препараты урсодезоксихолевой кислоты («Урсосан», «Урсофальк», «Урдокса», «Урсо 100»).
При аутоиммунном гепатите (АИГ) показана иммуносупрессивная и противовоспалительная терапия глюкокортикостероидами (преднизолон, метилпреднизолон). Приём азатиоприна позволяет снизить дозировку глюкокортикостеройдов. Вместо азатиоприна могут быть использованы 6-меркаптопурин, циклоспорин А, циклофосфамид, микофенолата мофетил.
| Суточная доза препаратов | |
|---|---|
| Преднизолон: 60 мг — 1-я неделя; 40 мг — 2-я неделя; 30 мг — 3-я и 4-я неделя; 20 мг — поддерживающая дозировка. | Преднизолон: 30 мг — 1-я неделя; 20 мг — 2-я неделя; 15 мг — 3-я и 4-я неделя; 10 мг — поддерживающая дозировка. Азатиоприн: 50 мг — постоянно. |
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Сапронова Н.Г.
1, 1
Лукьянов С.В.
1
Чигаева Е.В.
1
1 ГБОУ ВПО «Ростовский государственный медицинский университет Минздрава России»
Проведен анализ лечения 341 больного с портальной гипертензией (ПГ) разного генеза. Из 297 пациентов с внутрипеченочной ПГ было выполнено 79 операций спленоренального венозного шунтирования (СВШ) и 128 операций трансъюгулярного внутрипеченочного портосистемного шунтирования (ТВПШ). Помимо этого больным выполнялся лапароцентез с реинфузией концентрата асцитической жидкости (38). С целью предоперационной подготовки, ликвидации гипо- и диспротеинемии, а также заместительной терапии интерлейкином-2 и профилактики гнойных осложнений при дальнейшей хирургической коррекции ПГ одним из двух способов, связанных с риском инфицирования, 12 больным с вирус-ассоцированнымHCV циррозом печени, осложненным асцитом и признаками иммунной недостаточности по клеточному типу с дефицитом CD3⁺- и CD4⁺-позитивных лимфоцитов, снижением содержания CD4⁺CD25⁺-лимфоцитов и NK-клеток выполняли лапароцентез с реинфузией концентрата асцитической жидкости (заявка на изобретение «Способ лечения больных с синдромом внутрипеченочной портальной гипертензии» №2013128527, приоритет от 21.06.2013 г.). После выполнения реинфузии перед операцией ни одному пациенту не понадобилось дополнительное введение альбумина, не было выявлено признаков гнойных осложнений, послеоперационные раны после СВШ зажили первичным натяжением, стабилизировались показатели биохимического анализа крови.
реинфузия асцитической жидкости
цирроз печени
лечение
портальная гипертензия
1. Гринев М. В. Интерлейкин-2 в комплексной детоксицирующей терапии хирургического сепсиса // Анестезиология и реаниматология. – 1994. – № 6. – С.25-28.
2. Иммунотерапия: руководство [под ред. Р.М. Хаитова, Р.И. Атауллаханова]. – М.: ГЭОТАР-Медиа, 2012. – 672 с.
3. Карякина Е.В., Белова С.В. Молекулы средней массы как интегральный показатель метаболических нарушений (обзор литературы) // Клиническая лабораторная диагностика. – 2004. – № 3. – С. 3-8.
4. Кетлинский С.А., Симбирцев А.С. Цитокины. – СПб.: Фолиант, 2008. – 552 с.
5. Козлов В. К., Лебедев М. Ф., Егорова В. Н. Новые возможности иммунотерапии с использованием Ронколейкина – рекомбинантного ИЛ-2 человека // TerraMedica. – 2001. – № 2. – С.12-14.
6. Козлов В.К. Иммунопатогенез и цитокинотерапия хирургического сепсиса. Пособие для врачей. – СПб.: Изд-во «Ясный Свет», 2002. – 48 с.
7. Козлов В.К., Смирнов М.Н., Егорова В.Н., Лебедев М.Ф. Коррекция иммунореактивности рекомбинантным интерлейкином-2. Пособие для врачей. – СПб.: Изд. СПбГУ, 2001. – 24 с.
8. Костюченко А. Л., Бельских А. Н., Тулупов А. Н. Интенсивная терапия послеоперационной раневой инфекции и сепсиса. – СПб., 2000. – 204 с.
9. Назаренко Д.П. Клинико-анатомическое обоснование спленоренального анастомоза для лечения внутрипеченочной портальной гипертензии на почве цирроза печени: дис. … канд. мед. наук. – Курск, 1998. – 112 с.
10. Назыров Ф.Г. Хирургическое лечение осложнений портальной гипертензии у больных циррозом печени: дис. … д-ра мед.наук. – М., 1998. – 287 с.
11. Останин А.А., Черных Е.Р. Эффективность цитокинотерапииРонколейкином® в комплексном лечении хирургических инфекций. НИИ клинической иммунологии СО РАМН. Пособие для врачей. – СПб.: Изд-во СПб. ун-та, 2002. – 28 с.
12. Пивоварова Л. П., Арискина О. Б., Кладухина Н. А. Оценка эффективности иммунотерапии у пострадавших с тяжелой механической травмой // Дни иммунологии в Санкт-Петербурге: тезисы докл. 2-й Международной научн. конф. (Санкт-Петербург). – СПб., 1998. – С.41-42.
13. Попова Л.Л. Клинико-патогенетическое обоснование стратегии и тактики иммунотерапии при хроническом вирусном гепатите С: Автореф. дис… д-ра мед. наук. – М., 2009. – 128 с.
14. Попович А.М. Достижения и перспективы клинического применения Ронколейкина при лечении иммунодефицитов различной этиологии // VII Всеросс. науч. форум «Дни иммунологии в Санкт-Петербурге»: матер. симп. «Эффективность Ронколейкина (интерлейкина-2) при лечении иммунодефицитов различной этиологии». – СПб., 2003. – С. 3-11.
15. Симбирцев А.С. Достижения и перспективы использования рекомбинантных цитокинов в клинической практике // Медицинский академический журнал. – 2013. – Т. 13, № 1. – С.7-22.
16. Скляр Л.Ф., Маркелова Е.В. Цитокинотерапия рекомбинатными интерлейкином 2 (Ронколейкином) больных хроническим вирусным гепатитом С// Цитокины и воспаление. –2002. – Т. 1, № 4. – С.43-46.
17. TIPS/ТИПС (трансъюгулярное внутрипеченочное порто-системное шунтирование) и лечение варикозных пищеводно-желудочных кровотечений / Ю. В. Хоронько, М. Ф. Черкасов, М.И. Поляк, Ю.Е. Баранов. – М.: Фарм-Синтез, 2013. – 242 с.
18. Успехи клинической иммунологии и аллергологии. – Т. III [под ред. А. В. Караулова]. –М.: Изд. регионального отделения РАЕН, 2002. – C. 280-300.
19. Федеральное руководство по использованию лекарственных средств (формулярная система). Вып. XIII [под ред. Чучалина А.Г., Яснецова В.В.]. – М.: ЭХО, 2012. – C. 722-725.
20. Хаитов Р. М. Иммунология: учебник для студентов медицинских вузов / Р.М. Хаитов. –М.: ГЭОТАР Медиа, 2006. – 320 с.
21. Шмелева Е.В. Иммунопрогностические критерии развития цирроза печени, как исхода хронического вирусного гепатита С: дис. … канд. мед. наук. – М., 2009. – 126 с.
22. Шмелёва Е.В., Малова Е.С., Балмасова И.П. и др. Иммунокомпетентные клетки как мишень для терапии хронического гепатита С // Лечащий врач. – 2011. – № 4. – С. 7-12.
23. Ярема И.В., Омаров И.М. Хирургическая коррекция гемо- и лимфообращения при циррозе печени // Вестник хирургии. – 2000. – Т.159, № 6. – С.12-14.
24. Conn H.O. Prevalens of spontaneous bacterial peritonitis/ H.O. Conn // Spontaneous Bacterial Peritonitis the Disease, Pathogenesis and Treatment/ Eds. Y.O. Conn, J. Rodex, M. Nasava. – New York, NY: Marsel Dekker, Ink., 2000. – P.75-85.
25. Osterberg J., Ljungdahl M., Lundholm M. et.al. Microbial translocation and inflammatory response in patient with acute peritonitis // Scand. J. Gastroenterology. – 2004. – Vol. 39. – P.657-664.
Введение
Цирроз печени (ЦП), осложненный портальной гипертензией (ПГ), нередко развивается на фоне вирусного гепатита С (HCV). Он является одной из актуальных медико-социальных проблем современной гепатологии. Способность возбудителя оказывать прямое цитопатическое действие на гепатоциты, его репликация в моноцитах и макрофагах часто приводят к развитию первично-хронического течения гепатита, трансформации в цирроз и первичную гепатокарциному и является причиной развития стойкой иммунной недостаточности [13,16,20,21,22]. Длительная вирусная инфекция (гепатит С) приводит к истощению иммунных механизмов, в частности к дефициту и истощению функций Th1 лимфоцитов, ответственных за выработку интерлейкина-2 [4,18,20,21]. Отмеченная особенность наиболее важна при хронической и тяжело протекающей патологии, когда применение традиционных иммуномодуляторов или синтетических индукторов синтеза цитокинов бессмысленно из-за истощения компенсаторных возможностей иммунной системы при необходимости дальнейшей хирургической коррекции внутрипеченочной ПГ [2,5,6,7,11,14,15,19]. Также нельзя не учитывать у данной категории пациентов явлений эндотоксемии, ишемию кишечника с микробной транслокацией, фармакологический анамнез и инвазивные манипуляции – как последовательность событий в формировании системного воспалительного ответа [1,3,8,12].
Появление синдрома портальной гипертензии (ПГ) имеет чрезвычайно важное значение в течение заболевания. Являясь приспособительным явлением в начале заболевания, ПГ с прогрессированием процесса приобретает роль ведущего патогенетического клинического фактора [23].
Асцит, рефрактерный к медикаментозным мероприятиям, встречается примерно у 10 % больных с ЦП [9]. С момента появления асцита у пациентов летальность составляет 42–70 % в течение года [17].
В ряде исследований последнего десятилетия установлена роль и значение гипопротеинемии как одного из основных факторов неблагоприятного исхода хирургического лечения больных с синдромом портальной гипертензии [10].
Наличие свободной жидкости в животе на фоне цирроза печени нередко сопровождается ее инфицированием – спонтанным бактериальным перитонитом. За последние годы частота этого осложнения значительно возросла и достигла 12–21 % [24,25].
Целью работы является улучшение результатов лечения пациентов с вирус-ассоциированнымHCV циррозом печени путём ликвидации гипо- и диспротеинемии, а также необходимостью предотвращения инфекционных осложнений и опасности развития генерализованной инфекции с проведением опережающего лечения, а именно – раннего применения интерлейкина-2 человеческого рекомбинантного при дальнейшей хирургической коррекции внутрипеченочной портальной гипертензии одним из известных способов.
Материалы и методы. В клинике хирургии Ростовского государственного медицинского университета с 1997 года пролечен 341 пациент с портальной гипертензией. Внутрипеченочная форма ПГ была у 297 (87,1 %) больных и у 2 (0,6 %) пациентов носила смешанный характер (внутрипеченочный и надпеченочный).
Из 299 больных внутрипеченочной ПГ у 287 был выявлен цирроз печени (у 227 из них в анамнезе выявлен вирусный гепатит), у 6 пациентов выявлена альфа-1-антитрипсиновая недостаточность, у одного редко встречающаяся гепатоцеребральная дистрофия (болезнь Вильсона – Коновалова), приведшие к развитию фиброза печени, у ребенка 8 лет ПГ развилась, как осложнение врожденного фиброза печени. У одного пациента регенеративный узел печени вызвал ПГ. Трем пациентам был поставлен диагноз полинодулярной трансформации печени. У двоих из них ПГ носила смешанный характер за счет гипоплазии нижней полой вены в области впадения печеночных вен с деформацией и стенозом их устьев в одном случае и сдавления печеночных вен и нижней полой вены в другом.
Из 297 больных внутрипеченочной формой ПГ у 74 (24,9 %) отмечена печеночно-клеточная недостаточность по Child-Turcotte-Pugh «А» класса, у 157 (52,9 %) – «В» класса, у 66 (22,2 %) – «С» класса. Варикозное расширение вен пищевода и кардиального отдела желудка имело место у всех обследованных больных: I степени выявлено у 51 (14,9 %) пациента, II степени – у 115 (33,7 %), III степени у 175 (51,3 %) больных. С признаками кровотечения из вен пищевода и желудка в клинику поступило 35 (10,2 %) больных. У 163 (47,8 %) пациентов в анамнезе было варикозное пищеводно-желудочное кровотечение. Спленомегалия выявлена у 317 (92,9 %) пациентов, признаки гиперспленизма установлены у 248 (72,7 %) больных. У 204 больных, что составляет 59,8 % наблюдений, заболевание сопровождалось разной степенью асцита.
Из 297 пациентов с внутрипеченочной ПГ было выполнено 79 операций спленоренального венозного шунтирования (СВШ) и 128 операций трансъюгулярного внутрипеченочного портосистемного шунтирования (ТВПШ). Помимо этого больным выполнялся лапароцентез с реинфузией концентрата асцитической жидкости (38).
Из 207 пациентов, которым выполнялась коррекция ПГ одним из вышеуказанных способов, у 79 (38,2 %) вирусный гепатит не был выявлен. У 9 (4,3 %) в анамнезе присутствовал вирусный гепатит А, у 26 (12,6 %) – вирусный гепатит В, у 75 (36,2 %) – вирусный гепатит С, различное сочетание двух или трех вирусных гепатитов было у 18 (8,7 %) больных. Подробная характеристика представлена на рис.1.
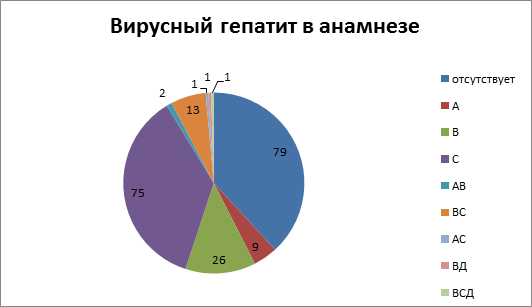
Рис.1. Этиология цирроза печени
Таким образом, вирус-ассоциированный цирроз печени присутствовал у 119 (67,5 %) больных, из них хронический вирусный гепатит С был выявлен у 89 (43,0 %) пациентов.
С целью предоперационной подготовки, ликвидации гипо- и диспротеинемии, а также заместительной терапии интерлейкином-2 и профилактики гнойных осложнений при дальнейшей хирургической коррекции ПГ одним из двух способов, связанных с риском инфицирования, 12 больным с вирус-ассоцированнымHCV циррозом печени, осложненным асцитом, выполняли лапароцентез с реинфузией концентрата асцитической жидкости (заявка на изобретение «Способ лечения больных с синдромом внутрипеченочной портальной гипертензии» №2013128527, приоритет от 21.06.2013 г.).
Сущность метода заключается в том, что внутривенно со скоростью перфузии 60 капель в минуту вводят 500 мл приготовленного концентрата асцитической жидкости с добавлением в него интерлейкина-2 человеческого рекомбинантного в дозе 500 МЕ, при необходимости оставшуюся часть концентрата вводят дробно по 500 мл интраоперационно и в первые сутки после хирургического лечения.
Результаты. 12 пациентам с вирус-ассоцированнымHCV циррозом печени и признаками иммунной недостаточности по клеточному типу с дефицитом CD3⁺- и CD4⁺-позитивных лимфоцитов, снижением содержания CD4⁺CD25⁺-лимфоцитов и NK-клеток, дисиммуноглобулинемией в предоперационном периоде была выполнена реинфузия концентрата асцитической жидкости по ранее заявленной методике.
Состав асцитической жидкости был исследован кроме данной группы еще у 26 больных с ЦП, всего у 38 пациентов. При биохимическом исследовании определялось содержание общего белка и белковых фракций, мочевины, креатинина и билирубина. Количество общего белка в асцитической жидкости составляло от 17,6 до 42,8 г/л (28,2±9,6 г/л). Низкое его содержание было у больных, которым ранее неоднократно выполнялся лапароцентез. Содержание альбумина в процентах составило 49,4±5,3, α-глобулина –14,1±2,4, β-глобулина – 13,4±1,9, γ-глобулина – 24,5±3,6, средние молекулы были в пределах 0,386±0,045 у.е.
В среднем показатели цитоза составляли 297±174 клеток в 1 мм3. Основную часть клеток при микроскопии осадка составляли лимфоциты (69 %), меньшую – сегментоядерные нейтрофилы (10 %), моноциты (2 %), макрофаги (2 %), мезотелиальные клетки (6 %), а также мононуклеары (11 %).
После ультрафильтрации объем асцитической жидкости уменьшался от 5 до 10 раз, содержание общего белка возрастало до 49,3±18,4 г/л. Фракция альбумина повышалась до 52,2±6,8 %, а количество γ-глобулина снижалось.
После выполнения реинфузии концентрата асцитической жидкости показатели общего белка плазмы крови составили 52,4±9,3 г/л до переливания и 58,8±8,4 г/л после, % содержание альбумина — 41,7±14,4 и 47,2±6,4 соответственно. Процент содержания гамма-глобулина – 32,6±7,5 до переливания и 28,4±5,4 после переливания. Коэффициент (отношение альбуминов к глобулинам) составил 0,62±0,04 и 1,1±0,03 соответственно.
После выполнения реинфузии перед операцией спленоренального венозного шунтирования (8) или трансъюгулярного внутрипеченочного портоситемного шунтирования (4) ни одному из 12 пациентов не понадобилось дополнительное введение альбумина, не было выявлено признаков гнойных осложнений, послеоперационные раны в 8 наблюдениях после СВШ зажили первичным натяжением, стабилизировались показатели биохимического анализа крови (табл.1).
Таблица 1
Изменения показателей крови больных ЦП до и после лечения
Показатель | До лечения | После лечения |
Общий белок, г/л | 52,4±9,3 | 61,8±7,2 |
Альбумин, % | 43,3±13,9 | 49,2±7,8 |
Протромбиновый индекс, % | 71,5±14,3 | 79,2±12,8 |
Тромбоциты, х10/л 9 | 92,3±64,8 | 196,6±44,8 |
Билирубин, ммоль/л | 25,3±8,97 | 22,7±7,68 |
Мочевина, ммоль/л | 7,2±1,4 | 6,1±1,2 |
Креатинин, мкмоль/л | 110,3±23,9 | 104,3±23,8 |
АЛТ, ммоль/л·ч | 1,05±0,3 | 0,76±0,2 |
АСТ, ммоль/л·ч | 0,92±0,23 | 0,78±0,18 |
Таким образом, концентрат асцитической жидкости может быть использован для коррекции гипопротеинемии, которая присутствует у всех пациентов с вирус-ассоциированным ЦП, осложненным асцитом. Осуществление данного способа позволяет повысить эффективность комплексного лечения данной категории больных за счет собственных резервов, коррегировать имеющуюся иммунологическую дисфункцию, снизить потери аутобелка, коллоидов, ферментов, гормонов за счет реинфузии концентрата асцитической жидкости, а также снизить риск развития инфекционных осложнений и генерализованной инфекции путем раннего применения интерлейкина-2 человеческого рекомбинантного.
Рецензенты:
Перескоков С.В., д.м.н., доцент кафедры хирургических болезней №2 ГБОУ ВПО «Ростовский государственный медицинский университет Минздрава России», г. Ростов-на-Дону.
Хоронько Ю.В., д.м.н., заведующий кафедрой оперативной хирургии и топографической анатомии ГБОУ ВПО «Ростовский государственный медицинский университет Минздрава России», г. Ростов-на-Дону.
Библиографическая ссылка
Сапронова Н.Г., Сапронова Н.Г., Лукьянов С.В., Чигаева Е.В. ОСОБЕННОСТИ ЛЕЧЕНИЯ ПАЦИЕНТОВ С ВИРУС-АССОЦИИРОВАННЫМ ЦИРРОЗОМ ПЕЧЕНИ // Современные проблемы науки и образования. – 2013. – № 6.;
URL: https://science-education.ru/ru/article/view?id=10856 (дата обращения: 27.03.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник