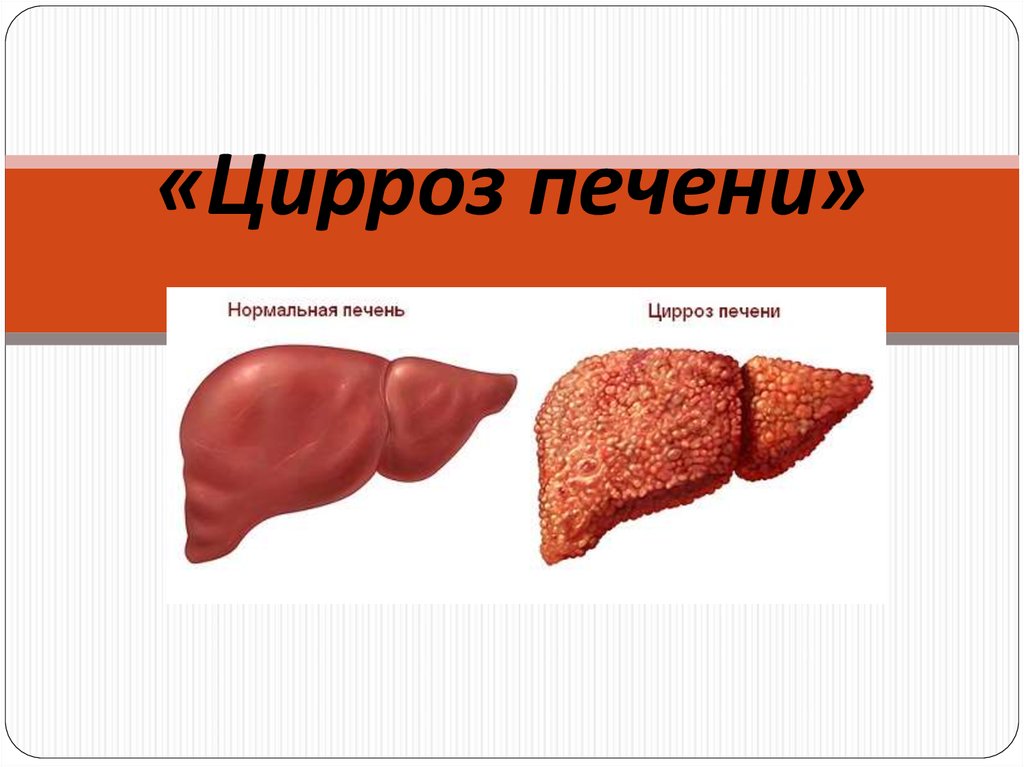
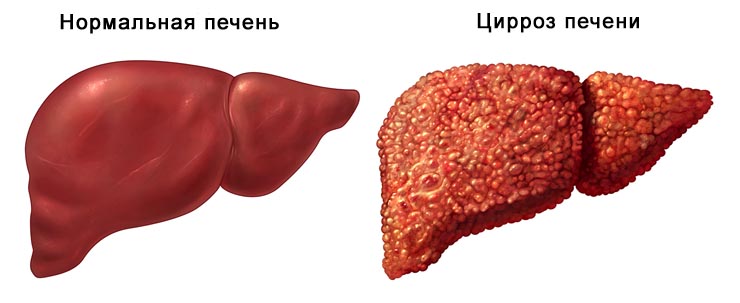
Цирроз печени от протеина
Человек, которого заинтересует вопрос о том, как взаимодействуют печень и протеин, может встретить во Всемирной информационной сети массу противоречивых утверждений, сделанных иногда людьми некомпетентными, но бесконечно уверенными в собственной правоте. Авторитетный тон таких публикаций, убедительно подобранные и профессионально изложенные аргументы способны убедить самого предвзятого читателя в безобидности растительного белка для человеческого организма. Из подобных опусов можно сделать вывод о безопасности протеина в любом возрасте, списать наличие побочных эффектов на некачественные или синтетические белковые соединения, содержащиеся в составе принимаемого средства.
Что такое протеин в спортивном питании
Популярное, активно продвигаемое усилиями маркетологов средство для тех, кто наращивает мышечную массу и занимается бодибилдингом. Распространенный вариант ответа на вопрос, что такое протеин – некорректен. Большинство пропагандистов уверяет потребителя в том, что это обычный белок растительного происхождения, которого не хватает в организме при усиленных тренировках. Поэтому и выпускаются различные добавки, в которых он содержится в концентрированном виде.
Такая формулировка дает видимый невооруженным глазом ответ на вопрос, вреден ли протеин для печени. Натуральное происхождение употребляемого состава, присутствие в нем белка, характерного для естественного белкового уровня, вспомогательная роль строительного материала без химических примесей – только некоторые аргументы в пользу употребления протеина.
Можно встретить убедительное устойчивое словосочетание – ключевая добавка (если речь идет о наращивании вожделенной мышечной массы), красочные эпитеты – универсальный и незаменимый, известный и популярный. И даже наукообразные термины – диетический компонент, спортивное питание, пищевая добавка. В последнем словосочетании характерным моментом является само определение – созданная на основе белковых смесей, с обязательным уточнением, что белок концентрированный.
Как такое производное может влиять на печень и вообще какое-либо негативное воздействие остается за кадром, потому что употребляется общий собирательный термин протеин. В реальности – это продукт, выпускаемый в разных видах, с вариабельным составом.
Внешний вид
Смесь для приема неизменно выпускается в порошкообразном виде, но цвета бывает разного. Ее окрас определяется популярными ароматизаторами: вкусом шоколада, клубники, ванили, апельсина (выбор богатый) и красителями, усиливающими вкусовые ассоциации. Часто встречается серый, белый и желтый, но и другие оттенки не исключены.
Ни ароматизаторы, ни красители не относятся к списку продуктов, рекомендованных при негативных состояниях печени. Во всех исследованиях по диете категорически запрещаются продукты с консерваторами и другими химическими добавлениями, призванными привлекать потребителя. Их присутствие в пищевых компонентах считается одним из вероятных провокаторов заболевания жизненно важного органа.
Составные компоненты
Состав предлагаемого БАДа редко соответствует заявленному 100%, концентрированному. В идеале он определяется принадлежностью к одной из трех распространенных категорий – сывороточныму концентрату, изоляту или гидролизату. Наибольшее – 90-95%, содержится в изоляте при условии, что это недешевый продукт от производителя с хорошей репутацией. Это касается только сывороточного протеина, который производится на промышленном уровне из коровьего молока.
Соевый, казеин, яичный или комплексный обладает своими особенностями и механизмами действия. Влияние на печень оказывает замедленное переваривание белковых соединений. Для мышц такой эффект считается положительным, потому что обеспечивает им пролонгированное питание. В большинстве добавок присутствует еще и стабилизатор, добавленный для закрепления действия ароматизатора, и подсластитель химического происхождения, заменяющий сахар.
Положительными моментами в составе активной добавки изготовители считают отсутствие углеводов, насыщенных и транс-жиров. Присутствие холестерина они оправдывают небольшим количеством, не оказывающим заметного влияния на его общий уровень в организме. Стевия, натуральный подсластитель, по мнению предвзято настроенных экспертов, даже обладает полезными, целебными свойствами и в некоторых странах используется в качестве разрешенной пищевой добавки.
Мнение о протеиновых смесях можно составить и самостоятельно, изучая по пунктам перечень компонентов, указанных на этикетке или в инструкции по применению. Но и в этом случае следует внимательно изучать то, что профессионально вуалируется маркетологами, заинтересованными в продаже продуктов с их содержанием. Например, о ксантиновой камеди в составе пищевых продуктов, безапелляционно утверждается, что она абсолютно безвредна – в одном источнике. В другом, между прочими хвалебными эпитетами упоминается, что ее постоянное или обильное применение приводит к расстройствам деятельности ЖКТ и метеоризму.
Удивительные аргументы в пользу
По мнению некоторых горе-экспертов, протеин отнюдь вредный – ведь он помогает снизить количество жиров и похудеть, уменьшить вес. При этом усваивается он быстрее (это интересный момент, если вспомнить приведенные ранее утверждения о пролонгированном действии и длительном обеспечении питания для мышц).
В качестве положительных моментов утверждается, что протеиновые батончики утоляют голод и не нуждаются в приготовлении, поэтому их можно использовать вместо полноценного пищевого перекуса. Весомым аргументом иногда служит то самое наличие других компонентов, которые, по предварительной аннотации к протеинам, как к концентрированному белку без примесей, напрочь в них отсутствуют.
Противопоказания
Проблема «печень и протеин» практически не рассматривается, но список противопоказаний включает индивидуальную невосприимчивость к отдельным компонентам – ведь существуют обменные нарушения, при которых люди не переносят лецитин (для яичного протеина), сою (при приеме белка, полученного из соевых бобов) или молоко коровы (сывороточный протеин). Отмечается, что при пониженной кислотности растительный и животный белок встречает заметные трудности в расщеплении и переваривании протеина, из-за чего может наблюдаться отравление продуктами расщепления.
Прием концентрированного продукта нежелателен при заболеваниях сердечно-сосудистой системы (особенно при гипотонии), патологиях выделительной системы, поскольку значительно увеличивает нагрузку на почки. Трудно представить себе спортсмена-сердечника или страдающего почечными патологиями. Однако и у здорового человека с предрасположенностью к ним опасное сочетание употребления протеина и интенсивных физических нагрузок способно спровоцировать развитие болезни.
Подробно расписывая пользу и утверждая, что активная добавка не помешает ни старику, ни ребенку, маркетологи и адепты «развенчивают мифы» о вреде белковых соединений для организма. Потенциальный вред, по их мнению, может быть только от передозировки или при употреблении некачественного продукта.
О вреде протеина для печени
Сколько-нибудь внятного объяснения, почему активная добавка может нанести непоправимый урон печени, найти невозможно, последние исследования на эту тему проводились в прошлом веке. В ходе экспериментов над мышами было обнаружено, что перерыв между употреблением значительного количества белка и новым его приемом способен вызвать именно в этом органе нежелательные эффекты.
Недавно в Америке заговорили о гепатотоксичности спортивного питания и даже привели некоторые впечатляющие цифры – 16% заболевших. Американская ассоциация по изучению болезней печени склонна считать вредными любые растительные и пищевые добавки, в том числе и так называемое спортивное питание. Основной аргумент – в отсутствии должного контроля за производителями, не соблюдающими предписанные технологии. Исследование таких препаратов показало несоответствие составу, указанному на этикетке, но из-за многочисленных вариантов добавлений не удалось отметить, что именно приводит к печеночным патологиям. Указано только, что количество заболевших увеличилось за десять лет почти в два раза:
- Те, кто утверждает, что белок не оказывает на экзокринную железу никакого вредного действия, в качестве аргумента приводят ежедневное расщепление печенью протеина, содержащегося в растительных и животных продуктах – пшенице, мясе, яйцах, сое, молочных продуктах. Они уверенны, что порошковый белок облегчает работу пищеварения, не заставляя работать дополнительно.
- Катализация (усвоение) белка – процесс постоянный. Его недостаток в пище приводит к задействованию накопленных резервов. Но в спортивном питании используется суперкатализация – иначе невозможно достижение желаемого эффекта. Это означает, что прием перекрывает естественные потребности и преследует целью рост мышечной массы.
- Но постоянная переработка количества, не расходуемого в процессе жизнедеятельности, не только увеличивает мышцы. Она дает дополнительную нагрузку на орган. Если в нем есть недиагностированные неполадки, это создаст определенные затруднения в работе. Ухудшение состояния закономерно наступает от перегрузки метаболитами избыточных реакций расщепления.
- Диета №5 при болезнях печени основана на соблюдении равновесия между белками, жирами и углеводами. В данном случае наблюдается избыток белка, который не менее вреден, чем злоупотребление жирами и углеводами. Поэтому гораздо лучше для здоровья придерживаться правильной сбалансированной диеты, в которую будут включены и мясо, и фрукты, и овощи. К примеру, можно извлечь пользу для печени из бананов.
В медицине категорические утверждения о безвредности допускаются только на основании клинических исследований, изучении механизма расщепления. Для переработанного компонента промышленным образом, он как следует не изучен и, вполне вероятно, отличается от того, каким организм получает его из продуктов питания.
Негативное влияние наблюдается и в том случае, если употребленный белок не востребован впоследствии, или не израсходован полностью физическими нагрузками. Опосредованный вред могут приносить экзокринной железе и развивающиеся обострения от побочных эффектов влияния протеина на сердечно-сосудистую систему и почки. Кроме того, некоторые спортсмены готовят протеиновые коктейли не на воде, и на молоке, опять-таки не задумываясь о том, насколько полезно молоко для печени, а тем более, в сочетании с таким большим количеством белка.
Источник
Вирусная этиология заболевания подтверждается выявлением специфических маркеров. Так, о циррозе печени, вызванном вирусом гепатита В (HBV) свидетельствует наличие в крови больных ДНК HBV, HBeAg, HBsAg, анти-НВс IgM и IgG, обнаружение в биоптатах печени при окраске орсеином маркеров вирусного происхождения. Установлена более высокая частота цирроза печени, вызванного хроническим вирусным гепатитом С (HCV), особенно генотипом I в. Подтверждением диагноза является индикация HCV РНК и антител к HCV в сыворотке крови. Цирроз печени вирусной этиологии характеризуется длительным течением с разными темпами прогрессирования, повторными обострениями, возникающими спонтанно или под влиянием провоцирующих факторов. Для цирроза печени, ассоциированного с HCV, характерен длительный латентный период, в течение которого он не распознается, однако после появления клинических признаков наблюдается быстрое прогрессирование процесса. Высокой циррозогенностью обладает вирус гепатита D (HDV), при котором появление морфологических признаков цирроза печени регистрируется уже в первые 1—2 года болезни. Клиническое течение характеризуется быстрым прогрессированием с высокой летальностью. В сыворотке крови таких больных обнаруживают HDV РНК, антитела к HDV классов М и G, а также HBsAg. HDAg нередко определяют в биоптатах печени. Активная фаза вирусного цирроза печени характеризуется температурной реакцией, гипергаммаглобулинемией, гипоальбумине- мией, повышением СОЭ, увеличением тимоловой пробы, повышением содержания иммуноглобулинов G, М и А, сенсибилизацией Т-лимфоцитов к липопротеиду печени человека, увеличением уровней АлАТ и АсАТ. Повышение содержания гамма-глобулинов до 30 % и тимоловой пробы до 8 ЕД характерны для умеренной, а более значительные сдвиги—для выраженной активности цирроза печени. Снижение уровня альбумина ниже 30 % и протромбинового индекса меньше 50 % считают прогностически неблагоприятным признаком (С.Н.Соринсон, 1998). Определенное значение в прогнозировании угрозы формирования цирроза печени вирусного генеза может иметь динамический контроль за содержанием альфа-фето- протеина в сыворотке крови.
Рис. Симптомы цирроза печени. Ладонная эритема
Алкогольный цирроз подтверждается указанием на длительное злоупотребление алкоголем, предшествующий острый алкогольный гепатит. Существенное значение имеют неврологические и соматические проявления алкоголизма. Об алкогольной этиологии цирроза печени свидетельствует сочетание таких морфологических признаков, как жировая инфильтрация гепатоцитов, мелкоузловое поражение, гепатоцеллюлярный фиброз. На более поздней стадии часто возникает макронодулярный вариант цирроза, а жировая дистрофия исчезает. Гистологически обнаруживают центролобулярное отложение гиалина Маллори, очаговую инфильтрацию нейтрофильными гранулоцитами вокруг гепатоцитов, крупнокапельное ожирение гепатоцитов, перицеллюлярный фиброз. Компенсированная стадия алкогольного цирроза обычно характеризуется малосимптомным течением. Печень увеличена, с гладкой поверхностью, нередко гепатомегалия является первым и единственным признаком заболевания. В стадии субкомпенсации появляются признаки недостаточности питания, миопатия, контрактура Дюпюитрена, внепеченочные сосудистые знаки, увеличение околоушных слюнных желез, выпадение волос и атрофия яичек. По мере прогрессирования процесса выявляют выраженные симптомы портальной гипертензии: варикозно расширенные вены пищевода и геморроидальные вены, асцит. Хронический алкоголизм обусловливает также наличие таких клинических симптомов и синдромов, как алкогольный гастрит (тошнота и рвота по утрам, боль в надчревной области), алкогольная энтеропатия (диарея), алкогольная невропатия (парестезии, снижение чувствительности, атрофия мышц), алкогольный миозит (болезненноть и слабость скелетных мышц), алкогольная миокардиопатия, алиментарный дисбаланс (красный язык, хейлоз), психические расстройства. У больных алкогольным циррозом печени выявляют анемию, диспротеинемию, повышение уровня билирубина, умеренное повышение активности аминотрансфераз. Иммунологические нарушения выражены незначительно, но в ряде случаев бывает отчетливое повышение содержания иммуноглобулинов класса А. В стадии декомпенсации алкогольного цирроза отмечают истощение больных, развитие тяжелой печеночно-клеточной недостаточности с желтухой, геморрагическим синдромом, лихорадкой, стабильным асцитом. Часто присоединяются такие осложнения, как асцит-перитонит, печеночная кома, желудочно-кишечные кровотечения и др. Особо быстро прогрессирующее течение характерно для цирроза печени, развивающегося на фоне аутоиммунного гепатита. Заболевание чаще встречается у женщин молодого возраста или в период менопаузы, сопровождается наличием аутоиммунных реакций, гипергаммаглобулинемией, высокой активностью индикаторов цитолитического синдрома, полисистемностью поражений, выраженными некротическими изменениями в ткани печени. Особой формой цирроза печени, связанной с длительным поражением желчных протоков, является билиарный цирроз. Различают первичный и вторичный билиарные циррозы печени.
Первичный билиарный цирроз (ПБЦ) — это хроническое прогрессирующее заболевание печени, протекающее с внутрипеченочным холестазом, характеризующееся деструкцией внутрипеченочных желчных протоков, портальным воспалением и фиброзом, способствующими развитию цирроза и печеночной недостаточности.
Хотя этиология ПБЦ неизвестна, механизм его развития связывают с аутоиммунными реакциями, направленными против антигенов гистосовместимости (HLA) клеток дуктулярного эпителия. У больных с ПБЦ отмечено преобладание генотипов HLA-DR2, DR3 и DR8. Болеют преимущественно женщины в возрасте старше 40 лет (соотношение женщин и мужчин составляет 10:1). При морфологическом исследовании выявляют аутоиммунную деструкцию мелких внутрипеченочных желчных протоков, сопровождающуюся холестазом, фиброз портальных трактов, нарушение архитектоники печени, появление узлов регенерации. Для ПБЦ характерно избыточное накопление в печени меди. Начальная стадия ПБЦ характеризуется появлением признаков холестаза: возникает зуд кожи, который приобретает постоянный характер и особенно усиливается по ночам. На первых этапах желтуха может быть незначительной или даже отсутствовать, больные жалуются на повышенную утомляемость, общее недомогание, боль в правом подреберье. Кожа сухая, со следами расчесов, приобретает серовато-коричневую пигментацию, что связывают с гиповитаминозом А. Размеры печени увеличены. Аутоиммунный характер патологического процесса определяет системность поражений при ПБЦ, что проявляется в виде дерматомиозита, аутоиммунного тиреоидита, гиперпаратиреоидизма, артралгии, периферической невропатии, почечного канальцевого ацидоза, гипосекреции поджелудочной железы. К ассоциированным с ПБЦ заболеваниям относят ревматоидный артрит, склеродермию, синдром Шегрена и мембранозный гломерулонефрит. При лабораторном исследовании выявляют повышенную активность щелочной фосфатазы и гамма-глютамилтранспептидазы в сыворотке крови, гиперлипемию и гиперхолестеринемию, умеренно повышенную активность сывороточных трансаминаз. Специфично определение антимитохондриальных антител. По мере прогрессирования процесса желтуха становится выраженной, часто наблюдаются ксантоматозные бляшки на коже — желто-коричневые бляшки, располагающиеся на веках (ксанте- лазмы), а также на ладонях, локтях, коленях, груди, спине (ксантомы), связанные с местным внутрикожным отложением холестерина. Характерным симптомом являются кольца Кайзера—Флейшнера. Это кольца коричневого цвета на периферии роговицы, связанные с накоплением меди. Можно обнаружить «сосудистые звездочки», «печеночные ладони», изменения пальцев в виде барабанных палочек. Печень всегда значительно увеличена, плотная, пальпируется селезенка. Появляются симптомы портальной гипертензии. Характерны изменения костной системы, возникающие в связи с нарушением метаболизма кальция, — боль в спине и ребрах, увеличение эпифизов костей, патологические переломы. Наряду с остеопорозом и остеомаляцией возможно развитие проксимальной миопатии. На поздних стадиях ПБЦ может развиться кифоз. При рентгенологическом исследовании выявляют деструкцию, декальцификацию позвоночного столба, ребер. Типичной является стойкая гипербнлирубинемия, гиперхолестеринемия, повышение уровня бета-глобулинов. Активность щелочной фосфатазы в 10 раз превышает норму, увеличено содержание желчных кислот в сыворотке крови , выявляют высокие показатели IgM в крови и антимито- хондриальные антитела. Снижается содержание Т-лимфоцитов- супрессоров в крови.
Вторичный билиарный цирроз печени (ВБЦ) развивается вследствие обструкции желчевыводящих протоков. При этом выделяют 3 уровня блока: 1) лобарный — от ворот печени до большого сосочка двенадцатиперстной кишки (врожденная атрезия и гипоплазия протоков, холелитиаз, опухоли, стриктуры общего желчного протока, первичный склерозирующий холангит); 2) лобулярный — внутри печени, но вне долек (атрезия или аплазия междольковых протоков, внутрипеченочный холангит); 3) каналикулярный (врожденный дефект синтеза желчных кислот, медикаментозный холестаз; Б.И.Шулутко, 1993). Механизм развития ВБЦ связывают с тем, что значительное повышение давления в протоках и токсическое воздействие избыточного содержания билирубина способствует возникновению тяжелых и распространенных некрозов гепатоцитов с последующим массивным склеротическим фиброзом. В то же время для ВБЦ не характерно самопрогрессирование, и устранение обструкции может даже способствовать обратному развитию процесса. Клинически ВБЦ проявляется в виде кожного зуда, желтухи, боли в правом подреберье. В связи с нарушением оттока желчи развиваются ахолия кала и стеаторея, нарушается усвоение жирорастворимых витаминов (A, D, К). Увеличены печень и селезенка. В отличие от ПБЦ обычно не отмечается увеличения содержания IgM в сыворотке крови. На фоне ВБЦ чаще возникают печеночные абсцессы, пиле- флебиты. Важным симптомом ВБЦ является неполная обтурация. При полной обтурации цирроз печени не успевает развиться, так как больной погибает вследствие острой печеночной недостаточности.
Декомпенсированная стадия, независимо от формы цирроза, характеризуется прогрессированием признаков функциональной недостаточности гепатоцитов с исходом в печеночную кому, а также развитием тяжелой портальной гипертензии с асцитом и кровотечениями из варикозно расширенных вен пищевода и желудка. В зависимости от степени выраженности поражения печени выделяют малую печеночную недостаточность (гепатодепрессию), при которой наблюдаются нарушения метаболических функций печени, не сопровождающиеся энцефалопатией, и большую печеночную недостатосность (гепатаргию), при которой глубокие изменения метаболизма в печени в комплексе с другими патологическими сдвигами приводят к развитию печеночной энцефалопатии.
Печеночная энцефалопатия представляет собой комплекс потенциально обратимых психических и нервно-мышечных нарушений, обусловленных тяжелой печеночной недостаточностью. Печеночная энцефалопатия у больных циррозом печени может развиться в связи с воздействием разрешающих факторов, к которым относят: желудочно-кишечные кровотечения, инфекции, в том числе бактериальный перитонит; прием седативных препаратов и транквилизаторов; прием алкоголя; избыточное употребление животных белков; хирургические вмешательства по поводу других заболеваний; парацентез с удалением большого количества асцитической жидкости; наслоение вторичной инфекции.
В патогенезе печеночной энцефалопатии и комы у одних больных преобладает фактор портокавального шунтирования крови со сравнительно более благоприятным прогнозом и хроническим рецидивирующим течением, у других — фактор тяжелой паренхиматозной недостаточности печени с неблагоприятным прогнозом, хотя цирроз печени предусматривает наличие обоих факторов. Печеночная энцефалопатия является результатом воздействия эндогенных нейротоксинов, которые в норме инактивируются в печени, аминокислотного дисбаланса, а также изменения функции нейротрансмиттеров и их рецепторов. Среди эндогенных церебротоксических веществ ведущее место занимает аммиак. При печеночной энцефалопатии скорость метаболизма аммиака и других токсинов в печени значительно снижается. Кроме того, аммиак попадает в общий кровоток по порто-кавальным анастомозам, минуя печень. В дальнейшем аммиак в неионизированной форме (1—3 % от всего аммиака крови) легко проникает через гематоэнцефалический барьер, оказывая токсическое влияние на ЦНС.
К группе эндогенных нейротоксинов относят также меркаптаны, коротко- и среднецепочечные жирные кислоты, производные фенола, индола. Меркаптаны представляют собой продукты бактериального гидролиза серусодержащих аминокислот (метионин, цистеин, цистин) в толстой кишке. В норме их обезвреживание происходит в печени. При печеночно-клеточной недостаточности возрастает концентрация меркаптанов в крови и они являются причиной особого, сладковатого «печеночного» запаха изо рта. Второй важной причиной печеночной энцефалопатии является аминокислотный дисбаланс, приводящий к синтезу ложных нейротрансмиттеров. При циррозе печени отмечается увеличение уровней ароматических аминокислот фенилаланина, тирозина и триптофана, а также снижение содержания аминокислот с разветвленной боковой цепью — валина, лейцина, изолейцина. Коэффициент Фишера (валин + лейцин + изолейцин/фенилаланин + тирозин), в норме равный 3—4,5, при печеночной энцефалопатии снижается до 1 и ниже. В результате повышенного поступления ароматических аминокислот в головной мозг образуются ложные медиаторы октопамин, Р-фенилэтаноламин, значительно менее активные, чем истинные медиаторы допамин и норадреналин. Наряду с этим, образующаяся в кишках гамма-аминомасляная кислота в результате портосистемного шунтирования крови попадает в общий кровоток и проникает в головной мозг, где дает тормозной эффект.
Таким образом, патогенез печеночной энцефалопатии складывается, с одной стороны, из накопления в крови церебротоксических веществ, а с другой — из нарушения кислотно-основного состояния и обмена электролитов. В результате этих нарушений ухудшаются процессы биологического окисления в мозге, уменьшается продукция энергии в мозговой ткани, угнетается деятельность ЦНС, что проявляется рядом неспецифических психических и неврологических расстройств. Клиническая картина печеночной энцефалопатии состоит из неспецифических расстройств психической деятельности, нервно-мышечных нарушений и изменений электроэнцефалограммы. В зависимости от степени выраженности этих проявлений выделяют 5 стадий печеночной энцефалопатии: 0 — субклиническая, латентная, при которой психическое состояние больных не нарушено, слабовыраженные изменения интеллекта и двигательные расстройства определяют только при выполнении психометрических тестов; I стадия (легкая) — эйфория, беспокойство, возбуждение, замедление психических реакций, нарушение сна, легкий мелкоразмашистый тремор, нарушение координации движений; II стадия (средней тяжести)—сонливость, нечеткая речь, дезориентация во времени, изменения личности, апатия, появляется крупнокалиберный «хлопающий» тремор (астериксис); III стадия (тяжелая) — выраженная дезориентация, ступор, неспособность к счету, неадекватное поведение, гиперрефлексия, нистагм, патологические рефлексы (Гордона, Бабинского, Жуковского, хоботковый, хватательный), гипервентиляция; IV стадия (кома)—отсутствие сознания и реакции на боль, арефлексия, потеря мышечного тонуса (Н.О.Сопп, 1979).
Для оценки степени нарушения функции мозга при печеночной энцефалопатии используют психометрические тесты (тест связи чисел и тест линии), а также электроэнцефалографию, при которой выявляют медленные, высокоамплитудные трехфазные волны. Определенное прогностическое значение, указывающее на возможность развития печеночной комы, имеет резкое снижение факторов свертывания крови — протромбина, проакцелерина, проконвертина.
Источник: studfile.net
Читайте также
Вид:


Источник