Цирроз печени в эксперименте
Изобретение относится к медицине, экспериментальной хирургии. Цирроз печени у кроликов воспроизводят путем подкожного введения тетрахлоруглерода. Измеряют сатурацию в левом, нижнем и правом краях большого сальника. При сатурации 87-97% рассекают большой сальник на 3-6 лоскутов. В каждом лоскуте две сальниковые артерии, анастомозирующие друг с другом. На диафрагмальной поверхности печени, на глубине от 0,5 см до 1,0 см формируют каналы длиной от 7,0 см до 10,0 см на расстоянии 2,0-3,0 см друг от друга. Проводят рассеченные участки большого сальника через печеночную ткань. Способ позволяет осуществить разгрузку портального кровотока при циррозе печени с компенсированным и декомпенсированным синдромом портальной гипертензии за счет образования коллатералей между сосудами печени и большого сальника. 5 ил.
Изобретение относится к медицине, а именно к экспериментальной хирургии, может быть использовано для разгрузки портального кровотока при циррозе печени с компенсированным и субкомпрессированным синдромом портальной гипертензии.
Низкая эффективность терапевтического лечения хронических заболеваний печени послужила причиной появления разнообразных методов хирургического воздействия на патологически измененный орган. Предложено множество вариантов этих операций (портокавальные анастомозы, органопексия), каждый из которых имеет свои достоинства и недостатки. К последним относится: высокая степень операционного риска, сложность технического исполнения, требуют знания и навыков «сосудистых швов» хирургов.
Аналогом изобретения является способ лечения синдрома портальной гипертензии при циррозе печени, включающем лапаротомию, оментогепатопексию; в печени формируют ложе путем ультразвуковой кавитации ткани печени с выделением сосудов, а прядь большого сальника укладывают в сформированное ложе /«Способ оментогепатопексии при портальной гипертензии». Патент РФ 2368329. Ганцев Ш.Х., Абдурахманов Б.А., Кулакеев O.K., Адыбжанов Д./.
Предлагаемый способ осуществляется следующим образом. Под наркозом осуществляют верхнесрединную лапаротомию, на диафрагмальной поверхности печени предварительно надсекают капсулу и производят ультразвуковую кавитацию ткани печени аппаратом Ly Sonix 3000 фирмы Byron Medical. Inc., выделяют печеночные сосуды. Далее в сформированное ложе укладывают прядь большого сальника и прошивают их между собой викрилом. После этого операционную рану послойно ушивают. В последующем за счет неспецифического воспаления и процессов грануляции в этой области формируются спайки с образованием сосудистых связей между печеночными и сальниковыми сосудами и формируется окольный кровоток, который приводит к разгрузке портального бассейна.
Недостатками данного способа, взятого в качестве аналога, являются: уложенная в печеночное ложе прядь большого сальника не полностью соприкасается с печеночной тканью, ограничивая количество сосудистых связей между печеночными и сальниковыми сосудами; не учитывается степень сатурации (SpO2) участков большого сальника, укладываемых в печеночное ложе; в пряди сальника не учитывается количество сальниковых артерий, что приводит к недостаточности кровоснабжения.
Прототипом изобретения является «Туннельная оментогепатопексия для лечения цирроза печени (экспериментальное исследование)» (З.М. Сигал, Ф.Г. Бабушкин, Ю.В. Елмашев, СВ. Бартов, А.К. Шубин, О.А. Анисимова; Материалы III межрегиональной заочной научно-практической конференции. ИГМА, г. Ижевск, 2011).
Большой сальник разрезается в вертикальном направлении на участке количестве от 3 до 5, длиной от 5-10 см. Через левую и правую доли печени тупым способом проводится зажим в горизонтальной плоскости, захватывая участки большого сальника на сосудистой ножке, и проводили их через печеночную ткань длиной от 5 до 10 см: толщина печеночной ткани от Глиссоновой капсулы до участка сальника была не больше 0,5 см (туннельная оментогепатопексия). Концы проведенных участков сальника фиксировали узловыми кетгутовыми швами к печеночной ткани.
Недостатком этого способа является:
1. Проведение зажима в горизонтальной плоскости ведет к перегибу сальниковых лоскутов с сосудами, что ограничивает кровоснабжение печеночной ткани.
2. Фиксация участков сальника к печеночной ткани может приводить к некрозу сальника и печеночной ткани.
3. При оментогепатопексии для лечения цирроза печени не определяли сатурацию сосудов большого сальника не только в левом крае сальника, но и в нижнем, правом краях; не определялись показания к операции по процентам жизнеспособности лоскутов большого сальника.
4. В прототипе не было также обоснования длины рассечения лоскутов сальника, глубины погружения сальника в печеночную ткань, расстояния между туннелями с лоскутами. Все это может вызвать малую эффективность операции и послеоперационные осложнения: внутрипеченочные гематомы, повреждение желчных путей и внутрипеченочных сосудов, разрыв печени с выходом лоскута сальника на поверхность печени с образованием спаечной непроходимости. Кроме того, такая операция может закончиться некрозом сальника в связи с тем, что одна сальниковая артерия слишком мала по калибру для кровоснабжения каждого туннеля, поэтому в каждом сальниковом лоскуте должно быть не менее двух артерий.
Задачей данного изобретения является повышение эффективности разгрузки портального кровообращения при циррозах печени с компенсированным и декомпенсированным синдромом портальной гипертензии.
Предлагаемый способ осуществляется следующим образом.
В экспериментах на животных (кролики) цирроз печени вызывали по методике В.Г. Глаура (1977) путем подкожных инъекций четыреххлористого углерода из расчета 0,6 мл/кг в течение 9 дней. Через 10-15 дней после инъекций наступали признаки печеночной недостаточности (снижение веса, аппетита, гиподинамия, повышение билирубина крови).
При наличии клинических признаков цирроза печени животным (20) под местной анестезией Sol. Novocaini 0,25% раствором осуществляют верхнесрединную лапаротомию. Определяют сатурацию (SpO2) кислородом гемоглобина артериальной крови в левом (не менее 97%), нижнем (не менее 93%) и правом краях (не менее 87%) участков большого сальника пульсоксиметром VX «Armed» контактным способом.
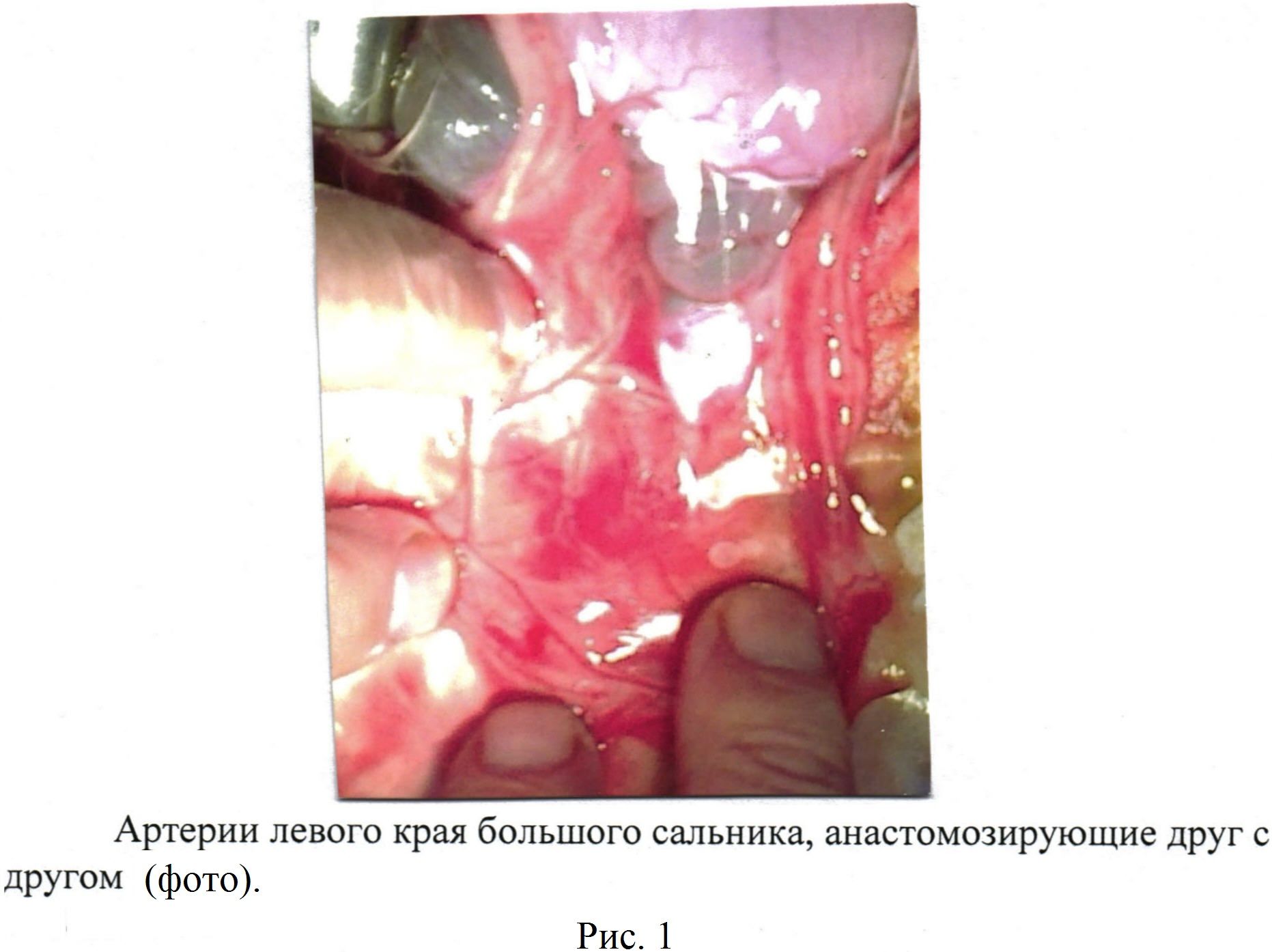
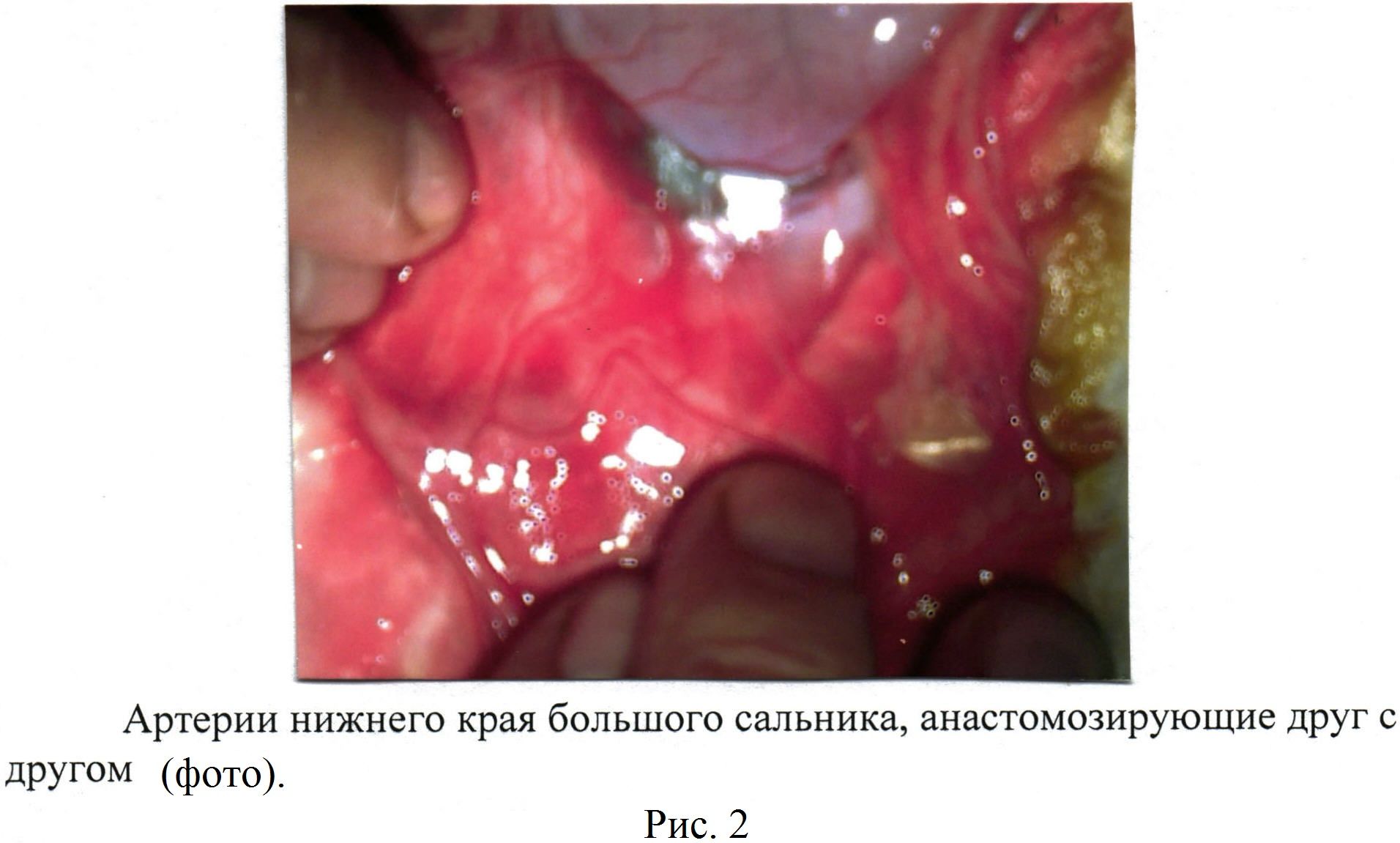
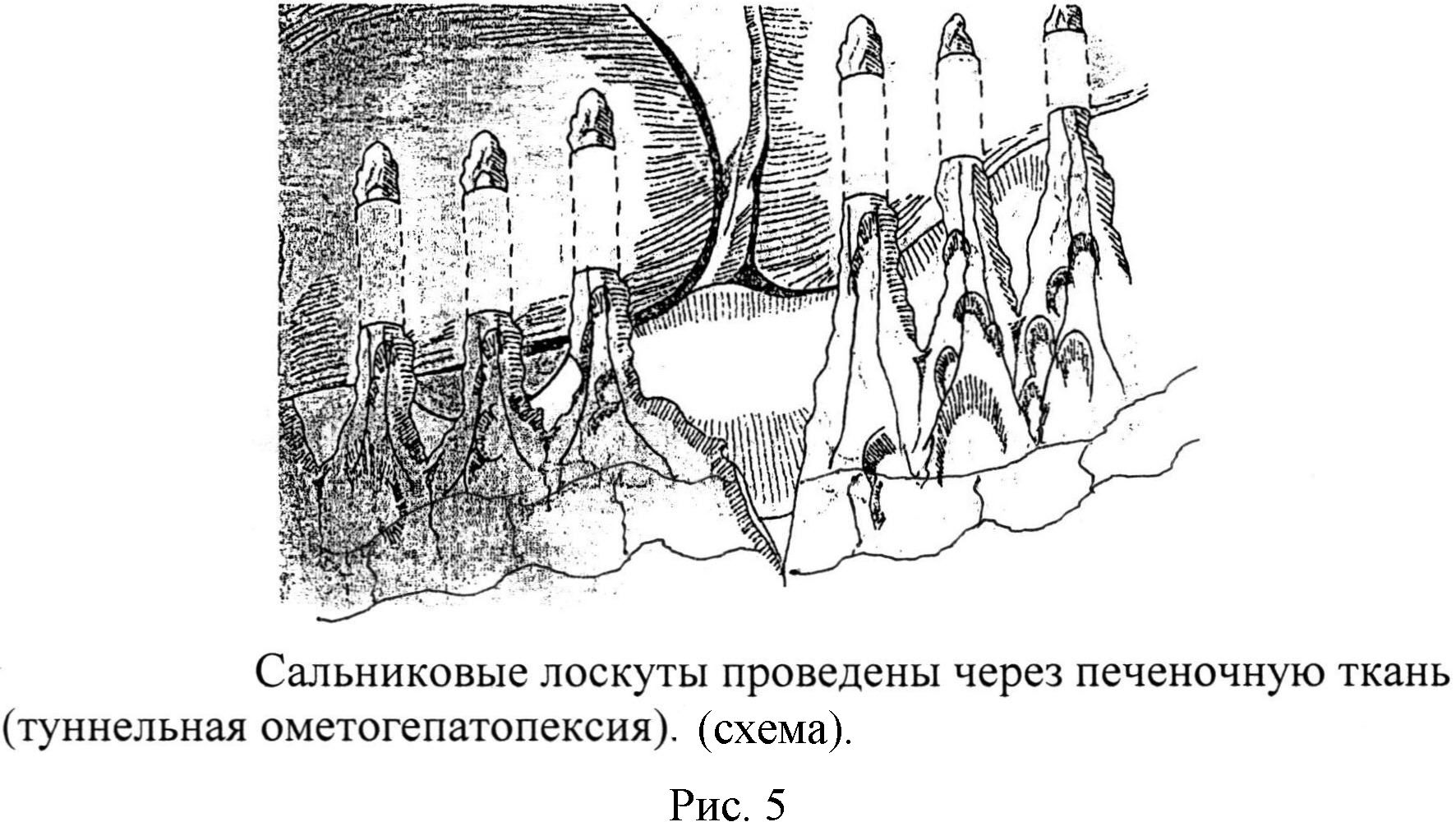
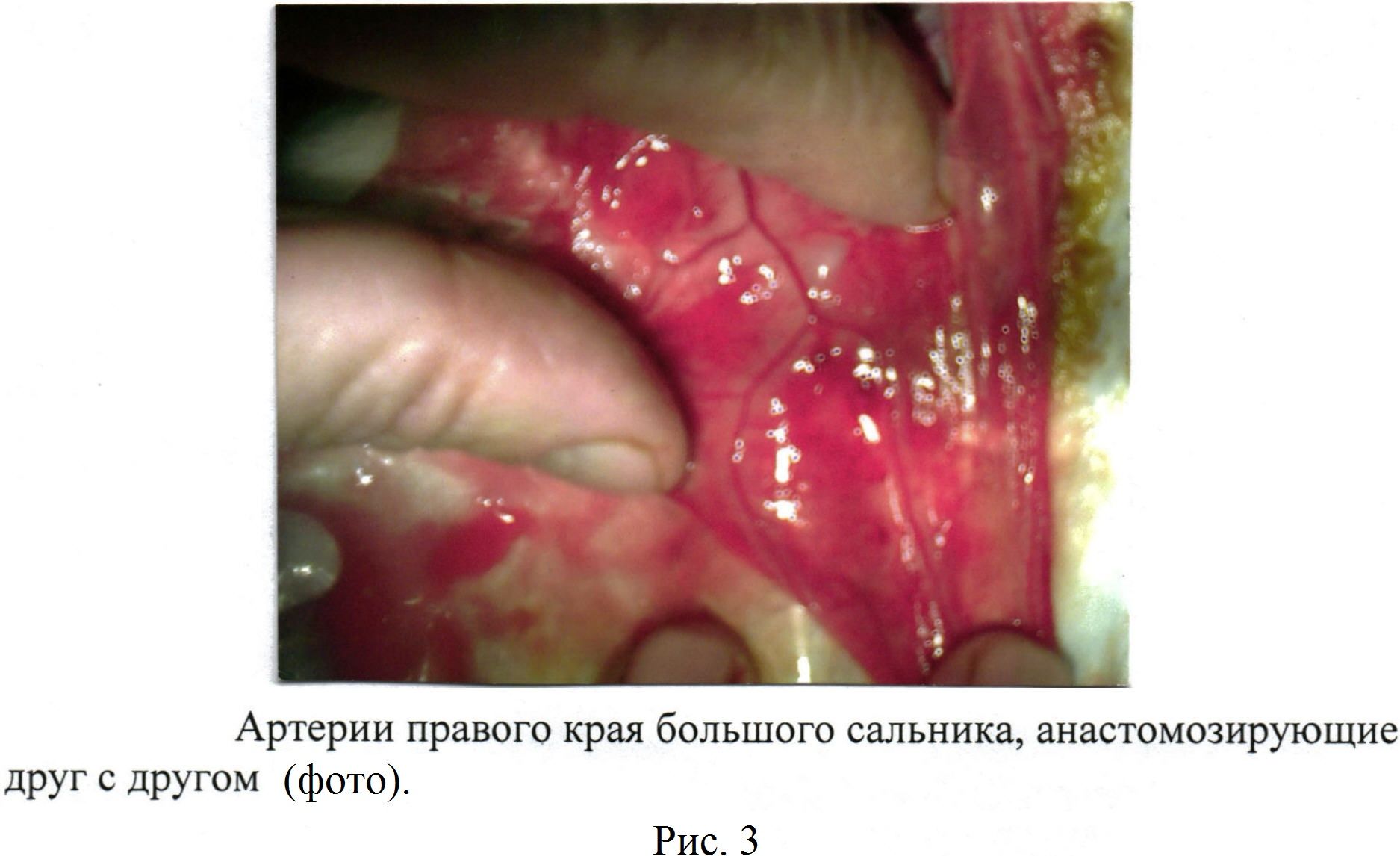
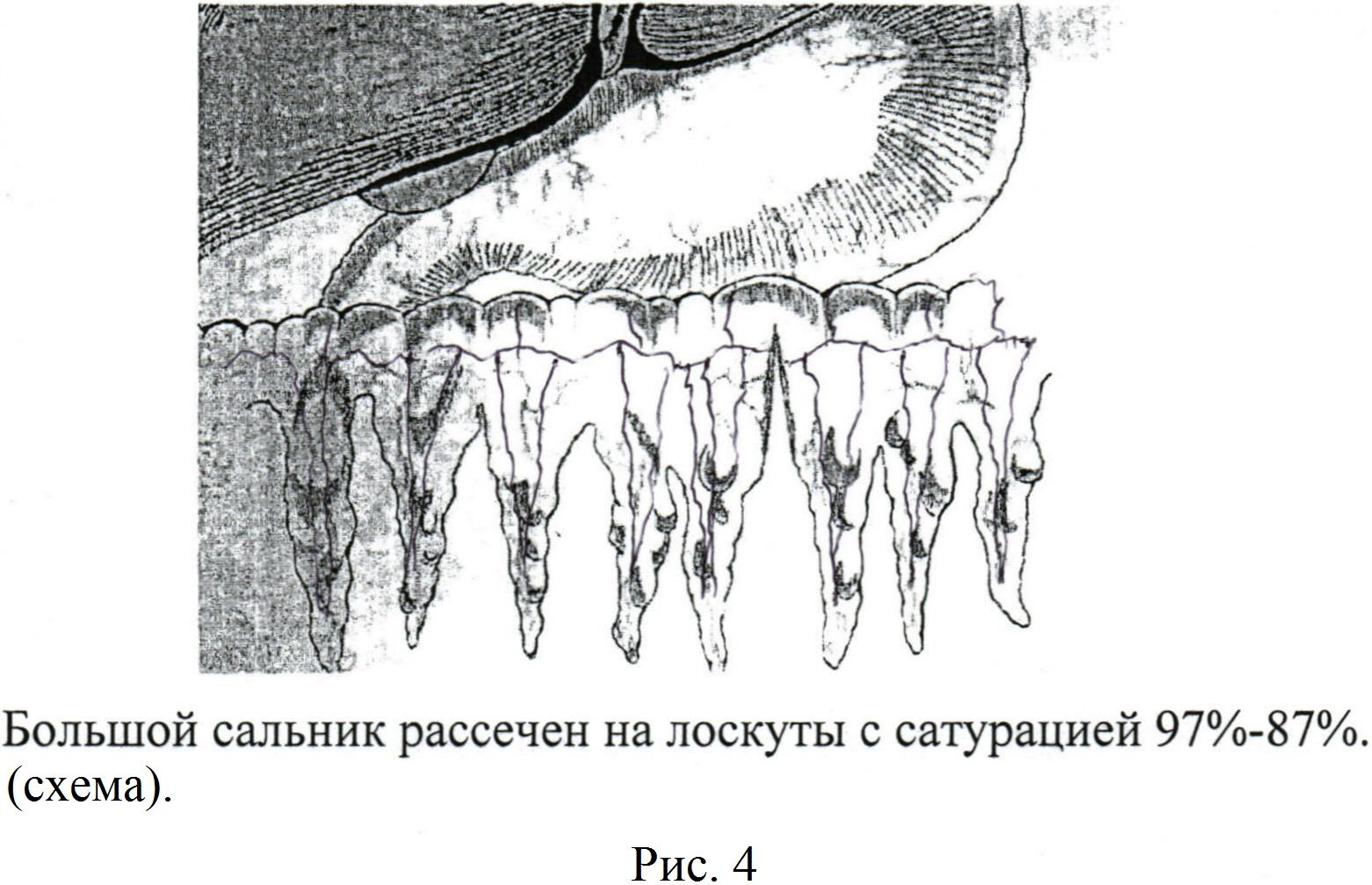
Выкраивают лоскуты большого сальника с двумя сальниковыми артериями, анастомозирующими друг с другом [рис. 1, 2, 3] в количестве от 3 до 6 длиной от 10,0 см до 15,0 см [рис 4]. На диафрагмальной поверхности печени изогнутым зажимом проводят проходы (туннели) на глубине от 0,5 см до 1,0 см печеночной ткани (не повреждаются крупные печеночные сосуды и желчные пути) длиной от 7,0 см до 10,0 см и, захватив сальниковый лоскут большого сальника, проводят его внутри канала на расстоянии 2,0-3,0 см друг от друга (туннельная оментогепатопексия) [рис 5].
Выведенные концы участков большого сальника фиксируют к Глиссоновой капсуле кетгутовым швом. Брюшная полость ушивается наглухо. В послеоперационном периоде внутрибрюшного кровотечения и желчеистечения не отмечалось (сальник обладает гемостатическим свойством). Летальных исходов не наблюдалось.
Для гистологического изучения развития коллатералей сосудов большого сальника в печеночной ткани животные забивались на 10 и 20 сутки после операции.
Гистологическое исследование (10 кроликов), проведенное через 10 суток после операции, показало: неполный септальный цирроз, вблизи большого сальника неспецифический реактивный гепатит с инфильтрацией нейтрофилами. В сальнике новообразованные капилляры с признаками полнокровия.
Гистологическое исследование (10 кроликов), проведенное через 20 суток после операции, показало: вторичный билиарный цирроз печени; выраженный интрацеллюлярный и внутрилокальный холестаз. Умеренная их лимфоидная инфильтрация, жировая и белковая дистрофия гепатоцитов. Компенсаторная гипертрофия отдельных гепатоцитов. Большое количество разнокалиберных сосудов в сальнике.
Таким образом, результаты проведенных морфологических исследований показали, что в предложенном способе процесс репаративной регенерации в зоне оментогепатопексии протекает с образованием большого количества сосудистых коллатералей.
Способ хирургического лечения цирроза печени, включающий лапаротомию, рассечение большого сальника на лоскуты и проведение зажимом рассеченных участков большого сальника по каналам, отличающийся тем, что измеряют сатурацию сосудов большого сальника в левом, нижнем и правом его краях и при установлении жизнеспособности большого сальника рассекают его на лоскуты, в каждом из которых находятся две сальниковые артерии; зажимом проводят каналы на диафрагмальной поверхности печени на глубине от 0,5 до 1,0 см.
Источник
Аннотация:
Изобретение относится к медицине, экспериментальной хирургии. Цирроз печени у кроликов воспроизводят путем подкожного введения тетрахлоруглерода. Измеряют сатурацию в левом, нижнем и правом краях большого сальника. При сатурации 87-97% рассекают большой сальник на 3-6 лоскутов. В каждом лоскуте две сальниковые артерии, анастомозирующие друг с другом. На диафрагмальной поверхности печени, на глубине от 0,5 см до 1,0 см формируют каналы длиной от 7,0 см до 10,0 см на расстоянии 2,0-3,0 см друг от друга. Проводят рассеченные участки большого сальника через печеночную ткань. Способ позволяет осуществить разгрузку портального кровотока при циррозе печени с компенсированным и декомпенсированным синдромом портальной гипертензии за счет образования коллатералей между сосудами печени и большого сальника. 5 ил.
Основные результаты:
Способ хирургического лечения цирроза печени, включающий лапаротомию, рассечение большого сальника на лоскуты и проведение зажимом рассеченных участков большого сальника по каналам, отличающийся тем, что измеряют сатурацию сосудов большого сальника в левом, нижнем и правом его краях и при установлении жизнеспособности большого сальника рассекают его на лоскуты, в каждом из которых находятся две сальниковые артерии; зажимом проводят каналы на диафрагмальной поверхности печени на глубине от 0,5 до 1,0 см.
Изобретение относится к медицине, а именно к экспериментальной хирургии, может быть использовано для разгрузки портального кровотока при циррозе печени с компенсированным и субкомпрессированным синдромом портальной гипертензии.
Низкая эффективность терапевтического лечения хронических заболеваний печени послужила причиной появления разнообразных методов хирургического воздействия на патологически измененный орган. Предложено множество вариантов этих операций (портокавальные анастомозы, органопексия), каждый из которых имеет свои достоинства и недостатки. К последним относится: высокая степень операционного риска, сложность технического исполнения, требуют знания и навыков «сосудистых швов» хирургов.
Аналогом изобретения является способ лечения синдрома портальной гипертензии при циррозе печени, включающем лапаротомию, оментогепатопексию; в печени формируют ложе путем ультразвуковой кавитации ткани печени с выделением сосудов, а прядь большого сальника укладывают в сформированное ложе /«Способ оментогепатопексии при портальной гипертензии». Патент РФ 2368329. Ганцев Ш.Х., Абдурахманов Б.А., Кулакеев O.K., Адыбжанов Д./.
Предлагаемый способ осуществляется следующим образом. Под наркозом осуществляют верхнесрединную лапаротомию, на диафрагмальной поверхности печени предварительно надсекают капсулу и производят ультразвуковую кавитацию ткани печени аппаратом Ly Sonix 3000 фирмы Byron Medical. Inc., выделяют печеночные сосуды. Далее в сформированное ложе укладывают прядь большого сальника и прошивают их между собой викрилом. После этого операционную рану послойно ушивают. В последующем за счет неспецифического воспаления и процессов грануляции в этой области формируются спайки с образованием сосудистых связей между печеночными и сальниковыми сосудами и формируется окольный кровоток, который приводит к разгрузке портального бассейна.
Недостатками данного способа, взятого в качестве аналога, являются: уложенная в печеночное ложе прядь большого сальника не полностью соприкасается с печеночной тканью, ограничивая количество сосудистых связей между печеночными и сальниковыми сосудами; не учитывается степень сатурации (SpO2) участков большого сальника, укладываемых в печеночное ложе; в пряди сальника не учитывается количество сальниковых артерий, что приводит к недостаточности кровоснабжения.
Прототипом изобретения является «Туннельная оментогепатопексия для лечения цирроза печени (экспериментальное исследование)» (З.М. Сигал, Ф.Г. Бабушкин, Ю.В. Елмашев, СВ. Бартов, А.К. Шубин, О.А. Анисимова; Материалы III межрегиональной заочной научно-практической конференции. ИГМА, г. Ижевск, 2011).
Большой сальник разрезается в вертикальном направлении на участке количестве от 3 до 5, длиной от 5-10 см. Через левую и правую доли печени тупым способом проводится зажим в горизонтальной плоскости, захватывая участки большого сальника на сосудистой ножке, и проводили их через печеночную ткань длиной от 5 до 10 см: толщина печеночной ткани от Глиссоновой капсулы до участка сальника была не больше 0,5 см (туннельная оментогепатопексия). Концы проведенных участков сальника фиксировали узловыми кетгутовыми швами к печеночной ткани.
Недостатком этого способа является:
1. Проведение зажима в горизонтальной плоскости ведет к перегибу сальниковых лоскутов с сосудами, что ограничивает кровоснабжение печеночной ткани.
2. Фиксация участков сальника к печеночной ткани может приводить к некрозу сальника и печеночной ткани.
3. При оментогепатопексии для лечения цирроза печени не определяли сатурацию сосудов большого сальника не только в левом крае сальника, но и в нижнем, правом краях; не определялись показания к операции по процентам жизнеспособности лоскутов большого сальника.
4. В прототипе не было также обоснования длины рассечения лоскутов сальника, глубины погружения сальника в печеночную ткань, расстояния между туннелями с лоскутами. Все это может вызвать малую эффективность операции и послеоперационные осложнения: внутрипеченочные гематомы, повреждение желчных путей и внутрипеченочных сосудов, разрыв печени с выходом лоскута сальника на поверхность печени с образованием спаечной непроходимости. Кроме того, такая операция может закончиться некрозом сальника в связи с тем, что одна сальниковая артерия слишком мала по калибру для кровоснабжения каждого туннеля, поэтому в каждом сальниковом лоскуте должно быть не менее двух артерий.
Задачей данного изобретения является повышение эффективности разгрузки портального кровообращения при циррозах печени с компенсированным и декомпенсированным синдромом портальной гипертензии.
Предлагаемый способ осуществляется следующим образом.
В экспериментах на животных (кролики) цирроз печени вызывали по методике В.Г. Глаура (1977) путем подкожных инъекций четыреххлористого углерода из расчета 0,6 мл/кг в течение 9 дней. Через 10-15 дней после инъекций наступали признаки печеночной недостаточности (снижение веса, аппетита, гиподинамия, повышение билирубина крови).
При наличии клинических признаков цирроза печени животным (20) под местной анестезией Sol. Novocaini 0,25% раствором осуществляют верхнесрединную лапаротомию. Определяют сатурацию (SpO2) кислородом гемоглобина артериальной крови в левом (не менее 97%), нижнем (не менее 93%) и правом краях (не менее 87%) участков большого сальника пульсоксиметром VX «Armed» контактным способом.
Выкраивают лоскуты большого сальника с двумя сальниковыми артериями, анастомозирующими друг с другом [рис. 1, 2, 3] в количестве от 3 до 6 длиной от 10,0 см до 15,0 см [рис 4]. На диафрагмальной поверхности печени изогнутым зажимом проводят проходы (туннели) на глубине от 0,5 см до 1,0 см печеночной ткани (не повреждаются крупные печеночные сосуды и желчные пути) длиной от 7,0 см до 10,0 см и, захватив сальниковый лоскут большого сальника, проводят его внутри канала на расстоянии 2,0-3,0 см друг от друга (туннельная оментогепатопексия) [рис 5].
Выведенные концы участков большого сальника фиксируют к Глиссоновой капсуле кетгутовым швом. Брюшная полость ушивается наглухо. В послеоперационном периоде внутрибрюшного кровотечения и желчеистечения не отмечалось (сальник обладает гемостатическим свойством). Летальных исходов не наблюдалось.
Для гистологического изучения развития коллатералей сосудов большого сальника в печеночной ткани животные забивались на 10 и 20 сутки после операции.
Гистологическое исследование (10 кроликов), проведенное через 10 суток после операции, показало: неполный септальный цирроз, вблизи большого сальника неспецифический реактивный гепатит с инфильтрацией нейтрофилами. В сальнике новообразованные капилляры с признаками полнокровия.
Гистологическое исследование (10 кроликов), проведенное через 20 суток после операции, показало: вторичный билиарный цирроз печени; выраженный интрацеллюлярный и внутрилокальный холестаз. Умеренная их лимфоидная инфильтрация, жировая и белковая дистрофия гепатоцитов. Компенсаторная гипертрофия отдельных гепатоцитов. Большое количество разнокалиберных сосудов в сальнике.
Таким образом, результаты проведенных морфологических исследований показали, что в предложенном способе процесс репаративной регенерации в зоне оментогепатопексии протекает с образованием большого количества сосудистых коллатералей.
Способ хирургического лечения цирроза печени, включающий лапаротомию, рассечение большого сальника на лоскуты и проведение зажимом рассеченных участков большого сальника по каналам, отличающийся тем, что измеряют сатурацию сосудов большого сальника в левом, нижнем и правом его краях и при установлении жизнеспособности большого сальника рассекают его на лоскуты, в каждом из которых находятся две сальниковые артерии; зажимом проводят каналы на диафрагмальной поверхности печени на глубине от 0,5 до 1,0 см.
Источник
Аннотация:
Изобретение относится к экспериментальной медицине и может быть применимо для лечения цирроза печени в эксперименте стимуляцией репаративной регенерации. Осуществляют дистрофирующее защемление на время репарации маргинального участка печени клипсой, выполненной в виде двух сомкнутых, дугообразных, замкнутых попарно концами, волнообразно изогнутых в плоскости смыкания браншей из никелид-титановой проволоки с эффектом памяти формы и сверхэластичности. Способ уменьшает интраоперационную травматизацию. 5 ил.
Печень выполняет множество жизненно важных функций. Это орган, принимающий важнейшее участие в процессах обмена веществ, кровообращении, пищеварении. Неразрывно связаны с работой печени и такие процессы как гормональный, витаминный, белковый, жировой, углеводный, пигментный, минеральный, водный обмены. Печень необходима для поддержания внутренней среды организма человека на постоянном, необходимом для него уровне. В печени осуществляются защитные, обезвреживающие, выделительные и ферментативные функции. Ее обследование обязательно в процессе диагностики различных заболеваний. Лечение печени имеет давнюю историю и обширный реестр способов.
Повышенная, по сравнению с другими органами, способность печени к регенерации используется как основной фактор в ряде хирургических способов лечения заболеваний, в частности, цирроза печени. В обобщенном виде сущность способов состоит в воздействии на какой-либо участок или участки печени, угнетает паренхиму этого участка. Компенсаторная реакция органа приводит к репарационной трансформации гепатоцитов нетронутого объема. Известные способы лечения заболеваний печени, использующие этот феномен, получили общее название «стимуляция репаративной регенерации печени». Теоретическое обоснование данной способности печени отсутствует. Практические результаты лечения, достойные применения, получены чисто эмпирическим путем.
Известен способ стимуляции регенерации печени [RU 2000111690], заключающийся в прижигании капсулы печени в шахматном порядке силой тока 8 мА с шириной шага 2,0 см. Способ может приводить к осложнениям в виде выраженного спаечного процесса, развития реактивного плеврита.
Известен способ хирургического лечения цирроза печени [RU 2186545], заключающийся в последовательном введении источника высокоинтенсивного лазерного излучения в ткань печени в точках, расположенных с шагом 1,5-2,0 см на глубину, по меньшей мере, 1,0 см. Повреждающее воздействие осуществляют излучением неодимового или диодного лазеров мощностью, по меньшей мере, 1,0 Вт. При данном способе возможно повреждение трубчатых структур печени, таких как сосуды и желчные протоки.
Известен способ лечения печеночной недостаточности [RU 2586952] заключающийся в имплантации в паренхиму печени клеточно-инженерной конструкции. Матрикс из децеллюляризированной донорской печени млекопитающего в объеме 1:1, в течение 8-12 часов, при температуре 4°С инкубируют в растворе с рН 7,4. Состав раствора: 138 мл NaCl, 2,67 мл КСl, 1,47 мл КН2РО4, 8,1 мл Nа2НРO4, фибронектин и ламинин по 10 мкг/мл, дистиллированная вода до 1 л. Проводят сокультивирование клеток печени и стволовых клеток костного мозга в течение 2-4 суток количестве 2×106-15×106 на 1 см матрикса. Матрикс с клетками объемом не менее 0,05 см3 смешивают с коллагенсодержащим гидрогелем в объеме 3:1. Размеры частиц матрикса от 200 до 700 мкм, пор не более 50 мкм, пористость 70-85%. Данный способ дорогостоящ, требует наличия специального оборудования, трудновыполним.
Этот способ, принятый за прототип, как и иные сходные с ним аналоги включают деструкцию печеночной ткани различными физическими агентами или механическим путем, что содержит риск повреждения трубчатых структур печени с последующим кровотечением или желчеистечением, риск развития выраженного воспалительного ответа с образованием спаек, реактивного плеврита, кишечной непроходимости. Высок риск абсцедирования и инфицирования органа на фоне деструкции печеночной ткани.
Технический результат предлагаемого решения — снижение интраоперационной травматизации. Указанный технический результат достигается тем, что в способе лечения цирроза печени стимуляцией репаративной регенерации гепатоцитов путем физического воздействия на паренхиму ограниченного участка (участков) печени указанное воздействие осуществляют дистрофирующим защемлением на время репарации маргинального участка печени клипсой, выполненной в виде двух сомкнутых, дугообразных, замкнутых попарно концами, волнообразно изогнутых в плоскости смыкания браншей из никелид-титановой проволоки с эффектом памяти формы и сверхэластичности.
Достижимость технического результата обусловлена комплексом отличительных признаков, доминантой которого является осуществление неинвазивного недеструктивного воздействия на печень, путем механического ущемления локального участка печени клипсой из никелида титана. Благодаря сверхэластичному свойству деформации этого материала, компрессия при защемлении маргинального участка органа осуществляется мягко, без ранения, и приводит к плавному снижению трофики и атрофии ткани этого участка. Волнообразно развитая структура браншей клипсы обеспечивает пониженное удельное давление на защемляемую ткань и, тем самым, ее травмобезопасность.
Замедленной динамике процесса соответствует ответная реакция нетронутого объема органа, вышеупомянутая репаративная регенерация печени. Репродуктивным процессам в организме свойственны такие темпы. Конечный результат репродукции при этом проявляется наиболее полно. В данном случае это касается восстановления функциональной состоятельности гепатоцитов, их пролиферации. Экспериментальные результаты проверки способа подтверждают этот факт на фоне аналогов уровня техники, включая способ-прототип.
Наглядным доказательством достижимости технического результата является отсутствие инвазивного вторжения в печень. К исходу действия клипсы, т.е. неполному смыканию ее браншей, между ними остаются оболочечные ткани, сохраняющие герметизм органа и исключающие кровопотерю из органа, желчеистечение и риск инфицирования.
Перечисленные технические особенности способа приводят к состоятельности стимуляции репаративной регенерации печени.
Комплекс отличительных признаков способа в их причинно-следственной связи с техническим результатом оригинален, что свидетельствует о соответствии предложения критерию «изобретательский уровень». На иллюстрациях представлено:
Фиг. 1. Клипса для стимуляции репаративной регенерации печени.
Фиг. 2. Наложение клипсы. Фрагмент операции.
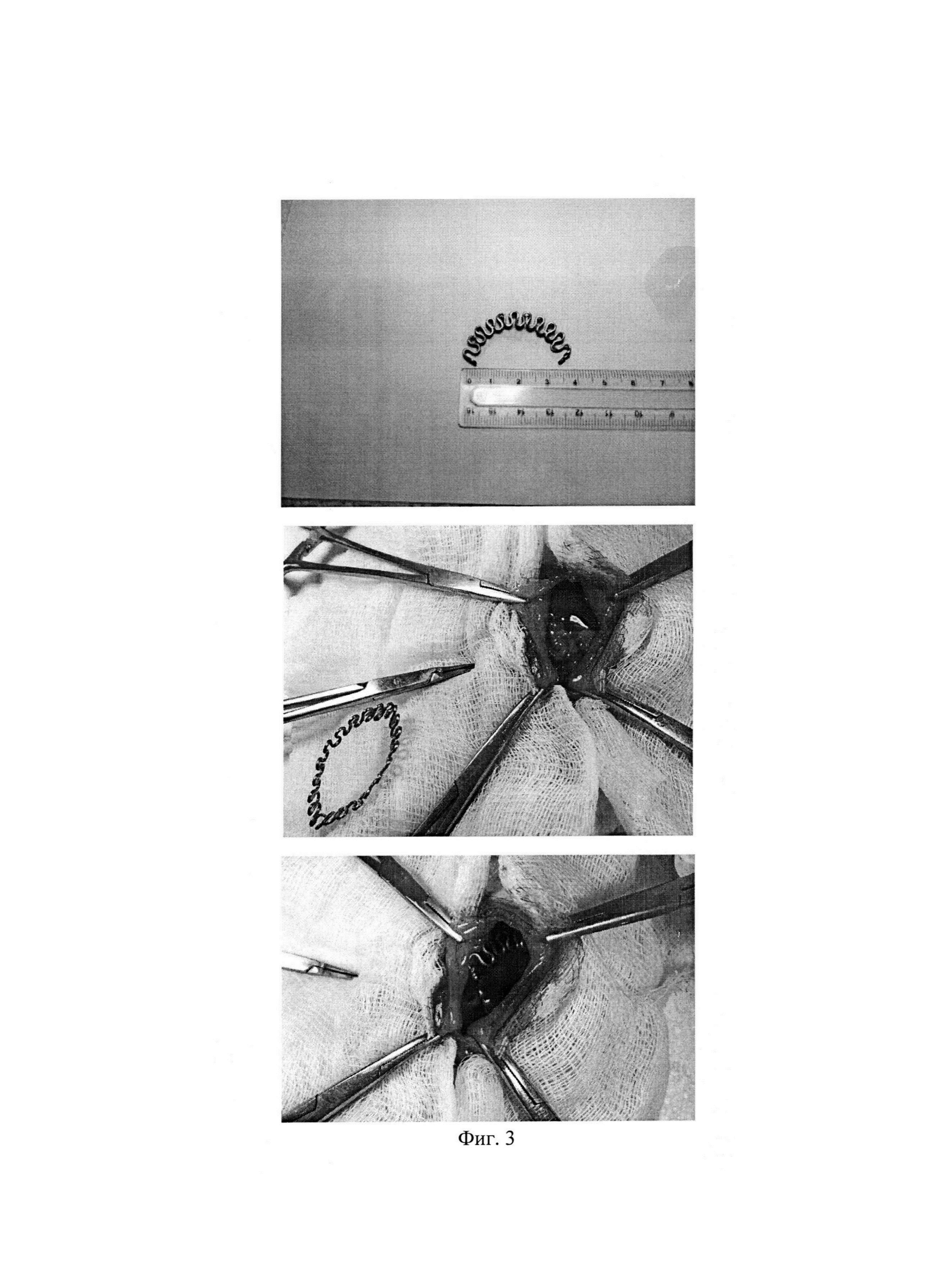
Фиг. 3. Наложение клипсы. Фрагмент операции.
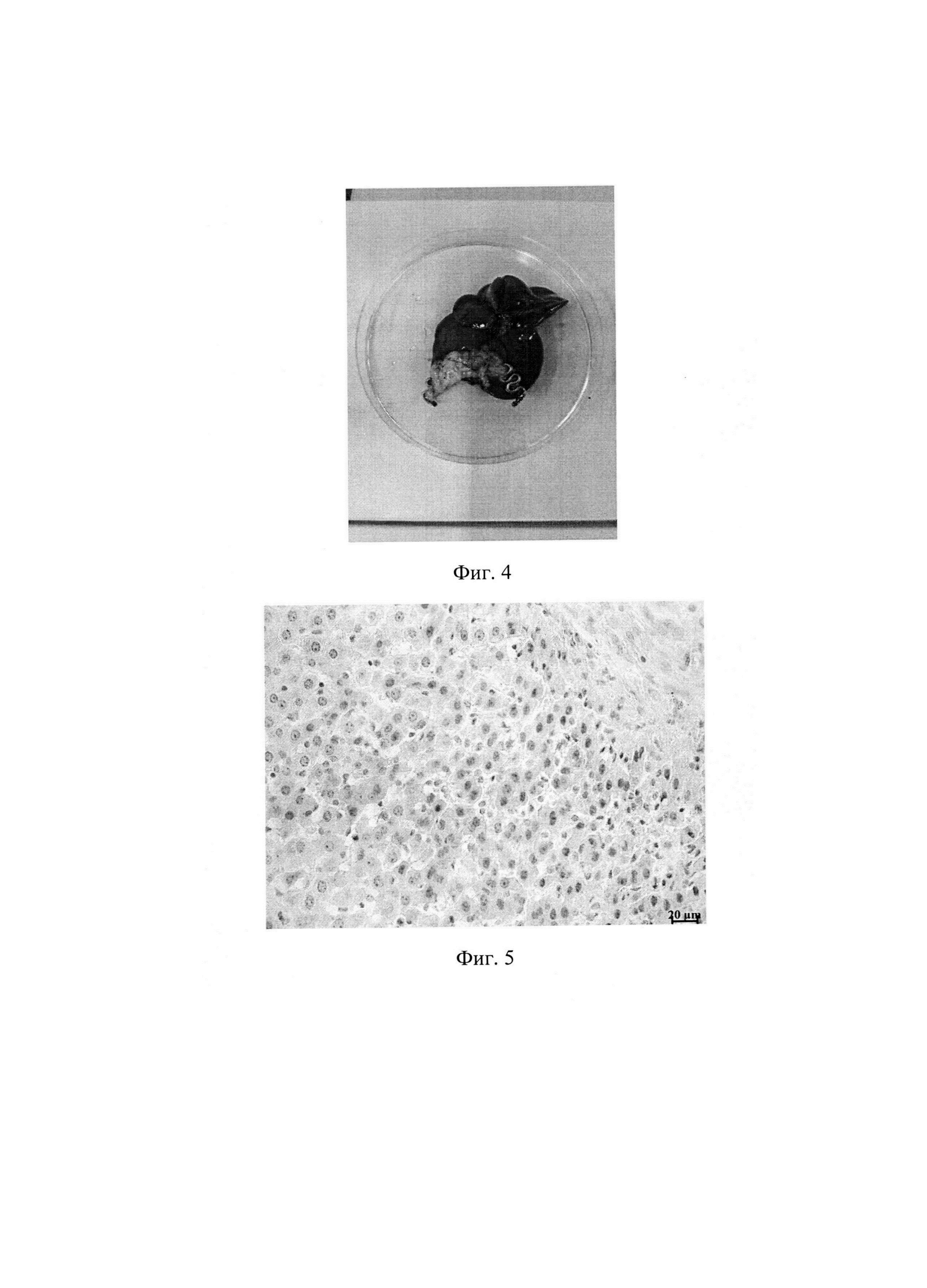
Фиг. 4. Вид печени с клипсой на 28 день после операции. Защемленный участок печени атрофирован.
Фиг. 5. Гистологический срез печени с признаками репаративной регенерации.
Проверка работоспособности, достижимости технического результата и апробация предлагаемого способа осуществлены экспериментально, путем моделирования болезни у лабораторных животных и лечения ее по методике способа. Конкретные данные и результаты эксперимента следующие:
Пример:
Лабораторные животные — крысы, самки линии Вистар, одинакового половозрелого возраста, для статистического анализа эксперимента сгруппированы в 3 партии по 5 особей в каждой. По спланированной методике эксперимента действия с животными дифференцированы по партиям следующим образом:
1. Для проверки работоспособности устройств, техники установки, атравматичности и динамики срабатывания первой партии животных установлены клипсы (Фиг. 1, 2, 3) на здоровую печень. После выведения животных из опыта, через 28 дней, установлено биоинертное состояние имплантатов и предполагаемое деформационное срабатывание. Габариты отдельной клипсы: длина 40 мм, амплитуда волн браншей 5 мм, количество волн 11, диаметр никелид-титановой проволоки марки ТН-10 — 0,8 мм.
2. В базисной партии животных смоделирован цирроз печени путем интрагастрального введения 40% масляного раствора тетрахлорметана в дозе 0,2 мл/100 г массы тела, два раза в неделю, в течение 12 недель. После установления факта развития цирроза печени животным наложены на маргинальные участки печени (Фиг. 2) клипсы идентичные первой партии конструкций и размерам. При наложении устройств использован термомеханический эффект памяти формы. Для этого при температуре около 0°С бранши клипсы из сомкнутого состояния раскрывались на угол 30-40 градусов и удерживались после наложения на краевом участке печени до их возвратной деформации и защемляющей фиксации в течение 1-2 мин. После операции, через 3, 7, 14, 21, 28 дней животные поочередно выведены из опыта для регистрации репаративной регенерации паренхимы и изучения ее динамики. Дистальные от клипсы отделы печени в динамике атрофировались (Фиг. 4), а основная масса печени имела признаки репаративной регенерации согласно данным морфологического исследования (Фиг. 5). Критериями регенерации явились такие признаки, как гипертрофия гепатоцитов, полиплоидизация гепатоцитов, удвоение и увеличение ядер гепатоцитов, уменьшение доли соединительной ткани в срезах. При этом наиболее выражен данный процесс у крыс, выведенных из эксперимента на 14-21 сутки. Данные морфологического исследования свидетельствуют о работоспособности способа.
3. У животных контрольной группы с моделированным циррозом печени ложно оперированные признаки регенерации были менее выражены.
Результаты эксперимента подтверждают феномен репаративной регенерации паренхимы при циррозах печени. Наглядный факт отсутствия в способе инвазивной деструкции печени доказывает достижимость технического и логически вытекающего -потребительского результата.
Положительные результаты эксперимента, согласующиеся с накопленным клиническим опытом сходных аналогов, дают основание считать предлагаемое решение, соответствующим критерию изобретения «промышленная применимость».
Способ лечения цирроза печени в эксперименте стимуляцией репаративной регенерации гепатоцитов путем физического воздействия на паренхиму ограниченного участка печени, отличающийся тем, что указанное воздействие осуществляют дистрофирующим защемлением на время репарации маргинального участка печени клипсой, выполненной в виде двух сомкнутых, дугообразных, замкнутых попарно концами, волнообразно изогнутых в плоскости смыкания браншей из никелид-титановой проволоки с эффектом памяти формы и сверхэластичности.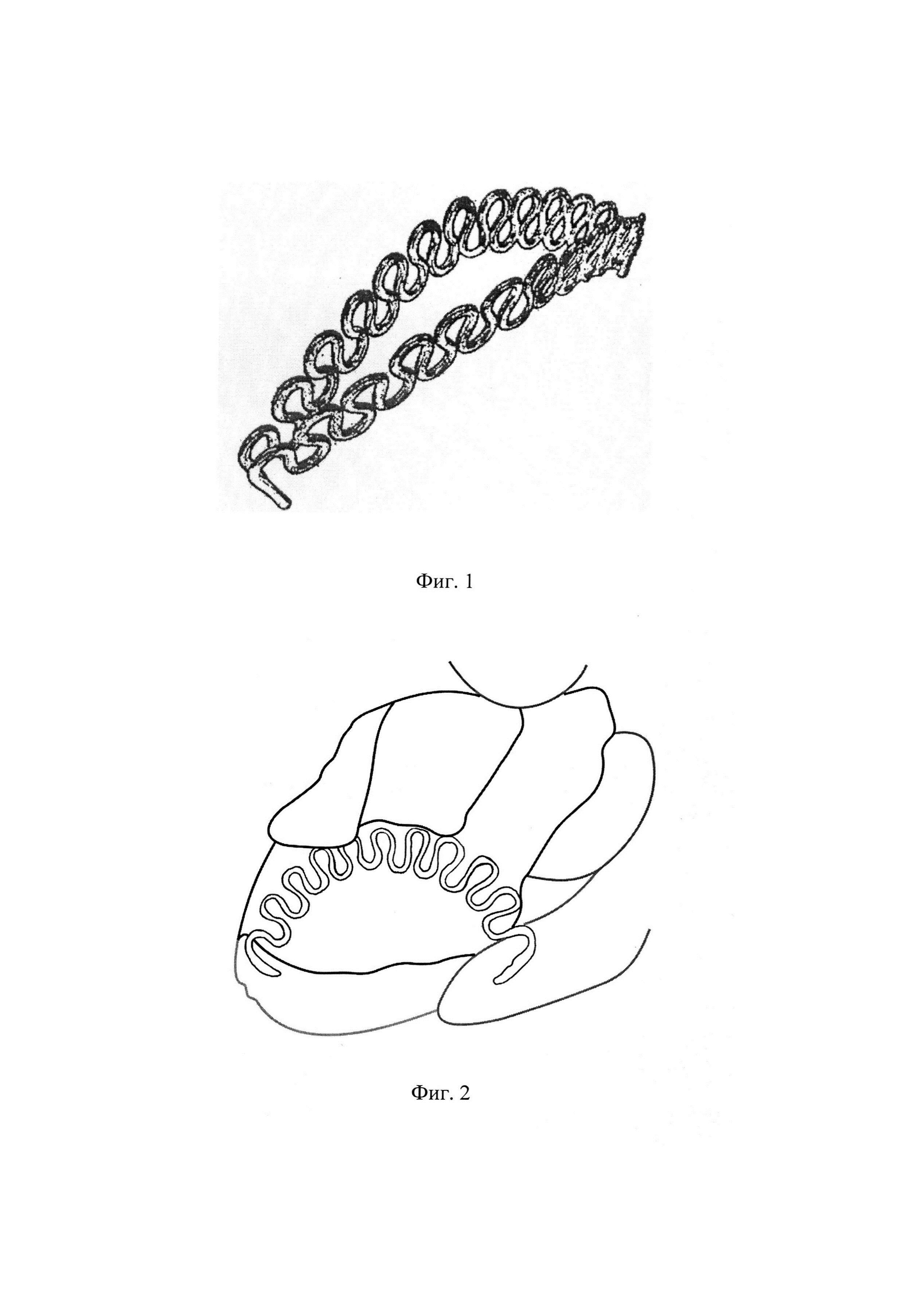
Источник

