Гемостаз при циррозе печени
Понятие о гемостазе
Термином гемостаз обозначается каскад реакций, обеспечивающих прекращение кровотечения в случаях повреждения тканей и стенки сосудов. В организме здорового человека Кровь способна выполнять свои многочисленные жизненно важные функции при условии сохранения жидкого состояния и непрерывной циркуляции. Жидкое состояние крови поддерживается в результате баланса систем свертывания, противосвертывания и фибринолиза. В норме клетки крови и эндотелий сосудистой стенки имеют отрицательный поверхностный заряд и между собой не взаимодействуют. Непрерывное движение крови препятствует факторам свертывания достигать критического повышения концентрации и образовывать кровяные сгустки в отдаленных от места повреждения участках сосудистой системы. Образовавшиеся в сосудистом русле микроагрегатов клеток крови и микросгустки разрушаются ферментами системы фибринолиза. Внутрисосудистому свертыванию крови так же препятствует эндотелий сосудов, который предотвращает активацию ХII фактора — (ффактора Хагемана) и агрегацию тромбоцитов. На поверхности эндотелия сосудистой стенки находится слой растворимого фибрина, который адсорбирует факторы свертывания.
Внутрисосудистому свертыванию крови препятствует эндотелий сосудов, который предотвращает активацию фактора Хагемана и агрегацию тромбоцитов. Эндотелий сосудистой стенки содержит слой растворимого фибрина, который адсорбирует факторы свертывания. Форменные элементы крови и эндотелий имеют поверхностные отрицательные заряды, что противостоит их взаимодействию. Активируют процесс свертывания крови эмоционально-болевой стресс, внутрисосудистое разрушение форменных элементов крови, разрушение эндотелия сосудов и более обширные повреждения кровеносных сосудов и тканей.
Изменения показателей свёртывания при циррозе
Печень играет первостепенную роль в синтезе большинства идентифицированных факторов коагуляции и многих ингибиторов активации каскада коагуляции. В печени синтезируется витамин К-зависимый комплекс факторов свертывания (II, VII, IX, X), лабильный фактор V, фактор VIII, контактные факторы XI и XII, фибриноген и фибринстабилизирующий фактор XIII. Период полураспада этих субстанций очень короткий, поэтому при остром некрозе гепатоцитов может очень быстро происходить снижение их уровня. При циррозе имеются множественные дефекты в системе гемостаза, конечным результатом paзвития которых является гипокоагуляция.
Таблица 2 Нарушения гемостаза у больных циррозом печени
Уменьшение синтеза факторов свертывания
Нарушение функции печени
Недостаточность/нарушение всасывания витамина К
Снижение синтеза ингибиторов свертывания
Образование аномальных/неполноценных белков
Повышение фибринолитической активности
Уменьшение синтеза нормальных ингибиторов фибринолиза
Синтез аномальных факторов свертывания, часть которых обладает антикоагулянтной активностью
Уменьшение выведения активаторов фибринолиза
Увеличение фибринолитической активности Диссеминированное внутрисосудистое свертывание
Многофакторное, в том числе эндотоксемия
Нарушение тромбоцитарного звена гемостаза
Тромбоцитопения
Нарушение функции тромбоцитов
У больных циррозом печени могут наблюдаться различные варианты нарушения гемостаза, они имеют важное клиническое значение, а их выраженность зависит от состояния компенсации заболевания. При циррозе имеется абсолютный дефицит прокоагулянтов, результатом чего является удлинение протромбинового времени. Вместе с тем, при компенсированном циррозе их уровень может быть нормальным или сниженным. Отмечается параллелизм между снижением функции печени и величиной протромбинового индекса — при умеренной и тяжелой печеночной недостаточности он составляет 50-70% от нормы. Особенно быстро уровень коагулянтов снижается при остром некрозе гепатоцитов. Поэтому протромбиновый индекс является чувствительным показателем функционального состояния печени. Протромбиновый индекс и содержание альбумина изменяются синхронно. Цирроз печени может сопровождаться образованием структурно и функционально неполноценных факторов свертывания, особенно это касается фибриногена. При циррозе наблюдается снижение ингибиторов коагуляции — антитромбина III, белков С и S, кофактора II гепатоцитов, уровень которых также коррелирует с функцией печени. Фибринолитическая активность также изменяется — параллельно с выраженностью геморрагических проявлений. Протромбиновое время отражает скорость превращения протромбина в тромбин, который необходим для полимеризации фибриногена в фибрин. Протромбиновое врем связано факторами I, II, V, VII, X, с уровнями фибриногена и протромбина. При их дефиците оно увеличивается.
Уровень факторов свертывания снижается также при дефиците витамина К. Наиболее частые причины дефицита — внепеченочный или внутрипеченочный холестаз, прием холестирамина, мальабсорбция, прием антибиотиков. Гепатоцеллюлярная недостаточность без вышеупомянутых причин не является причиной дефицита витамина К. Нарушение гемостатического баланса может не выявляться рутинными тестами. Наиболее чувствительный тест — исследование протромбинового времени до и после внутримышечного введения 10 мг витамина К.
Для синтеза факторов II, VII, IX, X печени требуется присутствие витамина К. Таким образом, увеличение протромбинового времени может наблюдаться при нарушении функции печени, дефиците витамина К, приеме антагонистов витамина К, врожденном дефиците факторов свертывания, повышенной их утилизации. Гиповитаминоз К и массивные паренхиматозные поражения печени можно дифференцировать, используя внутримышечное введение витамина К. Если протромбиновое время нормализуется или уменьшается на 30% через 1 сутки после одной внутримышечной инъекции витамина К, делается вывод, что синтетическая функция печени не нарушена, а увеличение протромбинового времени связано с гиповитаминозом К. Гиповитаминоз К может развиваться вторично при длительных обструктивных желтухах со стеатореей и дисбактериозе кишечника на фоне антибиотикотерапии. Напротив, отсутствие ответа на парентеральное введение витамина К больным с увеличенным протромбиновым временем свидетельствует о паренхиматозном поражений печени. Если гипоальбуминемия отражает хронизацию печеночной дисфункции, то увеличение протромбинового времени может служить маркером тяжести острой дисфункции печени. Например, при вирусном гепатите увеличение протромбинового времени на 5-6 с говорит о возможности молниеносного некроза печеночной ткани. Его выявление при острой дисфункции печени по протромбиновому времени возможно благодаря короткому периоду полураспада фактора VII.
Плазменные факторы свёртывания крови
Фибриноген. Глобулярный белок синтезируется в печени. Под влиянием тромбина превращается в фибрин. Агрегирует тромбоциты. Образует фибрилярную сеть кровяного сгустка. Стимулирует регенерацию тканей.
Протромбин. Гликопротеид. Под влиянием протромбиназы превращает в тромбин, обладающий протеолитической активностью по отношению фибриногена.
Тромбопластин. Состоит из белка апопротеина III и фосфолипидов. Входит в состав мембран клеток крови и тканей. Является матрицей, на которой протекают реакции образования протромбиназы.
Ионы Са2+. Участвует в образовании комплексов, которые входят в состав протромбиназы. Стимулируют ретракцию сгустка, агрегацию тромбоцитов, связывают гепарин, ингибируют фибринолиз.
Проакцелярин. Белок, необходим для образования тромбина. Связывает Ха-фактор с тромбином.
Исключен.
Проконвертин. Гликопротеид. Необходим для образования протромбиназы.
Антигемофильный глобулин А (АТГ) образует комплексную молекулу с фактором Виллебранта. При его отсутствии развивается гемофилия А.
FW. Образуется эндотелием сосудов, необходим для адгезии тромбоцитов и стабилизации VIII фактора.
Кристмас-фактор. Антигемофильный глобулин В. Гликопротеид. Активирует Х фактор. При его отсутствии развивается гемофилия В.
Х. фактор Стюарта-Прауэра. Гликопротеид. Ха является протромбиназой. Активируется факторами VIIа и IХа. Переводит протромбин в тромбин.
Плазменный предшественник тромбопластина. Гликопротеид. Активируется фактором XIIа, капликреином, высокомолекулярным кининогеном (ВМК).
Фактор Хагемана. Белок. Образуется эндотелием, лейкоцитами, макрофагами. Активируется при контакте с чужеродной поверхностью, адреналином, калликреином. Запускает процесс образования протромбиназы, активирует фибринолиз, активирует XI фактор.
Фибринстабилизирующий фактор (ФСФ), фибриназа. Синтезируется фибробластами, мегакариоцитами. Стабилизирует фибрин, активирует регенерацию.
Фактор Флетчера. Активирует XII фактор, плазминоген.
Фактор Фитцджеральда, высокомолекулярный кининоген. Образуется в тканях, активируется капликреином. Активирует факторы XII , XI, фибринолиз.
Источник
Дарниченко А.В.
Важное значение в развитии и прогрессировании патологии гемостаза и фибринолиза при циррозе печени придается этиологии заболевания. Вирусы гепатита и алкоголь могут являться факторами, определяющими разнонаправленность гемокоагуляционных расстройств. В тоже время имеющиеся в литературе данные об изменениях показателей свертывания крови и фибринолиза в зависимости от этиологии цирроза печени имеют противоречивый характер.
Серьезные нарушения показателей гемостаза и фибринолиза выявлены при циррозе печени различной этиологии, причем у больных вирусными и алкогольными циррозом печени по ряду признаков они носят разнонаправленный характер. При алкогольных циррозах печени наблюдались явления гиперкоагуляции: уровень ведущих факторов свертывания был достоверно выше нормы, а величина фибринолитической активности, полигалактуроназы, антитромбина-III приближались к норме. Концентрация составила в среднем 21,0±5,0 мкг/мл, что достоверно не отличалось от нормы. При вирусных циррозах печени наблюдались сдвиги, характерные для гипокоагуляционной фазы ДВС и коагулопатии потребления. Об этом свидетельствовало снижение уровня ведущих факторов свертывания, особенно ХШ-фактора, антитромбина Ш, повышение в крови концентрации продуктов деградации фибриногена до 67,2±11,8 мкг/мл против 18,6±3,2 мкг/мл в норме. При этом уровень фибринолитической активности заметно снижен, уровень полигалактуроназы снижен до 132,7±11,2 мкг/мл против 317,0±33,2 мкг/мл у доноров.
Наиболее наглядно отражает разнофазовость ДВС-синдрома у больных циррозом печени различной этиологии определение содержания в крови специфических маркеров ДВС-растворимые комплексы фибрин-мономера и продукты деградации фибриногена. Если при алкогольных циррозе печени в крови преимущественно обнаруживаются маркеры начальной, гиперкоагуляционной фазы ДВС-растворимые комплексы фибрин-мономера (75% случаев против 40% при вирусных цирроз печени), то у больных вирусными циррозами печени, напротив, значительно чаще был повышен уровень продукты деградации фибриногена, отражающих прогрессирование ДВС с развитием фазы гипокоагуляции (65% случаев против 19% при алкогольных циррозах печени).
Установленные особенности патологии гемостаза при вирусных и алкогольных циррозов печени во многом определяются меньшей выраженностью воспалительной активности и эндотоксикоза при алкогольных поражениях печени.
При сравнительном анализе результатов исследования показателей гемостаза и маркеров ДВС при циррозе печени различной этиологии в зависимости от степени активности было показано, что при алкогольных циррозах печени умеренной активности имелись незначительные нарушения гемостаза, а при высокой активности они были выражены в большей степени и приближались к изменениям у больных вирусными циррозами печени умеренной активности, имея преимущественно гиперкоагуляционный характер.
При вирусных циррозах печени высокой активности патология гемостаза и фибринолиза приобретала максимальную выраженность и у части больных соответствовала гипокоагуляционной фазе ДВС с развитием коагулопатии потребления, гиперфибринолиза, значительным нарастанием уровня продуктов деградации фибриногена.
У больных циррозом печени вирусной и алкогольной этиологии наблюдаются разнонаправленные изменения показателей гемостаза и фибринолиза, приобретавшие в значительной части случаев характер латентного ДВС-синдрома. При вирусных циррозах печени имеется тенденция к развитию гипокоагуляционных расстройств, а при алкогольных циррозах печени — гиперкоагуляционных. Глубина нарушений гемостаза и фибринолиза при вирусных и алкогольных циррозах печени связана с активностью воспалительного процесса в печени.
Информация для медицинских учреждений.
Источник
class=»tytuly-02-tytul-2-t2-«>21.1. Нарушения гемостаза при заболеваниях печени
ОПРЕДЕЛЕНИЕ, ЭТИОлогия и ПАТОГЕНЕЗ наверх
Прогрессирующая замещение печеночной паренхимы приводит к снижению концентрации в плазме всех факторов гемостаза за исключением: фибриногена (его концентрация снижается при запущенном билиарном циррозе), vWF (продуцируется в эндотелиальных клетках и мегакариоцитах), а также фактора VIII, концентрация которого может даже увеличится (также продуцируется в эндотелиальных клетках. Гиперспленизм может привести к тромбоцитопении. Приводит также к дисфибриногенемии и дисфункции тромбоцитов. При заболеваниях печени сосуществуют протромботические и геморрагические нарушения гемостаза. Способствуют увеличению риска тромбоза увеличенная активность vWF и фактора VIII, а также снижение активности ADAMTS‑13, антитромбина, белка C и белка S. Увеличение активности t-PA и PAI, а также уменьшении активности ингибиторов плазмина и плазминогена приводит к чрезмерному фибринолизу. Тенденция к кровотечениям, которая часто наблюдается у больных с декомпенсированным циррозом печени, также может возникать из-за сопутствующих механизмов: портальной гипертензии, дисфункции эндотелия, бактериальных инфекций, почечной недостаточности. Также наличие типичных факторов риска тромбоэмболических осложнений может усилить протромботические механизмы.
КЛИНИЧЕСКАЯ КАРТИНА И ЕСТЕСТВЕННОЕ ТЕЧЕНИЕнаверх
При острой печеночной недостаточности или токсическом повреждении печени обычно не наблюдают увеличения склонности к кровотечениям, за исключением молниеносного течения заболевания. При хронических заболеваниях печени появляются кровотечения из носа и десен, кровотечения из верхнего отдела ЖКТ (чаще всего из варикозно расширенных вен пищевода), экхимозы, обильные менструации, макрогематурия. Повышенный риск развития венозного тромбоза (напр., тромбоза портальной вены), также может развиваться артериальный тромбоз (инсульт, инфаркт миокарда).
ДИАГНОСТИКАнаверх
Постановка диагноза основана на изучении анамнеза и результатов лабораторных исследований. Одновременно наблюдается удлинение ПТВ, АЧТВ удлиненное или в пределах нормы, тромбоцитопения, часто увеличенная концентрация фибриногена, часто тромбоцитопения, удлиненное время окклюзии PFA, сниженная активность фактора V и фактора VII с нормальной или повышенной активностью фактора VIII, увеличенная активность vWF, нормальная или слегка повышенная концентрация D-димера, другие лабораторные особенности цирроза печени или острой печеночной недостаточности. Обычно у данных пациентов результаты рутинных исследований системы гемостаза не указывают на склонность к развитию тромбоза.
Дифференциальная диагностика
Кровотечения в течении:
1) ДВС-синдрома — дополнительно дефицит фибриногена и увеличенная концентрация продуктов деградации фибриногена и фибрина (FDP и D-димер) в плазме;
2) дефицита витамина К — сниженная активность факторов VII, IX, X при концентрации факторов V и VIII в пределах нормы.
Лечение
Лечение начинайте в случае активного кровотечения. Наиболее частое кровотечение при циррозе печени (из варикозных вен пищевода) в основном происходит из-за нарушений коагуляции. Поскольку нарушения гемостаза имеют комплексный характер, терапию данных нарушений не начинают у больных без склонности к чрезмерным кровотечениям. Исключением является подготовка к инвазивной процедуре — число тромбоцитов должно составлять ≥50 000–60 000/мкл, с другой стороны трудно указать минимальные «безопасные» параметры ПТВ и концентрации фибриногена, при которых гарантированно не развиваются геморрагические осложнения.
Применяют:
1) трансфузии СЗП (10–15 мл/кг массы тела каждые 12–24 ч) и ТМ;
2) криопреципитат 1–2 ЕД/10 кг массы тела или концентрат фибриногена 1–2 г — если концентрация фибриногена составляет <1,0 г/л или дисфибриногенемия;
3) витамин K (фитоменадион) 10 мг в/в — у больных с подозрением на его дефицит (напр. при холестазе);
4) PCC или (очень редко) рекомбинованный фактор VIIa (рVIIa) — в случае массивных кровотечений; увеличивают риск развития тромбоза у больных с тяжелым повреждением печени
5) антитромботическая терапия, в том числе профилактическая, согласно общепринятым правилам →разд. 2.34, учитывая риск кровотечения из варикозно-расширенных вен пищевода.
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Левитан Б.Н.
1
Ларина Н.Н.
1
Иванников В.В.
1
1 ГБОУ ВПО «Астраханская государственная медицинская академия Минздрава России»
В данной статье представлены результаты исследования антител к кардиолипину и ряда ведущих показателей системы плазменного гемостаза и фибринолиза у 31 больного хроническим гепатитом и 41 – циррозом печени. Установлено, что концентрация антител к кардиолипину при хронических гепатитах в 58 % случаев была в норме или умеренно повышена, а при циррозах печени, напротив, в 61,1 % случаев наблюдалось высокое содержание антител. Наиболее высокие средние значения антител к кардиолипину имелись у больных вирусными хроническими гепатитами и циррозами печени, а наименьшие – алкогольными. У больных циррозом печени с высокими значениями антител к кардиолипину часто выявлялись признаки гипокоагуляции, гиперфибринолиза и маркеры гипокоагуляционной фазы синдрома диссеминированного свертывания крови.
хронический гепатит
цирроз печени
антитела к кардиолипину
гемостаз
фибринолиз
диссеминированное внутрисосудистое свертывание крови
1. Насонов Е.Л. Антифосфолипидный синдром. – М.:Литерра, 2004. – 440 с.
2. Решетняк Т.М., Середавкина Н.В., Насонов Е.Л. Кардиоваскулярные аспекты антифосфолипидного синдрома // Клин. медицина. – 2008. – № 9. – С. 4–12.
3. Ягода А.В., Корой П.В. Патология печени и функция тромбоцитов (клинико-патогенетический анализ). – Ставрополь: СтГМА, 2008. – 273 с.
4. Aldawood A., Arabi Y., Aljumah A. et al. The incidence of venous thromboembolism and practice of deep venous thrombosis prophylaxis in hospitalized cirrhotic patients // Thrombosis J. – 2011. – Vol. 9. – № 1. – Р. 1–10.
5. Andre P., Nannizzi-Alaimo L., Prasad S.K. Platelet-derived CD40L. The switch-hitting player of cardiovascular disease // Circulation. – 2002. – Vol. 106. – Р. 896–899.
6. Bick R.L., Baker W.F. Antiphospholipid syndrome and thrombosis //Semin. Thromb. Hemost. – 1999. – Vol. 25. – № 3. – Р. 333–50.
7. Branger S., Schleinitz N., Veit V. Auto-immune hepatitis and antiphospholipids // Rev. Med. Interne. – 2007. – Vol. 28. – № 4. – Р. 218–24.
8. De Groot P.G., Derksen R.H. Pathophysiology of the antiphospholipid syndrome // J. Thromb. Hemost. – 2005. – Vol. 5. – Р. 1854–60.
9. Deep Vein Thrombosis and Pulmonary Embolism / Edited by E.J.R. van Beek, H.R. Buller, M. Oudkerk. 2009: John Wiley & Sons, Ltd., 562 p.
10. Giannakopoulos B., Passam F., Ioannou Y. How we diagnose the antiphospholipid syndrome // Blood. – 2009. – Vol. 113. – № 5. – Р. 985–94.
11. Mangia A., Margaglione M., Cascavilla I. Anticardiolipin antibodies in patients with liver disease // Am. J. Gastroenterol. – 1999. – Vol. 94. – № 10. – Р. 2983–7.
12. Miyakis S., Lockshin M.D., Atmusi T. et al. International consensus statement on an update of classification criteria for definite antiphospholipid syndrome (APS) // J. Thromb. Hemost. – 2006. – Vol. 4. – Р. 295–306.
13. Zachou K., Liaskos Ch., Rigopoulou E. Presence of high avidity anticardiolipin antibodies in patients with autoimmune cholestatic liver diseases // Clin. Immune. Orlando Fla. – 2006. – Vol. 119. – № 2. – Р. 203–212.
В настоящее время важное значение в патогенезе тромбофилий придается антифосфолипидному синдрому (АФС), который характеризуется рецидивирующими венозными и артериальными тромбозами, тромбоцитопенией и гиперпродукцией антифосфолипидных антител (АФЛ) [1, 6, 8, 9].
АФЛ – гетерогенная группа аутоантител, распознающих антигенные детерминанты анионных и нейтральных фосфолипидов и комплексные эпитопы, образующиеся в процессе взаимодействия фосфолипидов и фосфолипидсвязывающих белков плазмы крови [1, 6, 10]. АФЛ являются патогенетическим медиатором тромбозов в связи с их способностью повреждать эндотелиальный барьер, подавлять функциональную активность факторов свертывания, эндогенный фибринолиз, активировать тромбоцитарное звено гемостаза [1, 8, 12].
Одним из ведущих диагностических маркеров АФС являются антитела к кардиолипину (АКЛ) – фосфолипидам клеточных мембран. Определенный уровень АКЛ присутствует в крови здоровых людей, но при его повышении происходит активация тромбоцитов и эндотелия сосудов, что способствует возникновению тромбозов и тромбоэмболий. Повышение уровня АКЛ является фактором риска первого венозного тромбоза, а также повторных тромбоэмболий в популяции [1, 2, 8, 9]. Согласно международным критериям классификации АФС (Сидней, Австралия, 2006), определение АКЛ относят к обязательным методам лабораторной диагностики АФС [12].
В литературе имеются отдельные немногочисленные данные об изменениях содержания АКЛ в крови при хронических гепатитах и циррозах печени, однако они носят противоречивый характер [4, 7, 11, 13]. Практически не изучена связь антител с показателями плазменного гемостаза, фибринолиза, маркерами синдрома диссеминированного свертывания (ДВС), что указывает на необходимость дальнейших исследований в данном направлении.
Цель исследования – изучить концентрацию антител к кардиолипину у больных хроническим гепатитом и циррозом печени и установить их связь с изменениями плазменного гемостаза и фибринолиза.
Материалы и методы исследования
Проведено комплексное клинико-инструментальное и лабораторное обследование 31 больного хроническим гепатитом (ХГ) и 41 – циррозом печени (ЦП), проходивших лечение в гастроэнтерологическом отделении ГБУЗ АО «Александро-Мариинская областная клиническая больница». Группу контроля (ГК) составили 25 практически здоровых доноров.
Больные обследованы в стационаре в стадии обострения их основного заболевания. Диагностика ХГ и ЦП осуществлялась на основании комплекса клинико-лабораторных и инструментальных показателей в соответствии с существующими стандартами.
Определение концентрации АКЛ в плазме крови проводилось методом иммуноферментного анализа с использованием коммерческой тест-системы производства компании Orgentec (Германия). При оценке результатов исследования АКЛ в соответствии с международными рекомендациями выделялись нормальный (M ± 2 SD), умеренно повышенный (от M ± 2 SD до M ± 5 SD) и высокий (> M ± 5 SD) уровни АКЛ, где M-средняя концентрация АКЛ у здоровых лиц, а SD – стандартное отклонение [169].
Cогласно полученным данным нормальный уровень АКЛ составил от 6,0 до 16,8 МЕ/мл; умеренно повышенный – от 16,9 до 24,9 МЕ/мл; высокий – от 25,0 МЕ/мл и выше.
Всем больным проводилось исследование ведущих показателей системы гемостаза и фибринолиза, а также маркеров синдрома внутрисосудистого свертывания крови.
Результаты исследования и их обсуждение
Средний уровень АКЛ у здоровых лиц составил 11,4 ± 0,5 МЕ/мл. Значения АКЛ в группе больных ЦП были достоверно (р < 0,05) выше, чем при ХГ (соответственно 41,5 ± 4,6 МЕ/мл и 28,9 ± 3,8 МЕ/мл). Разброс значений АКЛ при ХГ составлял от 6,6 МЕ/мл до 91,1 МЕ/мл, при ЦП – от 6,6 МЕ/мл до 157,2 МЕ/мл, что указывает на гетерогенность выборки.
На рис. 1 представлено распределение больных ХГ и ЦП в зависимости от уровня у них АКЛ: нормального, умеренно повышенного или высокого. Нормальная концентрация АКЛ в группе больных ХГ наблюдалась в 35,4 % случаев, умеренное повышение – в 22,6 % случаев, а значительное повышение – в 42,0 %. В группе больных ЦП соответственно 21,9 % случаев, 17,0 и 61,1 %. Следовательно если при ХГ содержание АКЛ более, чем у половины больных было в норме или повышено умеренно, то при ЦП количество больных с высоким уровнем антител превысило 60 %.
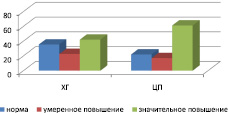
Рис. 1. Распределение больных хроническим гепатитом и циррозом печени (% случаев) в зависимости от концентрации АКЛ
Концентрация АКЛ в крови зависела от этиологии ХГ и ЦП. У больных ХГ вирусной этиологии средние значения АКЛ составили 40,8 ± 5,3 МЕ/мл, алкогольной этиологии – 15,4 ± 2,4 МЕ/мл, смешанной (вирус + алкоголь) этиологии – 22,3 ± 3,7 МЕ/мл. При вирусных ЦП средние значения АКЛ составили 45,5 ± 5,9 МЕ/мл, при алкогольных – 17,7 ± 3,4 МЕ/мл, при смешанных (вирус + алкоголь) – 31,4 ± 7,4 МЕ/мл. Следовательно, наиболее высокие средние значения АКЛ имелись в подгруппах больных ХГ и ЦП вирусной этиологии, а наименьшие – алкогольной. У пациентов смешанными ХГ и ЦП средний уровень антител приближался к значениям у лиц с вирусной этиологией заболевания.
Результаты исследования концентрации АКЛ при ЦП в зависимости от класса тяжести по Child-Pugh показало, что у больных компенсированным ЦП класса А (n = 12) уровень АКЛ составил в среднем 17,0 ± 2,5 МЕ/мл. По мере прогрессирования заболевания наблюдалось существенное нарастание концентрации антител и при субкомпенсированном ЦП класса В (n = 17) их содержание составило в среднем 44,5 ± 7,3 МЕ/мл, а при декомпенсированном ЦП класса С (n = 12) – 43,4 ± 11,6 МЕ/мл.
При этом, как следует из рис. 2, нормальный уровень АКЛ имелся у 66,6 % больных ЦП класса «А», 17,6 % класса «В» и 25,0 % класса «С». Умеренное повышение АКЛ наблюдалось у 16,7 % больных ЦП класса «А», 11,8 % класса «В» и 8,3 % класса «С». Значительное повышение АКЛ выявлено у 16,7 % больных ЦП класса «А», 70,6 % класса «В» и 66,7 % класса «С». Следовательно, у пациентов с компенсированным ЦП класса «А» повышение концентрации» АКЛ наблюдается редко в отличие от больных ЦП класса «В» и «С», у которых в большинстве случаев имелось значительное нарастание количества антител в крови, причем различия между данными подгруппами практически отсутствовали.
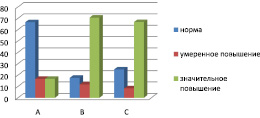
Рис. 2. Распределение больных циррозом печени класса «А», «В» и «С» по Child-Pugh (% случаев) в зависимости от концентрации АКЛ
Достоверных корреляционных связей между величиной АКЛ в крови и показателями исследованных факторов плазменного гемостаза, фибринолиза и маркеров ДВС – синдрома при ХГ и ЦП выявлено не было. В связи с этим были проанализированы средние значения ряда ведущих показателей гемостаза и фибринолиза в группах больных ХГ и ЦП в зависимости от величины АКЛ. Обследованные пациенты с ХГ и ЦП соответственно были разделены на две подгруппы: 1 подгруппа – с нормальным и умеренным повышением уровня АКЛ, 2 подгруппа – с значительным повышением уровня АКЛ. Результаты исследования представлены в таблице.
Величина АКЛ и изменения показателей гемостаза и фибринолиза при хронических гепатитах и циррозах печени
Показатель | Норма и умеренное повышение АКЛ | Значительное повышение АКЛ | ||
ХГ (n = 18) | ЦП (n = 16) | ХГ (n = 13) | ЦП (n = 25) | |
Фибриноген (г/л) | 2,9 ± 0,1 | 2,3 ± 0,1 | 2,5 ± 0,2** | 1,7 ± 0,1* |
XIII фактор (с) | 68,5 ± 2,4 | 65,9 ± 3,0 | 65,7 ± 2,9 | 57,1 ± 2,6* |
Протромбиновый индекс (%) | 87,3 ± 2,1 | 82,9 ± 2,2 | 84,2 ± 2,3 | 75,3 ± 2,4 |
Фибринолитическая активность (мин) | 224,3 ± 6,8 | 224,2 ± 8,1 | 218,1 ± 7,2 | 181,3 ± 6,4* |
Фибронектин (мкг/мл) | 264,1 ± 16,9 | 237,4 ± 12,1 | 224,4 ± 16,3 | 198,1 ± 11,7* |
Фибрин-мономер (% случаев) | 41,6 | 56,2 | 46,3 | 32,0 |
ПДФ (мкг/мл) | 22,3 ± 3,1 | 24,3 ± 3,2 | 31,4 ± 4,2 | 54,8 ± 5,1* |
Примечания: *р < 0,05 между подгруппами ЦП; ** р < 0,05 между подгруппами ХГ.
Как следует из таблицы, при ХГ практически отсутствовали достоверные различия показателей гемостаза и фибринолиза, включая маркеры ДВС-синдрома, в зависимости от степени повышения концентрации АКЛ. При ЦП, напротив, у больных из первой и второй подгрупп имелись достоверные (р < 0,05) различия практически по всем исследованным параметрам, за исключением протромбинового индекса. В подгруппе больных ЦП со значительным повышением концентрации АКЛ наблюдалось достоверное снижение значений фибриногена, ХIII фактора свертывания, фибронектина, повышение фибринолитической активности, уровня продуктов деградации фибриногена-фибрина (ПДФ). Циркулирующие фибрин-мономеры (ФМ) у них встречались значительно реже, чем в 1 подгруппе. Следовательно, при ЦП, несмотря на высокие значения АКЛ, наблюдаются сдвиги показателей в сторону гипокоагуляции, гиперфибринолиза и развития признаков ДВС в фазе гипокоагуляции.
По нашему мнению, это не противоречит устоявшимся представлениям, что гиперпродукция антифосфолипидных антител способствует усилению гиперкоагуляции, рецидивированию микротромбозов. В современной литературе имеются данные, что влияние АКЛ распространяется, прежде всего, на тромбоцитарные факторы гемостаза и в меньшей степени на плазменные. Так, согласно современным представлениям ключевым звеном тромбообразования при антифосфолипидном синдроме является СD40 лиганд, биологически активная (растворимая) форма которого, циркулирующая в крови, более чем на 95 % высвобождается из активированных тромбоцитов [5]. Нами же состояние тромбоцитарного гемостаза при ХГ и ЦП не изучалось, хотя в литературе имеются данные о снижении количественных и функциональных показателей тромбоцитов при хронических диффузных заболеваниях печени [3]. По-видимому, повышение АКЛ у больных ХГ и особенно ЦП является одним из пусковых механизмов ДВС-синдрома, но не приводит к существенному росту тромбозов. Так, ни у одного из 72 обследованных нами больных ХГ и ЦП достоверных клинических признаков развития венозных и артериальных тромбозов обнаружено не было.
Выводы
1. Концентрация антител к кардиолипину при ХГ в 58 % случаев была в норме или умеренно повышена, а при ЦП, напротив, в 61,1 % случаев наблюдалось высокое содержание антител.
2. Несмотря на отсутствие корреляционных связей между концентрацией АКЛ и ведущими показателями системы гемостаза при ХГ и ЦП, у больных циррозом с высокими значениями АКЛ часто выявлялись признаки гипокоагуляции, гиперфибринолиза и маркеры гипокоагуляционной фазы ДВС-синдрома.
Рецензенты:
Орлов М.А., д.м.н., профессор, зав. кафедрой медицинской реабилитации, ГБОУ ВПО «Астраханская государственная медицинская академия», г. Астрахань;
Умерова А.Р., д.м.н., доцент, зав. кафедрой клинической фармакологии, ГБОУ ВПО «Астраханская государственная медицинская академия», г. Астрахань.
Работа поступила в редакцию 25.12.2013.
Библиографическая ссылка
Левитан Б.Н., Ларина Н.Н., Иванников В.В. АНТИТЕЛА К КАРДИОЛИПИНУ И СОСТОЯНИЕ ПЛАЗМЕННОГО ГЕМОСТАЗА ПРИ ХРОНИЧЕСКИХ ГЕПАТИТАХ И ЦИРРОЗАХ ПЕЧЕНИ // Фундаментальные исследования. – 2013. – № 12-2. – С. 239-242;
URL: https://fundamental-research.ru/ru/article/view?id=33313 (дата обращения: 29.04.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник


