Гепатит и в12 дефицитная анемия
Кандидат медицинских
наук, доцент В.А. Ткачев
В12-ДЕФИЦИТНАЯ
АНЕМИЯ
В12-дефицитная
анемия –
это тяжелая прогрессирующая анемия,
возникающая при нарушении усвоения
витамина В12,
поступающего с пищей, вследствие
пониженной (или при отсутствии) секреции
внутреннего желудочного фактора.
Номенклатура
названия этого заболевания разная, и
оно нередко обозначается в литературе
как пернициозная анемия (perniciosa
– гибельная), злокачественная болезнь
Аддисона–Бирмера (по фамилии авторов),
а также мегалобластная анемия (по типу
кроветворения).
Болеют лица старше
40 лет. Женщины подвержены этому заболеванию
в два раза чаще, чем мужчины и, прежде
всего, в возрасте старше 50–60 лет. Известны
случаи В12-дефицитной
анемии у детей, вскармливаемых козьим
молоком или сухими молочными смесями.
Заболеваемость составляет от 20 до 60
случаев на 10 000 населения.
Историческая
справка.
Первое описание этого заболевания
сделал Кумбс в 1822 г. и назвал его тяжелым
первичным малокровием. В 1855 г. врач
Аддисон описал это страдание под
названием «идиопатическая анемия». В
1872 г. Бирмер опубликовал результаты
наблюдения за группой больных, страдавших
прогрессирующей пернициозной анемией.
Однако возможность излечения этого
заболевания появилась только в 1926 г.,
когда Майнот и Мерфи обнаружили выраженный
лечебный эффект от назначения сырой
печени.
Через три года
американский физиолог Кастл показал,
что сырое мясо, печень, дрожжи, обработанные
желудочным соком здорового человека,
обладают свойством вызывать ремиссию
у больного пернициозной анемией.
Исследования Кастла легли в основу
концепции, согласно которой в результате
взаимодействия двух факторов – внешнего,
содержащегося в сыром мясе, сырой печени,
дрожжах, и внутреннего, вырабатываемого
слизистой оболочкой желудка, создается
антианемическое соединение, которое
обеспечивает физиологическое вызревание
костномозговых клеток.
Природа внешнего
фактора была установлена – им является
цианкобаламин
(витамин В12).
Витамин В12
по потребности организма используется
не только для гемопоэза в костном мозге,
но и для нормального функционирования
нервной ткани и органов пищеварения.
Комплексное
соединение, состоящее из пептидов
(появляющихся в процессе превращения
пепсиногена в пепсин) и мукоидов
(выделяемых добавочными клетками
слизистой оболочки желудка) было названо
гастромукопротеидом
или внутренним фактором Кастла.
Роль внутреннего фактора (гастромукопротеида)
заключается в образовании с витамином
В12
комплекса, обеспечивающего транспорт
цианкобаламина по кишечнику и
препятствующего его распаду и инактивации.
Резорбция (всасывание) витамина В12
происходит в подвздошной кишке. Дальнейшее
поступление его в портальный кровоток
осуществляется при помощи белковых
переносчиков: транскобаламина-1
(-глобулина)
и транскобаламина-2 (-глобулина),
которые образуют белково-В12-витаминный
комплекс, способный депонироваться в
печени.
Этиология.
Ведущим фактором в этиологии заболевания
является эндогеннная
недостаточность витамина В12,
возникающая вследствие нарушения его
всасывания из-за прекращения секреции
внутреннего фактора (гастромукопротеида).
Нарушение всасывания
В12
может возникнуть в результате поражения
желудочно-кишечного тракта воспалительным
или злокачественным процессом, после
субтотального
или тотального удаления желудка,
после обширной
резекции части тонкого кишечника.
В редких случаях пернициозная анемия
развивается при нормальной секреции
внутреннего желудочного фактора и
обусловлена врожденным
отсутствием транскобаламина-2,
с которым витамин В12
связывается и доставляется в печень,
либо в результате отсутствия
в кишечнике белкового акцептора
(воспринимающего) витамина В12,
необходимого для поступления цианкобаламина
из кишечника в кровеносное русло. В
отдельных случаях имеет место генетический
фактор развития
В12-дефицитной
анемии вследствие врожденного нарушения
выработки желудочного фактора или
наличия антител против париетальных
клеток.
К возникновению
В12-дефицитной
анемии могут привести и следующие
факторы:
нарушение всасывания
В12
в тонком кишечнике в результате
хронического
энтерита или глютеновой энтеропатии;конкурентное
поглощение витамина В12
в тонком кишечнике широким
лентецом
или микроорганизмами;полное исключение
пищи животного происхождения;длительное снижение
внешнесекреторной активности
поджелудочной железы,
следствием чего является нарушение
расщепления протеина R,
без которого витамин В12
не может связаться с мукополисахаридом;длительное
назначение некоторых
лекарственных препаратов:
метотрексат, сульфасалазин, триамтерен,
6-меркаптопурин, азатиоприн, ацикловир,
фторурацил, цитозар, фенобарбитал и
др.
Патогенез.
Нарушение
кроветворения при В12-дефицитной
анемии характеризуется мегалобластическим
типом для
всех трех ростков крови: эритроидного,
гранулоцитарного и мегакариоцитарного.
Отмечается неэффективность красного
кроветворения: нарушение дифференцировки
эритроидных клеток и появление аномальных
клеток типа промегалобластов, мегалобластов
(большого размера клеток с базофильной
цитоплазмой и ядром, содержащим ядрышки).
В результате
дефектного метаболизма фолиевой кислоты
(из-за дефицита В12),
которая участвует в образовании ДНК,
нарушается клеточное деление. Следствием
этого является выраженная интрамедуллярная
гибель эритроидных элементов и снижение
количества эритроцитов на периферии.
Из-за несостоятельности
клеточных элементов крови усилен
гемолиз,
который проявляется гипербилирубинемией,
уробилинурией, увеличением стеркобилина
в кале.
Патологоанатомические
изменения
характеризуются общим малокровием,
желтушностью кожи и слизистых, жировой
дистрофией миокарда, печени, почек.
Костный мозг сочный, малинового цвета
из-за гиперплазии.
Со стороны органов
пищеварения выявляются атрофические
изменения сосочков языка (их сглаженность),
воспалительные его изменения (глоссит),
афтозные высыпания, трещины (Гунтеровский
глоссит), а также атрофия слизистой
оболочки щек, неба, глотки, пищевода.
Наибольшая атрофия регистрируется в
желудке, которая характеризуется
истончением его стенок, формированием
полипов. Слизистая оболочка кишечника
также атрофирована. Селезенка, как
правило, нормальных размеров или
увеличена.
Гепатомегалия
невыраженная. Выявляется гемосидероз
в печени, селезенке, почках (ржавый
оттенок на разрезе) в результате гемолиза
эритроцитов.
В нервных волокнах
языка (нервных сплетениях Мейснера и
Ауэрбаха), а также в задних столбах
спинного мозга (очаговое набухание с
распадом миелиновых нервных волокон)
отмечаются дистрофические изменения.
Клинические
проявления
В12-дефицитной
анемии чаще развиваются постепенно:
нарастает слабость, недомогание,
головокружение, диспепсические
расстройства, шум в ушах, склонность к
ожирению. Редко заболевание начинается
остро, с подъема температуры тела до
38
С, выраженной слабости.
Анемический
синдром
характеризуется вялостью, бледностью
кожных покровов с лимонно-желтым
оттенком, иногда (у 12% больных)
субиктеричностью склер. В периферической
крови регистрируется анемия, чаще (58%)
тяжелая, с увеличением цветного показателя
до 1,4, снижением ретикулоцитов до 0,5 –
1,0% (у трети больных – ретикулоцитоз),
пойкилоцитозом и наличием телец Жолли
и колец Кэбота в эритроцитах. Часто
выявляется лейкопения, лимфоцитоз, но
тромбоцитопения.
В костном мозге
определяются признаки мегалобластического
типа кроветворения.
Синдром желудочной
диспепсии
(37,% наблюдений) проявляется отрыжкой,
тошнотой, потерей вкусовых ощущений,
снижением аппетита вплоть до отвращения
к пище, тяжестью в эпигастрии, иногда
дисфагией, чувством жжения языка,
слизистой оболочки рта. На ЭГДС выявляются
атрофические изменения в слизистой
оболочки пищевода и желудка.
Синдром кишечной
диспепсии характеризуется
неустойчивым стулом, похуданием.
Глоссит
проявляется наличием «ошпаренного»
(красного) или «лакированного» с трещинами
языка. Боли в языке отмечаются у 30%
больных с В12-дефицитной
анемией.
Синдром желтухи
бывает у 50% больных и проявляется
субиктеричностью склер и гипербилирубинемией.
Синдром
фуникулярного миелоза (сенсорная
атаксия – нарушение координации
движений) отмечается у больных с
В12-дефицитной
анемией в 11% случаев и развивается в
результате нарушения проприорецептивной
чувствительности из-за атрофических
процессов в задних рогах спинного мозга.
Могут быть и другие симптомы поражения
нервной системы: парестезии, расстройства
функции тазовых органов, снижение
рефлексов.
Синдром межреберной
невралгии
встречается существенно чаще (до 30%
случаев), чем признаки фуникулярного
миелоза, проявляется невралгическими
болями по ходу межреберий и также
обусловлен функциональной недостаточностью
нервной ткани проводников.
У части больных
отмечается поражение черепномозговых
нервов (зрительного, слухового,
обонятельного), наличие симптомов
спинального паралича (спастический
парапарез с повышенными рефлексами и
клонусами) Может обнаруживаться
центральная скотома (дефект поля зрения)
с потерей зрения.
Изменения со
стороны центральной
нервной системы
могут проявляться синдромом
психомоторного возбуждения
(маниакальное состояние с эйфорией или
синдромом депрессии
с нарушением памяти и критики —
мегалобластное слабоумие).
Кардиальный
синдром (в
15–20% наблюдений) характеризуется
одышкой, сердцебиением, болями в области
сердца, миокардиодистрофией. При
аускультации сердца выслушивается
функциональный анемический шум. На ЭКГ
определяется снижение ST,
расширение желудочкового комплекса.
Отечный синдром
встречается при В12-дефицитной
анемии в 80% случаев и проявляется
периферическими отеками, могущими
достигать степени анасарки, как результат
недостаточности кровообращения.
Увеличение печени
(синдром
гепатомегалии)
встречается у 22% больных, увеличение
селезенки (синдром
спленомегалии)
в 10% случаях.
При нелеченной
В12-дефицитной
анемии может развиться синдром
пернициозной комы,
проявляющийся ишемией головного мозга,
потерей сознания, арефлексией, падением
температуры тела, снижением АД, рвотой,
непроизвольным мочеиспусканием.
С целью диагностики
заболеванияпроводится
тщательное гематологическое исследование,
включающее изучение картины
периферической крови,
стернального
пунктата и
сывороточных факторов, участвующих в
гемопоэзе. Точный
диагноз очень важен, т.к. эти больные в
ряде случаев нуждаются в пожизненном
лечении.
Гиперсегментация
нейтрофилов
(более пяти ядерных долей) периферической
крови является первой гематологической
патологией при мегалобластном статусе.
У здорового человека могут циркулировать
в крови до 2% гиперсегментированных
нейтрофилов. У больных мегалобластной
анемией количество гиперсегментированных
нейтрофилов превышает 5%.
Для костномозгового
кроветворения характерен мегалобластический
тип, для
которого типично раздражение красного
ростка и появление мегалобластов.
Костный мозг гиперклеточный за счет
увеличения количества ядросодержащих
клеток красного ряда. В результате
нарушения клеточного деления эритроидные
клетки становятся очень крупными
(мегалобласты).
Они характеризуются большой величиной,
нежной структурой и необычным расположением
хроматина в ядре, асинхронной
дифференцировкой ядра и цитоплазмы.
В сыворотке крови
у больных с В12-дефицитной
анемией повышена
концентрация билирубина, железа,
ферритина
(железосодержащий белок печени).
Активность
сывороточной лактатдегидрогеназы (ЛДГ)
значительно повышена
и увеличивается по мере прогрессирования
заболевания. Уровень сывороточного
цианкобаламина
обычно низкий, но может быть нормальным.
Дифференциальная
диагностика
проводится с
фолиево-дефицитной анемией.
Дефицит фолиевой кислоты наблюдается
обычно в более молодом возрасте, не
сопровождается атрофическими изменениями
слизистой оболочки желудка и неврологической
симптоматикой.
Для исключения
фолиево-дефицитной анемии проводится
тест Шиллинга: вводят витамин В12
парентерально, который определяется в
моче в минимальных количествах при
В12-дефицитной
анемии и в больших количествах — при
фолиево-дефицитной. Важно учитывать,
что назначение больным с В12-дефицитной
анемией фолиевой кислоты быстро
способствует развитию фуникулярного
миелоза.
Следует помнить,
что симптоматическую мегалобластную
анемию вызывают опухоли
желудка, тонкой и слепой кишки, а также
глистная инвазия
(глистная В12-дефицитная
анемия), что необходимо исключить при
верификации диагноза.
Дифференцировать
следует и с эритромиелозами
(начальные формы проявления лейкоза),
которые сопровождаются анемией,
протекающей с повышенным содержанием
в крови витамина В12
и резистентной к лечению цианкобаламином.
При проведении
дифференциальной диагностики
В12-дефицитной
анемии необходимо установить ее причины.
ЛечениеВ12-дефицитной
анемии включает парентеральное
введение витамина В12
или гидрооксикобаламина (метаболит
цианкобаламина) в дозах, обеспечивающих
удовлетворение дневной потребности и
удвоение запасов депо. Витамин В12
вводят по 1000 мкг внутримышечно ежедневно
в течение двух недель, затем один раз в
неделю до нормализации уровня гемоглобина,
после чего переходят на введение 1 раз
в месяц в течение всей жизни.
Оксикобаламин
по фармакологическим свойствам близок
к цианкобаламину, но сравнительно с
последним быстрее превращается в
организме в активную коферментную форму
и дольше сохраняется в крови. Вводится
оксикобаламин в дозе 500–1000 мкг через
день или ежедневно. При наличии
неврологической симптоматики необходимо
введение препарата в дозе 1000 мкг каждые
две недели в течение шести месяцев.
При фуникулярном
миелозе назначаются массивные дозы
цианкобаламина по 1000 мкг ежедневно в
течение 7–10 дней, далее два раза в неделю
до исчезновения неврологических
признаков.
Начало терапии
кобаламином быстро улучшает самочувствие
больных. Костномозговой эритропоэз
превращается из мегалобластного в
нормобластный уже через 12 часов после
введения витамина В12.
Поэтому назначение витамина В12
при
коматозном состоянии относится к
неотложным мероприятиям. Ретикулоцитоз
появляется на 3–5 день, пик его
(ретикулоцитарный криз) наиболее выражен
на 4–10 день. Концентрация гемоглобина
нормализуется через 1–2 месяца.
Гиперсегментация нейтрофилов сохраняется
до 10–14 дней.
Трансфузии
эритроцитарной массы
показаны для срочной ликвидации симптомов
гипоксии.
После терапии
кобаламином может развиться тяжелая
гипокалиемия.
Поэтому в процессе лечения витамином
В12
необходимо тщательно контролировать
содержание калия в крови и при необходимости
проводить заместительную терапию.
Лечение кобаламином
следует назначать всем больным после
тотальной
гастрэктомии.
Для предупреждения обострения витамин
В12
вводится один раз в две недели по 100 –
200 мкг.
Диспансеризация.
Больные В12-дефицитной
анемией подлежат диспансерному
наблюдению, в ходе которого проводится
мониторинг состояния периферической
крови 1-2 раза в год, а также лечение
заболеваний и состояний, приведших к
развитию данного вида анемии.
Существуют разные
схемы поддерживающей терапии кобаламинами.
При назначении цианкобаламина
рекомендуются пожизненно ежегодные
профилактические трехнедельные курсы
по 400-500 мкг через день либо ежемесячное
введение 500-1000 мкг препарата.
Гидроксикобаламин
рекомендуется
ежегодными профилактическими курсами
по одной инъекции в неделю (1 мг) в течение
2-х месяцев.
Источник
Медицина / Патология / Патология (статья)
B9- и B12-дефицитные анемии
Статья |
21-10-2018, 18:11
|
 АнемияМегалобластная анемия – одна из форм анемии, представляющая большую группу заболеваний, которые возникают в результате нарушения синтеза ДНК в эритроидных клетках; характеризуется мегалобластным типом кроветворения. Нарушение синтеза ДНК происходит при дефиците витаминов B9 (фолиевая кислота) и B12 (цианокобаламин), некоторых генетических нарушениях (наследственных патологиях, сопровождающихся нарушением активности ферментов, принимающих участи в синтезе коферментов фолиевой кислоты или утилизации оротовой кислоты (оротовая ацидурия)).
АнемияМегалобластная анемия – одна из форм анемии, представляющая большую группу заболеваний, которые возникают в результате нарушения синтеза ДНК в эритроидных клетках; характеризуется мегалобластным типом кроветворения. Нарушение синтеза ДНК происходит при дефиците витаминов B9 (фолиевая кислота) и B12 (цианокобаламин), некоторых генетических нарушениях (наследственных патологиях, сопровождающихся нарушением активности ферментов, принимающих участи в синтезе коферментов фолиевой кислоты или утилизации оротовой кислоты (оротовая ацидурия)).
При мегалобластной анемии в костном мозге определяются клетки с характерными морфологическими признаками: крупные, незрелые по внешнему виду ядра, окруженные относительно более зрелой цитоплазмой. С точки зрения биохимии основной причиной этого состояния является нарушение синтеза ДНК: в S-фазе клеточного цикла клетки прекращают развиваться (при частичной репликации ДНК клетка не может завершить процесс деления). При этом синтез РНК не нарушен. Происходит нарушение дифференцировки ядра. Учитывая, что синтез цитоплазматических компонентов очень интенсивный (особенно гемоглобина), площадь клеток-эритроидных предшественников очень расширена – это способствует образованию макроцитов (гиперхромных эритроцитов крупных размеров) или мегалоцитов. Такие изменения также характерны для гранулоцитарных предшественников и мегакароцитов.
Впервые мегалобласная анемия была описана английским ученым Аддисоном (Addison) в 1849 году. Аддисон обозначил ее как злокачественную (пернициозную). Врач Фенвик (Fenwick) из Лондона в 1870 году при вскрытии больного с пернициозной анемией обнаружил атрофию слизистой оболочки желудка. Немецкий врач Биермер (Biermer, Цюрих) в 1872 году в отношении этой патологии применил термин «прогрессирующая пернициозная анемия». А в 1880 ученый Эрлих (Ehrich) в костном мозге больных пернициозной анемией обнаружил крупные клетки со специфической структурой – мегалобласты. В начале XX века пернициозная анемия была одной из самых распространенных патологий крови и считалась неизлечимой.
Специалистам, которые изучали эту патологию и методы ее лечения, было присвоено пять Нобелевских премий. В 1930 году Касл (Castle) предполагал, что в мясе животных содержится «внешний фактор», который связывается с «внутренним фактором», в результате чего образуется так называемое гемопоэтическое вещество, способное усваиваться и депонироваться в печени. Ученые Минот (Minot), Марфи (Murphy) и Випл (Whipple) получили Нобелевскую премию в области медицины и физиологии за новый метод лечения пернициозной анемии сырой печенью. В 1948 году сразу две группы ученых (в США под руководством Фолкерса (Folkers) и в Великобритании под руководством Лестера-Смита (Lester-Smith)) выделили внешний фактор, витамин B12. Также Нобелевскую премию получила Дороти Кроуфут-Хоткин (Dorothy Crowfoot-Hodgkin) за изучение структуры пенициллина и витамина B12.
Витамин B12 (цианокобаламин) обладает структурой корриноида, в основе которой находится углеродная структура коррина, схожего по строению с порфирином. Цианокобаламин – сложная по структуре молекула с центральным атомом кобальта, который связан с четырьмя пиррольными кольцами и нуклеотидом. Витамин B12 имеет две коферментные формы – аденозилкобаламин и метилкобаламин. В крови человека основная форма витамина B12 – метилкобаламин.
Витамин B12 содержится только в продуктах животного происхождения (печень, почки, мясо, молоке и молочных продуктах). Небольшое количество этого витамина синтезируется в кишечнике человека. Цианокобаламин практически не содержится в продуктах растительного происхождения. У травоядных животных синтез витамина B12 происходит в желудке благодаря микроорганизмам, обитателям бобовых и корнеплодов, затем витамин попадает в паренхиматозные ткани и мышцы этих животных. Максимальная концентрация цианокобаламина в печени и почках животных (примерно 100 мкг/100 г продукта). В мясе содержание цианокобаламина гораздо ниже (примерно 0,5-2,0 мкг/100 г). Содержание витамина B12 в молоке и яйцах еще ниже, кроме этого, из-за прочной связи с протеином кобалафилином, содержащийся в этих продуктах витамин плохо усваивается. Цианокобаламин под действием протеолитических ферментов высвобождается в желудке и при кулинарной обработке продуктов.
Через стенки кишечника цианокобаламин попадает в кровь, где вступает в связь с транскобаламином II (транспортным протеином) и через воротную вену распределяется по кровеносной системе, откуда попадает в ткани-мишени.
Содержание цианокобаламина в организме взрослого человека составляет от 2 до 5 мг. Основной запас витамина B12, которого хватает на несколько лет (3-6), находится в печени. Экскреция (выведение из организма) цианокобаламина осуществляется через кишечник (с калом) и почки (с мочой), и составляет примерно 2-5 мкг в сутки. Суточная потребность организма взрослого человека в витамине B12 составляет 3-7 мкг.
Коферменты витамина B12 принимают участие в процессе синтеза ДНК, а также в регуляции функции системы гемопоэза и нервной системы. В крови содержится в большей степени активная форма витамина – метилкобаламин, который участвует в синтезе тетрагидрофолиевой кислоты, необходимой для образования тимидина.
Дефицит витамина B12 приводит к нарушению метаболизма фолатов и синтеза ДНК, в результате чего пролиферирующие кроветворные клетки не способны полностью созревать и нормально делиться. При этом в костном мозге развивается мегалобластический тип кроветворения, что приводит к появлению гигантских клеток миелопоэза и мегакариоцитопоэза. Из-за дефицита витамина B12 или B9 образуется недостаточное количество тетрагидрофолата, что вызывает развитие мегалобластной анемии по причине снижения синтеза нуклеиновых кислот.
Клиническая картина
Классическая картина B12-дефицитной анемии состоит из трех основных синдромов:
- Анемический синдром (см статью «Анемия. Общие положения. Классификация»)
- Желудочно-кишечный
- Неврологический
B12-дефицитная анемия, как правило, манифестирует в возрасте 50-60 лет (при этом такие пациенты часто выглядят старше своего возраста). Этот вид анемии наиболее широко распространен в Скандинавских странах, что обусловлено предрасположенностью к этой патологии голубоглазых блондинов.
B12-дефицитная анемия имеет три степени тяжести:
I степень: Легкая – концентрация гемоглобина в крови > 90 г/л
II степень: Средняя – концентрация гемоглобина в крови 70-90 г/л
III степень: Тяжелая – концентрация гемоглобина в крови < 70 г/л
Как правило больные обращаются к врачу при средней и тяжелой степени анемии. Часто от появления первых симптомов анемии до постановки диагноза проходит более года.
B12-дефицитная анемия обычно дебютирует анемическим синдромом (больного беспокоит слабость, повышенная утомляемость, тахикардия, одышка при незначительной физической нагрузке). По причине относительно медленного развития патологии выраженность анемии по данным лабораторных анализов часто оказывается большей, чем врачи ожидают при анализе клинических данных. Исключением являются больные, у которых неврологическая симптоматика усиливается быстрее, чем анемический синдром. Бывают случаи, когда характерное при глоссите жжение зыка возникает раньше, чем проявления анемии. У больных могут наблюдаться парестезии. При тяжелых случаях развивается фуникулярный миелоз, характеризующийся нарушениями чувствительности и походки. В случае дальнейшего прогрессирования патологии у больного возникают нарушения зрения, расстройства мочеиспускания. Нарушения функций желудочно-кишечного тракта наблюдаются примерно у 40-50% пациентов, страдающих B12-дефицитной анемией.
Объективное обследование пациента с B12-дефицитной анемией позволяет обнаружить характерную бледность кожи (с лимонно-желтым оттенком), субиктеричность кожи и склер. У ряда больных обнаруживаются объективные признаки глоссита (язык приобретает алый цвет с участками воспаления; сосочки языка сглаженные, иногда атрофированные – «лакированный» язык; отметим, что эти симптомы встречаются очень редко, как и глубокая мегалобластная анемия). Незначительное увеличение печени и селезенки при B12-дефицитной анемии наблюдается у 10-20% пациентов. Но у большинства пациентов патология сопровождается только анемическим синдромом, который часто является единственным клиническим признаком даже при тяжелой степени анемии.
Диагностика анемии основана на анамнезе, клинической картине, морфологическом исследовании клеток крови и костного мозга, анализа крови на содержание цианокобаламина и фолиевой кислоты.
Диагностика B12-дефицитной анемии
При B12-дефицитной анемии происходят характерные изменения гемограммы, включающие лейкопению, макроцитарную анемию, тромбоцитопению, а также гиперсегментированные нейтрофилы в мазке крови.
Мегалобластные анемии характеризуются преимущественным снижением уровня эритроцитов и в меньшей степени гемоглобина. Гиперхромия в этом случае проявляется повышением величины гемоглобина > 35 пг или цветового показателя > 1,1. Также увеличивается средний объем эритроцитов (> 100 фл и даже > 120 фл). В случаях, когда B12-дефицитная анемия сочетается с железодефицитной анемией или анемией хронического воспаления, средний объем эритроцитов может оставаться в пределах нормы. Выраженное повышение уровня ретикулоцитов (200-300% и выше) развивается на 5-8 день лечение витамином B12 – это повышение является подтверждением диагноза. Кроме этого, у многих пациентов наблюдается лейкопения (выраженность лейкопении часто коррелирует со степенью тяжести анемии). В некоторых случаях может наблюдаться снижение уровня тромбоцитов.
Большое диагностическое значение среди биохимических анализов крови имеет исследование уровня цианокобаламина. В миелограмме при нормальном или повышенном уровне миелокариоцитов обнаруживается выраженная гиперплазия эритроидного ростка и мегалобластический тип кроветворения (см рис. 1-7).
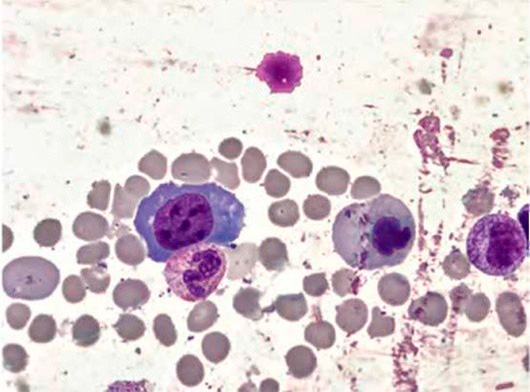
Рисунок 1. B12-дефицитная анемия. Костный мозг. Мегалобласты (окр. по Романовскому-Гимзе; ув. ×100)
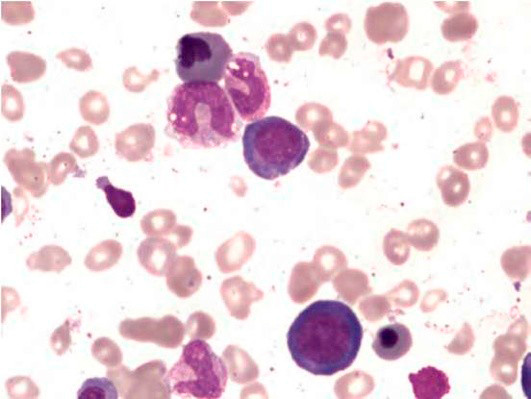
Рисунок 2. B12-дефицитная анемия. Костный мозг. Мегалобласты. Гигантские палочкоядерные нейтрофилы (окр. по Романовскому-Гимзе; ув. ×100)
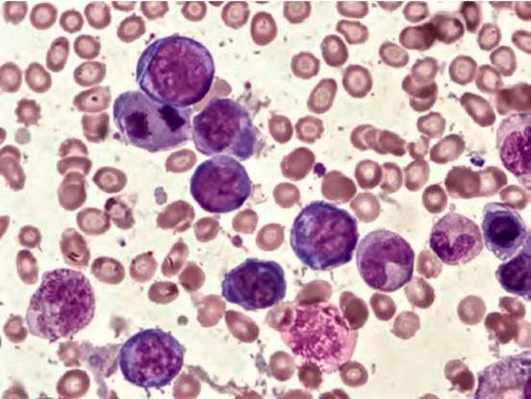
Рисунок 3. B12-дефицитная анемия. Костный мозг. Множественные базофильные мегалобласты – «синий костный мозг» (окр. по Романовскому-Гимзе; ув. ×100)
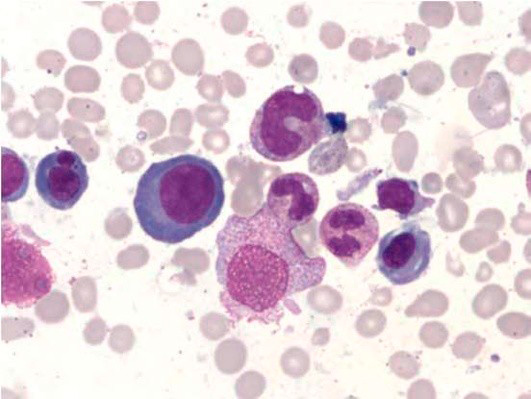
Рисунок 4. B12-дефицитная анемия. Препарат костного мозга. Мегалобластный тип кроветворения (окр. по Романовскому-Гимзе; ув. ×100)
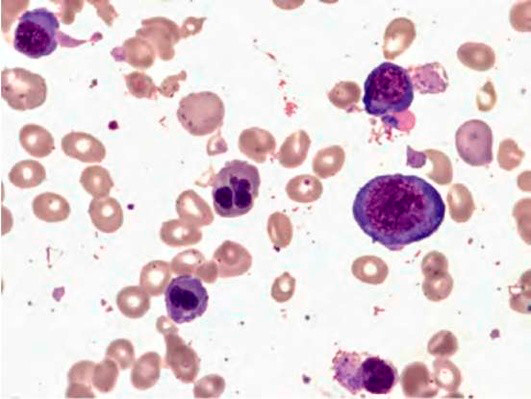
Рисунок 5. B12-дефицитная анемия. Препарат костного мозга. Множественные базофильные мегалобласты – «синий костный мозг» (окр. по Романовскому-Гимзе; ув. ×100)
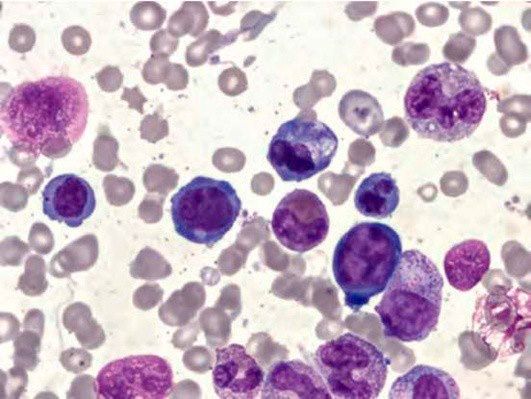
Рисунок 6. B12-дефицитная анемия. Препарат костного мозга. Мегалобласты, гигантские палочкоядерные нейтрофилы (окр. по Романовскому-Гимзе; ув. ×100)
Такие изменения миелограммы можно наблюдать только до начала терапии витамином B12. В аспирате костного мозга, полученного даже после однократной инъекции препарата, мегалобласты исчезают, а мегалобластический тип кроветворения сменяется нормобластическим. Отметим, что очень важным диагностическим критерием является высокий уровень лактатдегидрогеназы в крови.
Основа диагностики B12-дефицитной анемии в гематологии – анализ костного мозга на предмет наличия мегалобластов и миелоцитов с метамиелоцитами (гигантских клеток-предшественников гранулоцитопоэза). Но на практике эти клетки обнаруживаются не во всех случаях (даже если у больного явная форма анемии). Предположительно это происходит из-за того, что какое-то количество цианокобаламина больной все-таки как-то получил, что послужило причиной временного изменения гемопоэза, но не позволило полностью улучшить состояние. Но точные причины такого парадокса неизвестны. Поэтому с целью диагностики типичного случая B12-дефицитной анемии достаточно провести анализ периферической крови, с помощью которого можно определить гиперхромную макроцитарную анемию (при дифференциальной диагностике только патологий из группы миелодиспластических синдромов!). При этом могут обнаруживаться гиперсегментированные нейтрофилы (см рис. 7, 8), иногда метамиелоциты.
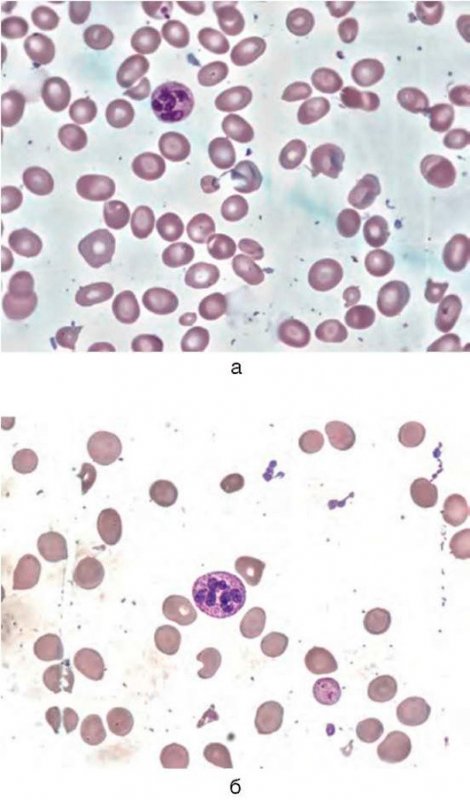 B12-дефицитная анемия
B12-дефицитная анемия
Рисунок 7. B12-дефицитная анемия. Препарат костного мозга. Множественные мегалобласты (окр. по Романовскому-Гимзе; ув. ×100) (а, б)
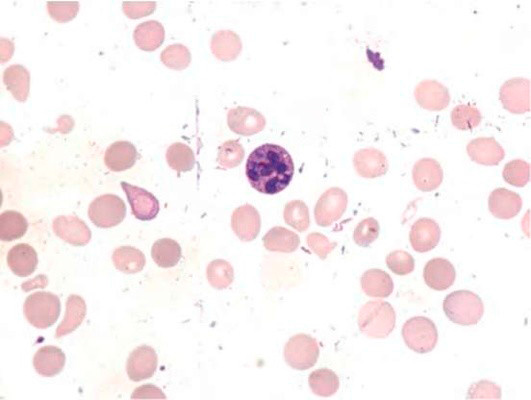
Рисунок 8. B12-дефицитная анемия. Костный мозг. (окр. по Романовскому-Гимзе; ув. ×100)
Если лабораторные исследования демонстрируют умеренную тромбоцитопению, незначительное повышение уровня непрямого билирубина и значительное повышение концентрации лактатдегидрогеназы, диагноз можно считать подтвержденным (в этом случае проведение дополнительных пункций – лишняя процедура).
При диагностике B12-дефицитной анемии важное значение играет фиброгастроскопия, с помощью которой можно подтвердить диагноз «атрофический гастрит» — главная причина дефицита цианокобаламина. Кроме этого, гастроскопия позволяет исключить злокачественную патологию желудка.
После назначения лечения витаминами B9 и B12 наблюдается следующая динамика изменения показателей лабораторных исследований:
— значительное повышение уровня эритроцитов и гемоглобина в течение 14 дней, показатель которых, в зависимости от выраженности дефицита, нормализуется через 8-12 недель с момента начала лечения; отметим, что уровень гемоглобина повышается медленнее, поэтому его показатель в периферической крови возвращается в норму через 1-2 месяца лечения;
— на 2-4-й день терапии начинает увеличиваться уровень ретикулоцитов, достигает максимума на 8-9-й день, и нормализуется к 14-му дню лечения; при этом повышается уровень тромбоцитов и лейкоцитов;
— на 10-14-й день терапии гиперсегментация ядер нейтрофилов сохраняется;
— в течение 24-48 часов после первого введения препарата в костном мозге исчезают мегалобласты; изменения морфологии ядер гранулоцитов сохраняется еще несколько суток;
— биохимический анализ крови показывает повышение уровня мочевой кислоты и холестерина (максимум достигается на пике ретикулоцитоза); концентрация лактатдегидрогеназы, щелочной фосфотазы и билирубина возвращаются в норму; может наблюдаться незначительное снижение концентрации калия в крови.
Лечение
Пока врачи не могли использовать в терапии препараты цианокобаламина, B12-дефицитная анемия считалось фатальным заболеванием. В те времена ремиссию можно было получить с помощью эмпирического подбора рациона питания, трансфузионной терапии или спленэктомии, но после этого следовал очередные рецидивы, которые приводили к смерти пациента (как правило это происходило через 1-3 года с момента диагностирования патологии).
С целью профилактики развития B12-дефицитной анемии рацион питания должен содержать животный белок (печень, сердце, мясо, рыба, молочные продукты и др). Во время манифестации патологии нужно назначать цианокобаламин. Если у больного диагностированы глистные инвазии, дополнительно назначается противогельминтная терапия.
Сегодня для лечения B12-дефицитной анемии широко применяются два препарата: Цианокобаламин и Оксикобаламин. В нашей стране принято назначать Цианокобаламин: подкожно или внутримышечно 200-400 мкг 1 раз в день на протяжении 4-5 недель. В тяжелых случаях и при развитии фуникулярного миелоза суточная дозировка цианокобаламина повышают до 1000 мкг.
При условии назначения адекватного лечения явное улучшение состояния пациента и нормализацию картины костного мозга можно наблюдать уже на 3-4-е сутки лечения. Повышение уровня ретикулоцитов в периферической крови в среднем на 20-30% (ретикулоцитарный криз) развивается через 1-2 недели. Концентрация билирубина в крови возвращается в норму на протяжении 3-4 недель, лактатдегидрогеназы – через 7-14 дней.
При назначении цианокобаламина ремиссия наступает у всех больных B12-дефицитной анемией.
При отсутствии эффекта от терапии на протяжении нескольких недель, следует предполагать неверную трактовку генеза анемии. В этом случае пациенту необходимо провести дополнительную диагностику, чтобы уточнить причину анемического синдрома.
ФОЛИЕВО-ДЕФИЦИТНАЯ АНЕМИЯ
Эта патология относится к группе мегалобластных анемий. Дефицит фолиевой кислоты приводит к нарушению влияния цианокобаламина на процесс синтеза ДНК, что приводит к развитию мегалобластного типа кроветворения.
Дефицит витамина B9 может возникать из-за недостаточного поступления в организм фолиевой кислоты с пищей, патологий желудочно-кишечного тракта (нарушений усвоения фолиевой кислоты), а также при повышенной потребности организма в этом витамине.
Характерные жалобы пациентов с фолиево-дефицитной анемией – общая слабость и головокружения. Глоссит у таких больных, в отличие от больных B12-дефицитной анемией, развивается очень редко. Также при B9-дефицитной анемии не обнаруживаются признаки фуникулярного миелоза.
Как и при дефиците цианокобалавина, при дефиците фолиевой кислоты в периферической крови обнаруживается макроцитоз, повышается среднее содержание гемоглобина в эритроците и средний объем эритроцитов. В костном мозге появляются мегалобласты. Повышается уровень непрямого билирубина в крови, увеличивается активность лактатдегидрогеназы.
Дефицит фолиевой кислоты в организме приводит к повышению уровня гомоцистеина, что является фактором риска для образования венозных тромбов (из-за чрезмерного влияния гомоцистеина на эндотелий кровеносных сосудов). Гетерозиготное носительство мутации метилтетрагидрофолатредуктазы также является причиной высокого уровня гомоцистеина, однако риск образования тромбов при этом ниже.
Лечение фолиево-дефицитной анемии подразумевает применение препаратов фолиевой кислоты.
Источник