Иммунный статус и гепатит с
Сахарова Д.А., Терешков П.П., Витковский Ю.А.
Введение. Мировая пандемия вируса гепатита С остается злободневной реальностью современности. Гепатит С (HCV) характеризуется высокой частотой хронизации, длительным персистированием возбудителя, высоким риском развития осложнений – цирроза печени, первичной гепатокарциномы и является ведущим в структуре смертности от заболеваний печени. Установлено, что основную роль в формировании характера иммунного реагирования макроорганизма играет взаимодействие в системе «вирус-хозяин», что определяет сценарий развития событий при HCV-инфекции [4].
В настоящее время считается доказанным, что высокая частота (50-85% по данным различных авторов) формирования хронических форм и развития осложнений обусловлена «ускользанием» вируса от иммунного надзора [5, 6]. Механизмы этого феномена до сих пор четко не установлены. Предполагается, что центральную роль в элиминации вируса гепатита С играет Т-клеточное звено иммунитета, которое, в конечном итоге всё же оказывается недостаточным [1, 7]. Существенное значение в поддержании патологического процесса у больных придается недостаточности CD4+ Т-хелперов и дисбалансу цитокинов [8].
При этом не в полной мере выяснены вопросы, касающиеся состояния системы иммунитета в зависимости от клинических факторов – наличия репликации, активности процесса, стадии и длительности заболевания, наличия сопутствующей патологии, генотипа HCV, что может иметь важное практическое значение [1].
Таким образом, многие аспекты иммунного ответа при гепатите С остаются невыясненными, в том числе в зависимости от стадии фиброза печени и длительности заболевания, хотя это актуально как в теоретическом, так и в практическом плане.
Цель исследования: изучить некоторые показатели иммунного статуса больных хроническим вирусным гепатитом С в зависимости от ряда клинических характеристик заболевания.
Материалы и методы. Было обследовано 69 человек, находившихся на стационарном лечении в ГУЗ «Краевая клиническая инфекционная больница» г. Читы за период с 2011 по 2013 г. по поводу хронического вирусного гепатита С. Женщины составили 30,4% (21 человек), мужчины – 69,6% (48 человек). Возраст обследованных находился от 16 до 58 лет, средний возраст – 36±1 лет. От всех пациентов получено добровольное информированное согласие на участие в исследовании.
Диагноз хронического вирусного гепатита С выставлен на основании клинико-лабораторных данных и обнаружения рибонуклеиновой кислоты (РНК) HCV методом полимеразной цепной реакции (ПЦР). Длительность заболевания до 5 лет выявлена у 66,7%, свыше 5 лет – у 33,3%. Первая степень биохимической активности процесса определялась у 55,0% больных хроническим вирусным гепатитом С (ХВГС), вторая – у 45,0%. Стадия заболевания по Metavir F0-F1 была диагностирована у 43,5% (30); F2 – у 42,0% (29); F3-F4 – у 14,5% (10).
Группу контроля составили 9 здоровых человек в возрасте от 27 до 42 лет, средний возраст 34,0±2 лет. Женщин было 66,7% , мужчин – 33,3%. От всех обследованных получено добровольное информированное согласие на участие в исследовании.
Кровь для иммунологического обследования получали путем пункции локтевой вены в строго стерильных условиях на 2-3-и сутки стационарного лечения. Взятие крови осуществляли в утренние часы (8-9 часов) строго натощак. Для иммунофенотипирования кровь забирали в пробирку VACUTAINER (BD), содержащую динатриевую соль ЭДТА объемом 2,5 мл.
Изучались активность и количество Lymphocytes (CD45+), T-cell (CD3+), T-help (CD3+CD4+), T-killer (CD3+CD8+), T-cellAktiv (CD3+HLA-DR+), T-helpAktiv (CD3+CD4+HLA-DR+), T-killAktiv (CD3+CD8+HLA-DR+), B-cell (CD19+), NK-cell (CD3-CD16+CD56+), T-NK-cell (CD3+CD16+CD56+). Оценку субпопуляционной структуры лимфоцитов осуществляли стандартным методом прямого пяти-параметрического иммунофлюоресцентного окрашивания цельной крови с использованием коммерческого лизирующего/фиксирующего раствора OPTILYSE С (Beckman Coulter) и панели моноклональных антител tetraCHROME™ и IOTest (Beckman Coulter): 1-ая панель – CD45-FITC/CD4-RD1/CD8-ECD/CD3-PC5 и HLA-DR-PC7; 2-ая панель – CD45-FITC/CD56-RD1/CD19-ECD/CD3-PC5 и CD16-PC7. Контрольные пробы инкубировали с иммуноглобулинами, мечеными флуорохромами (FITC, RD1, ECD, PC5, PC7) соответствующего изотипа – мышиные IgG1, IgG2a IOTest (Beckman Coulter). Цитофлюорометрию осуществляли на проточном цитофлюориметре «Cytomics FC-500» (Beckman Coulter, USA), регистрировали суммарно не менее 10 тыс. событий. Данные анализировали с помощью программы CXP Cytometer (Beckman Coulter).
Определение показателя лимфоцитарно-тромбоцитарной адгезии (ЛТА) проводили по методу, предложенному Ю.А. Витковским и соавт. (1999) [2]. Свежую гепаринизированную кровь обследуемых больных наслаивали на градиент урографин-фикол (плотность 1,077) и выделяли лимфоциты. Собирали интерфазное кольцо, содержащие клетки и кровяные пластинки, однократно промывали фосфатно-солевым буфером (рН 7,4) и центрифугировали при 1000 об/мин в течение 3-4 минут. Надосадочную жидкость сливали, осадок микроскопировали в камере Горяева. Показатель ЛТА выражали числом лимфоцитарно-тромбоцитарных коагрегатов на 100 клеток (норма – 13-15%). Степень адгезии (ЛТИ) определяли как число кровяных пластинок, адгезированных на поверхности одного лимфоцита (норма – 3,0±0,3).
Статистическая обработка полученных результатов осуществлялась с использованием пакета анализа Microsoft Excel. Она включала описание выборки, нахождение средней арифметической, среднеквадратического отклонения и ошибки средней арифметической, определялись частоты встречаемости признаков, группировка данных. Достоверность различий определялась по t-критерию Стьюдента.
Результаты и их обсуждение. Установлено, что у всех больных хроническим вирусным гепатитом С изменены показатели иммунограммы, по сравнению с контролем, при этом аналогичные закономерности определялись вне зависимости от стадии фиброза печени (табл. 1). Общими изменениями, по сравнению с контролем, явились значимое повышение относительного и абсолютного количества лимфоцитов, субпопуляций CD3+, CD3+CD4+, активированных Т-лимфоцитов (CD3+HLA-DR+), активированных Т-хелперов (CD3+CD4+HLA-DR+), активированных Т-киллеров (CD3+CD8+HLA-DR+). Одновременно отмечено снижение, по сравнению с контролем, процента и количества субпопуляций лимфоцитов CD19+ и CD3-CD16+CD56+. Повышенным оказался и иммунорегуляторный индекс (CD4+/CD8+).
В табл. 2 представлены средние показатели иммунограммы больных хроническим вирусным гепатитом в зависимости от степени активности процесса, в сравнении с контролем. Изменения иммунограммы аналогичны описанным выше, при этом значимых отличий между первой и второй степенью активности не зарегистрировано.
Изменения показателей иммунограммы у больных хроническим вирусным гепатитом С в зависимости от длительности заболевания представлены в табл. 3. Выявлено, что чем продолжительнее стаж болезни, тем значимо больше становилось активированных Т-лимфоцитов (р<0,05), активированных Т-хелперов (р<0,05) и активированных Т-киллеров (р<0,05). При этом иммунорегуляторный индекс (CD4+/CD8+) был повышен на ранних сроках заболевания и снижался после 5 лет болезни (р<0,01). Другие показатели клеточного иммунитета не зависели от длительности течения хронического вирусного гепатита С.
Не выявлено отличий, в сравнении с контролем, по таким показателям клеточного иммунитета, как абсолютное и относительное количество Т-киллеров (CD3+CD8+) и относительного количества субпопуляции CD3+CD16+CD56+.
В настоящее время широко изучаются межклеточные взаимодействия, особенно между системой гемостаза и иммунитета. Установлено, тромбоциты
Таблица 1. Сравнительная характеристика средних значений показателей иммунного статуса у больных ХВГС на разных стадиях фиброза печени (M±m)
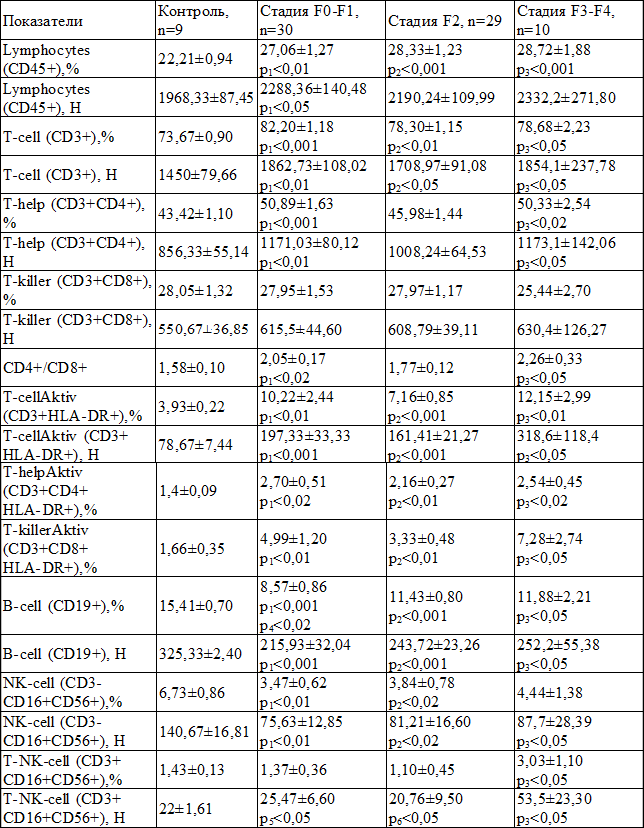
Примечания: р1 – достоверное различие показателей группы F0-F1 с контролем; р2 – достоверное различие показателей группы F2 с контролем; р3 – достоверное различие показателей группы F3-F4 с контролем; р4 – достоверное различие показателей группы F0-F1 с группой F2; р5 – достоверное различие показателей группы F0-F1 с группой F3-F4; р6 – достоверное различие показателей группы F2 с группой F3-F4
Таблица 2. Сравнительная характеристика средних значений показателей иммунного статуса у больных ХВГС в зависимости от степени активности процесса (M±m)
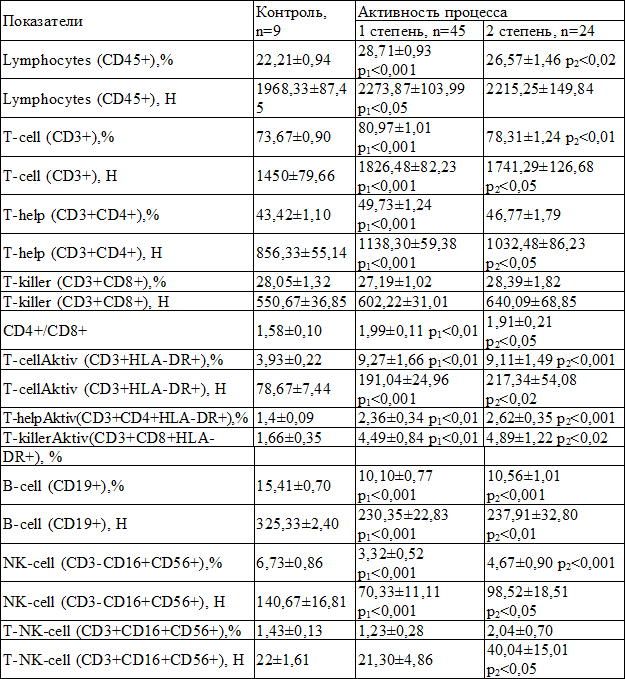
Примечания: р1 – достоверное различие показателей группы с 1 степенью активности с контролем; р2 – достоверное различие показателей группы со 2 степенью активности с контролем; р3 – достоверное различие показателей группы с 1 степенью активности с группой со 2 степенью активности
имеют отношение к протеканию воспалительных реакций: адгезивные взаимодействия между тромбоцитами и лейкоцитами являются важными звеньями механизмов, обеспечивающих миграцию лейкоцитов в зону повреждения, а, следовательно, воспаления и развития иммунных и репаративных реакций [2, 3]. Этот феномен получил название лимфоцитарно-тромбоцитарной адгезии.
Установлено, что у больных хроническим вирусным гепатитом С общий показатель ЛТА оказался пониженным – 9,13 ± 0,56%, при этом значимых отличий от стадии фиброза печени, активности процесса и длительности заболевания не выявлено (табл. 4). При этом заметна тенденция к повышению лимфоцитарно-тромбоцитарной адгезии с ростом степени активности и снижение ее с увеличением стажа болезни.
Таблица 3. Сравнительная характеристика средних значений показателей иммунного статуса у больных ХВГС в зависимости от длительности заболевания (M±m)
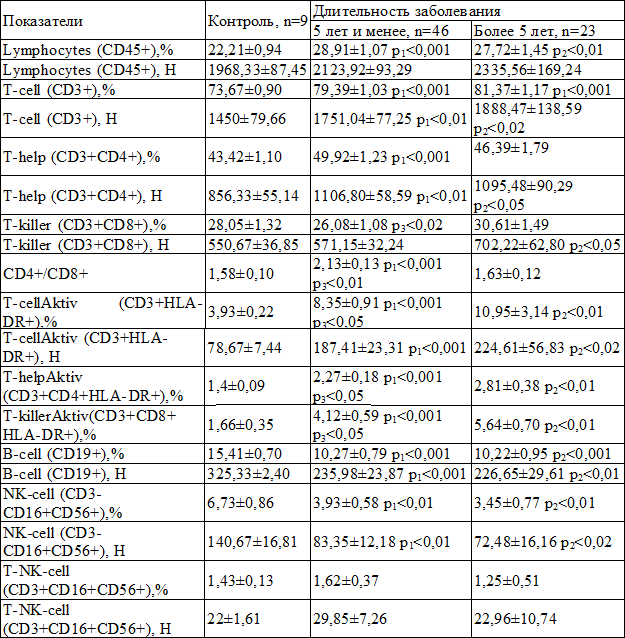
Примечания: р1 – достоверное различие показателей группы с длительностью заболевания 5 лет и менее с контролем; р2 – достоверное различие показателей группы с длительностью заболевания более 5 лет с контролем; р3 – достоверное различие показателей группы с длительностью заболевания 5 лет и менее с группой с длительностью заболевания более 5 лет
Среднее число тромбоцитов, вступивших в контакт с лимфоцитами, у больных ХВГС было уменьшенным – 2,60 ± 0,12. Нами не получено зависимости изменения этого показателя от изучаемых характеристик заболевания, но заметно снижение ЛТИ с увеличением степени активности процесса.
Таблица 4. Показатели ЛТА и ЛТИ у больных хроническим вирусным гепатитом С в зависимости от некоторых клинических характеристик заболевания
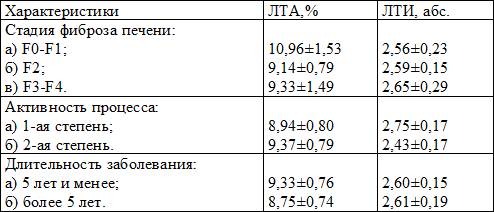
Выводы. Таким образом, у больных хроническим вирусным гепатитом С, в сравнении с контролем, установлен значительный рост популяции активированных Т-лимфоцитов (CD3+HLA-DR+), активированных Т-хелперов (CD3+CD4+HLA-DR+) и активированных Т-киллеров (CD3+CD8+HLA-DR+), что является проявлением дизрегуляции клеточного иммунитета и отражает иммунопатогенез HCV-инфекции. При этом данные изменения зависят от длительности заболевания, и не коррелируют со стадиями фиброза печени и степенью активности процесса.
Одновременно с этим, выявлено значимое снижение процента и количества субпопуляций лимфоцитов CD19+ и CD3-CD16+CD56+.
Показатель лимфоцитарно-тромбоцитарной адгезии оказался сниженным у больных ХВГС, особенно у лиц с более высоким стажем болезни, что свидетельствует о дисфункции Т-лимфоцитов, проявляющейся в уменьшении их способности к адгезии тромбоцитов.
Полученные результаты демонстрируют необходимость изучения иммунограммы и теста лимфоцитарно-тромбоцитарной адгезии для оценки иммунитета у больных хроническим вирусным гепатитом С.
Источник
Человеческий организм оснащен собственным механизмом борьбы с угрозой, пришедшей из мира бактерий и вирусов — иммунитетом. Благодаря функциям иммунной системы, инфицирование происходит не при каждом контакте с патогеном.
Однако именно иммунитет может указать на наличие вируса в крови человека. Ведь первым, что указывает на заражение небактериального типа являются иммуноглобулины, или антитела к антигенам возбудителя заболевания.
Но какова иммунная реакция организма на гепатит С? Как борется иммунитет с этой болезнью? Что происходит с иммунитетом после гепатита С? Ответы на все эти вопросы вы сможете найти в нашей статье.
Функции иммунной системы
Иммунитет против гепатита С — особое явление, требующее отдельного изучения. Некоторые пациенты полагают, что, благодаря наличию антител к антигенам ВГС возможно самоизлечение, однако подобное мнение ошибочно. С таким заболеванием, как гепатит С, иммунитет справляется без помощи медикаментов в крайне редких случаях, поэтому надеяться на это при постановке соответствующего диагноза не рекомендуется.
Для того, чтобы понять, как воздействует на вирус гепатита иммунитет, следует изучить функции иммунной системы. Основной из этих функций является контроль и регулирование основных физиологических реакций, обеспечивающих жизнеспособность организма. Иммунная система защищает органы и ткани от чужеродного проникновения (в том числе, вирусного).
Статья опубликована при поддержке исследовательского института индийского фармацевтического производителя Zydus Heptiza. Официальный сайт в России Zydus.ru
В состав рассматриваемой наиважнейшей области человеческого организма входят:
- Тимус
- Селезенка
- Лимфатические узлы
- Межэпителиальные лимфоциты
- Кишечные бляшки
- Печень
- Носоглоточные миндалины
Наличие антител к ВГС
Борьбу иммунитета с вирусным гепатитом С при фактическом заражении можно проследить по появлению иммуноглобулинов в крови пациента. Поэтому самым первым анализом, который необходимо сдать при подозрении на ВГС, является тест на антитела к антигенам гепатовируса.
Для максимально точной диагностики вирусного заболевания проверяется наличие следующих типов иммуноглобулинов:
- lgM – по их наличию определяется начальная стадия болезни;
- IgG – указывает на хроническую форму вирусного воспаления печени, а также на перенесенную ранее болезнь
- Неструктурные или структурные белковые соединения патогенного характера.
Так как при анализе на антитела есть вероятность ложноположительного результата, пациентам рекомендуется сдавать повторные тестирования для более точного определения своего состояния.
Виды и различия иммуноглобулинов
Антитела, или иммуноглобулины, представляют собой особые белковые фракции, которые вырабатываются организмом человека в ответ на проникновение в него чужеродного материала. Основная их функция – защита от вирусов, бактерий и их антигенов. Некоторые антитела входят в состав медицинских препаратов.
Всего есть пять типов иммуноглобулинов: A, D, G, E и M. Все они различны по особенностям строения и функциям:
- М – вырабатывается сразу после того, как чужеродный агент попал в биологические жидкости носителя
- G – защищает от повторного инфицирования или рецидива болезни
- E – трудно выявляется, основная функция — защита от возрастания вирусной нагрузке, участие в анафилактической реакции
- А – защищает от чужеродного проникновения слизистые оболочки органов и полостей
- D – применяется в противовирусных медикаментах.
В качестве экстренной терапии, иммуноглобулины могут применяться при экстренной терапии гепатита В. В случае ВГС более эффективно лечение противовирусными препаратами прямого действия (ПППД).
Как иммунитет борется с вирусом?
Возбудитель вирусного гепатита С поступает в организм через плазму крови. Затем флававирус атакует гепатоциты – клетки, формирующие печень. Вирус поражает клеточное ядро, программируя его на проекцию новых элементов для репликации вирионов. Этот процесс негативно сказывается на общем состоянии больного, возникает острая фаза заболевания (примерно у 15% из общего числа больных).
Активная работа иммунитета против гепатита С начинается до острого периода и продолжается в течение него. Иммунная система делает все возможное, чтобы избежать инфицирования, и в ряде случаев организму удается победить болезнь. Тогда острый ВГС не переходит в хроническую форму, и пациент постепенно идет на поправку.
В плазме крови таких пациентов фиксируются антитела, указывающие на победу иммунитета над гепатитом С. Но в большинстве случаев заболевание переходит в хроническую форму, и в этом случае без систематического лечения ПППД больной не поправится. Однако и в случае медикаментозного лечения пациенту немаловажно поддерживать в норме иммунную систему. Для этого нужно:
- Придерживаться правильного питания (диетический стол №5), следить за своим весом.
- Отказаться от употребления спиртных напитков, наркотиков и табачной продукции.
- Высыпаться, избегать стрессовых ситуаций.
- Поддерживать физическую форму и заниматься посильными физическими упражнениями.
- Вовремя принимать выписанные лечащим врачом препараты.
- Сделать прививки от гепатитов А и В, так как возможна ко-инфекция.
К сожалению, с гепатитом С иммунитет далеко не всегда может справиться самостоятельно. К тому же, из-за постоянной борьбы с заболеванием, он ослабевает. Для успешного лечения ВГС огромное значение имеет своевременная диагностика болезни. Обнаружение инфицирования на ранней стадии позволяет быстрее подобрать эффективное лечение и избежать осложнений.
Иммунитет после гепатита С
После перенесенной болезни в крови пациента обнаруживаются антитела группы G. Эти иммунноглобулины формируют естественный барьер между клетками крови и гепатовирусом, препятствуя повторному заражению. Благодаря их работе, удается избежать рецидива опасного заболевания.
Однако в целом иммунитет после гепатита С может быть сильно ослабленным. Наличие G-антител не гарантирует абсолютной защиты от вторичного заболевания. Поэтому после курса терапии ВГС пациенту следует соблюдать все необходимые меры предосторожности и избегать контакта с зараженной кровью.
Оцените статью:
| Всего голосов: 1 Средняя оценка: 5
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Решетников И.В.
1
1 ГБОУ ВПО «Южно-Уральский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Одним из главных путей передачи ВИЧ в России остается внутривенное употребление наркотиков. Число ВИЧ-инфицированных лиц с сопутствующим заболеванием хронический вирусный гепатит С (ХВГС) очень велико вследствие общих путей передачи ВИЧ и ВГС. Влияние вирусного гепатита С на течение ВИЧ-инфекции остается спорным вопросом. В нашей работе исследовались особенности иммунного статуса ВИЧ-инфицированных потребителей инъекционных наркотиков (ПИН) с хроническим вирусным гепатитом С. Для этого была использована система расширенного дифференциального подсчета лейкоцитов методом проточной цитометрии CytoDiff. Данная система позволяет определять относительные и абсолютные количества следующих клеточных популяций: B–лимфоциты, T- и NK-клетки (CD16+ и CD16-), моноциты (CD16+ и CD16-), зрелые нейтрофилы, эозинофилы, базофилы, незрелые гранулоциты, предшественникиT- и B-клеток. Уровень лимфоцитов CD4+ определялся с помощью стандартной панели моноклональных антител CD45-FITC/CD4-RD1/CD3-PC5. Был проведен сравнительный анализ двух групп ВИЧ-инфицированных пациентов – ПИН с дополнительным заболеванием ХВГС и лица без ХВГС, не употребляющие инъекционные наркотики. В группе ПИН с коинфекцией ВИЧ/ВГС были зафиксированы более низкие относительные и абсолютные количества Т-хелперов. Достоверных различий по другим популяциям лейкоцитов не выявлено.
потребители инъекционных наркотиков (ПИН)
вирус гепатита С (ВГС)
вирус иммунодефицита человека (ВИЧ)
1. Санникова О.Е. Социально-психологические аспекты дезадаптации ВИЧ-инфицированных лиц в пенитенциарной среде / О.Е. Санникова, А.Г. Соловьев, П.И. Сидоров // Экология человека. – 2009. – № 4. – С. 20-24.
2. De Luca A. Coinfection with hepatitis viruses and outcome of initial antiretroviral regimens in previously naïve HIV-infected subjects / A. De Luca, R. Bugarini, A.C. Lepri et al. // Arch Intern Med. – 2002. – Vol. 162. – P. 2125-2132.
3. Greub G. Clinical progression, survival, and immune recovery during antiretroviral therapy in patients with HIV-1 and hepatitis C virus co-infection / G. Greub, B. Ledergerber, M. Battegay et al. // Lancet. – 2000. – Vol. 356. – P. 1800-1805.
4. Laurence J. T-Cell Subsets in Health, Infectious Disease, and Idiopathic CD4+T Lymphocytopenia / J. Laurence // Annals of Internal Medicine. – 1993. – Vol. 119 – P. 55-62.
5. McCarthy L. Opioids, opioid receptors, and the immune response / L. McCarthy, M. Wetzel, J.K.Sliker et al. // Drug Alcohol Depend. – 2001. – Vol. 62. – P. 111-123.
6. Sulkowski M.S. Hepatitis C virus infection as an opportunistic disease in persons infected with human immunodeficiency virus / M.S. Sulkowski, E.E. Mast, L.B. Seef, D.L. Thomas // Clin Infect Dis. – 2000. – Vol. 30. – P. 77-84.
7. Sulkowski M.S. Hepatitis C and progression of HIV disease / M.S. Sulkowski, R.D. Moore, S.H. Mehta et al. // JAMA. – 2002. – Vol. 288. – P. 199-206.
8. Van Asten L. Infection with concurrent multiple hepatitis C virus genotypes is associated with faster HIV disease progression / L. Van Asten, M. Prins // AIDS. – 2004. – Vol. 18. – P. 2319-2324.
Коинфекция ВИЧ/ВГС широко распространена по всему миру. Это связано, прежде всего, с общими путями передачи обоих вирусов. Инфицирование ВИЧ через парентеральное употребление наркотиков остается одним из главных путей передачи ВИЧ-инфекции. По этой причине число ВИЧ-инфицированных потребителей инъекционных наркотиков (ПИН) с сопутствующим заболеванием ВГС очень велико. От 50 до 90 % ПИН, которые заражаются ВИЧ в результате инъекционного потребления наркотиков, одновременно инфицированы ВГС [6].
Данные относительно влияния инфицирования ВГС на течение ВИЧ-инфекции остаются противоречивыми. Ряд ученых отмечает более быстрое прогрессирование ВИЧ-инфекции у пациентов с ВГС [2, 3, 8]. Часть ученых отмечает, что никакого значимого влияния ВГС на число Т-хелперов, скорость развития СПИД или смертность у ВИЧ-инфицированных лиц не наблюдается [7].
Целью нашей работы стало изучение влияния ХВГС на субпопуляционный состав лейкоцитов и вирусную нагрузку ВИЧ у ВИЧ-инфицированных потребителей инъекционных наркотиков.
Материалы
В исследовании приняли участие 62 ВИЧ-инфицированных лица с III и IVА стадией заболевания по Покровскому, находящихся на диспансерном наблюдении в инфекционном отделении для лечения больных ВИЧ/СПИДом Клиники ГБОУ ВПО ЮУГМУ Минздрава России. Среди ВИЧ-инфицированных ПИН, вошедших в исследование, большая часть использовала героин или «ханку» (опиоидный наркотик кустарного производства).
Для исключения влияния стадии заболевания на результаты сравнения был проведен анализ отдельно для пациентов с III и IVА стадиями заболевания. ВИЧ-инфицированные лица каждой стадии были разделены на 2 группы — лица, не являющимися ПИН, без сопутствующего заболевания ХВГС (группа 1) и ПИН с сопутствующим диагнозом ХВГС (группа 2). Среди пациентов с III стадией заболевания в группу 1 вошли 25 человек, в группу 2-17 человек. Среди пациентов с IVА стадией заболевания в группу 1 вошли 5 человек, в группу 2-15 человек.
Среди ВИЧ-инфицированных лиц с III стадией в группе 1 средний возраст составил 30,0±6,3 лет, в группе 2 — 29,9±3,3 лет. Среди ВИЧ-положительных лиц с IVА стадией в группе 1 средний возраст составил 26,8±4,1 лет, в группе 2 — 32,8±4,0 лет. Все пациенты, включенные в исследование, не получали антиретровирусную терапию.
ВГС у большинства ВИЧ-инфицированных лиц, включённых в исследование, был охарактеризован врачом-клиницистом как ХВГС минимальной степени активности.
Методы
Для изучения субпопуляционного состава лейкоцитов нами была использована новейшая система расширенного дифференциального подсчета лейкоцитов методом проточной цитометрии CytoDiff производства компании BeckmanCoulter. Система CytoDiff включает в себя панель моноклональных антител, реагенты для контроля качества и соответствующее программное обеспечение. Анализ проводился на проточном цитометре FC500 Cytomicsпроизводства BeckmanCoulter.
Реагенты CytoDiff представляют собой пятицветную комбинацию из 6 моноклональных антител, которая позволяет с помощью проточной цитометрии определить 9 гематологических параметров в образце цельной крови. Комбинация антител CD36‑FITC/CD2‑PE/CD294(CRTH2)‑PE/CD19‑ECD/CD16‑PC5/CD45‑PC7.
Реагент предназначен для использования в рутинной практике клинической лаборатории для invitro диагностики.
При использовании значения общего количества лейкоцитов (WBC), полученного с помощью автоматического гематологического анализатора, анализ образца, окрашенного реагентом CytoDiff, позволяет получить как значения относительного содержания тех или иных популяций клеток, так и абсолютные значения.
Используемая стратегия гейтирования позволяет обнаружить циркулирующие лейкоциты, среди которых в дальнейшем определяют 9 гематологических параметров. Результат представляется в виде процентного содержания положительно-окрашенных клеток.
В образцах цельной крови система определяет следующие гематологические параметры (таблица 1).
Таблица 1
Популяции лейкоцитов и соответствующие им фенотипы, доступные для определения с помощью системы CytoDiff
Популяция клеток | Условное обозначение (фенотип) |
В-лимфоциты | Ly B (SSClow, CD45high, CD16-, CD2 и CRTH2-, CD19+) |
Т- и NK-клетки CD16- | T- (SSClow, CD45high, CD16-, CD2+ или CRTH2+) |
Т- и NK-клетки CD16+ | T+ (SSClow, CD45high, CD16+, CD2+ или CRTH2+) |
Т- и NK-клетки | Lymph T&NK |
Общее количество лимфоцитов | LymphTotal |
Популяция клеток | Условное обозначение (фенотип) |
Моноциты CD16- | M- (SSCint, CD16-, CD2- и CRTH2-, CD19-, CD36+) |
Моноциты CD16+ | M+ (SSCint, CD16+, CD2- и CRTH2-, CD19-, CD36+) |
Общее количество моноцитов | MonoТotal |
Незрелые гранулоциты | Imm Gr (SSChigh, CD45int, CD16-, CD2- и CRTH2-) |
Эозинофилы | Eo Total (SSChigh, CD45high, CD16-, CD2+ или CRTH2+) |
Зрелые нейтрофилы | Neutro Mature (SSChigh, CD45high, CD16+) |
Общее количество нейтрофилов | NeutroTotal |
Предшественники В-лимфоцитов | Xb (SSClow, CD45low, CD16-, CD2 и CRTH2-, CD19+) |
Предшественники Т-лимфоцитов | Xt (SSClow, CD45low, CD16-, CD2+ или CRTH2+) |
Предшественники моноцитов | Xm |
Базофилы | Baso Total (SSCint, CD45int, CD16-, CD2+ или CRTH2+) |
Для определения числа Т-хелперов была использована дополнительная панель моноклональных антител CD45-FITC/CD4-RD1/CD3-PC5. Анализ проводился на том же проточном цитометре FC500 Cytomics.
Определение вирусной нагрузки ВИЧ проводилось методом ПЦР на автоматизированной системе для анализа нуклеиновых кислот Abbott m2000rt.
Результаты и обсуждение
Среди ВИЧ-инфицированных пациентов с III стадией заболевания в группе 2 относительно группы 1 наблюдается снижение относительного и абсолютного числа Т-хелперов (таблица 2).
Таблица 2
Сравнительный анализ показателей иммунной системы у ВИЧ-инфицированных лиц с III стадией заболевания с учетом сопутствующегозаболевания ХВГС и приема наркотиков, (M±m)
Показатели | Группа 1 (ПИН-, ХВГС-) | Группа 2 (ПИН+, ХВГС+) |
n=25 | n=17 | |
Т-хелперы, % | 27,75±1,63 | 20,37±1,77 |
Т-хелперы, клеток/мкл | 536,45±31,39 | 405,43±47,84 |
Примечание: в таблицах 2 и 3 указаны только статистически значимые показатели, р<0,05.
Среди ВИЧ-инфицированных пациентов с IVА стадией заболевания в группе 2 относительно группы 1 наблюдается снижение относительного числа лимфоцитов, T- и NK-клеток, в том числе CD16-негативных. В группе 2 также зафиксировано снижение абсолютного количества Т-хелперов и CD16-негативных T- и NK-клеток (таблица 3).
Таблица 3
Сравнительный анализ показателей иммунной системы у ВИЧ-инфицированных лиц с IVА стадией заболевания с учетом сопутствующего заболевания ХВГС и приема наркотиков, (M±m)
Показатели | Группа 1 (ПИН-, ХВГС-) | Группа 2 (ПИН+, ХВГС+) |
n=5 | n=15 | |
Т- и NK-клетки CD16-, % | 39,60±4,09 | 22,29±3,12 |
Т- и NK-клетки CD16-, клеток/мкл | 2327,21±793,33 | 1146,21±158,68 |
Т- и NK-клетки, % | 42,56±4,31 | 25,15±3,23 |
Общее количество лимфоцитов, % | 45,89±4,87 | 28,13±3,33 |
Т-хелперы, клеток/мкл | 543,00±150,71 | 246,50±50,67 |
Достоверных различий по уровню вирусной нагрузки ВИЧ не выявлено.
К настоящему времени вопрос о влиянии ВГС на течение ВИЧ-инфекции изучен недостаточно. Результаты нашего исследования показывают, что сопутствующее заболевание ХВГС усугубляет состояние иммунной системы ВИЧ-инфицированных лиц, что выражается в более низком уровне Т-хелперов. По данным ряда ученых, уже при моноинфекции ВГС фиксируется снижение CD4+ клеток [4]. В контексте же ВИЧ-инфекции у ВГС может быть особая роль. ВГС активирует клетки иммунной системы, а активация клеток является обязательным условием для репликации ВИЧ.
Нельзя также исключить воздействия наркотических средств на иммунную систему ПИН. У опиатных наркоманов более высокий уровень инфекционной заболеваемости, что может быть непосредственно связано с ослаблением функций иммунной системы. Морфин и героин усиливают апоптоз лимфоцитов, активируя клетки через их μ-опиоидные рецепторы [5]. В контексте ВИЧ-инфекции активация клеток может играть дополнительную роль — активация необходима для репликации вируса.
Возможны и другие причины. Согласно литературным данным, у ВИЧ-инфицированных ПИН наблюдается повышенный уровень кортизола [1]. При этом известно, что кортикостероиды оказывают негативное влияние на лимфоциты: индуцируют апоптоз и эмиграцию тимоцитов, вызывают апоптоз и подавляют пролиферацию зрелых лимфоцитов.
Таким образом, мы отмечаем негативное влияние коморбидной патологии в виде наркотической зависимости и ХВГС на течение ВИЧ-инфекции, что проявляется в более выраженном дефиците лимфоцитов CD4+. При этом наличие ХВГС не влияет на концентрацию РНК ВИЧ в периферической крови пациентов.
Выводы
Вопрос о влиянии ХВГС на течение ВИЧ-инфекции у ВИЧ-инфицированных ПИН до сих пор изучен недостаточно. Полученные в нашей работе данные показывают, что сопутствующее заболевание ХВГС и внутривенное употребление наркотиков приводят к более выраженному дефициту Т-хелперов у ВИЧ-инфицированных лиц. Такие пациенты требуют более пристального внимания врачей-клиницистов при прогнозировании развития ВИЧ-инфекции и назначении антиретровирусной терапии.
Рецензенты:
Абрамовских О.С., д.м.н., начальник отдела аспирантуры и докторантуры, профессор кафедры микробиологии, вирусологии, иммунологии и клинической лабораторной диагностики, ГБОУ ВПО «Южно-Уральский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г.Челябинск.
Савочкина А.Ю., д.м.н., заведующая Центральной научно-исследовательской лабораторией, профессор кафедры микробиологии, вирусологии, иммунологии и клинической лабораторной диагностики, ГБОУ ВПО «Южно-Уральский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Челябинск.
Библиографическая ссылка
Решетников И.В. ВЛИЯНИЕ ХРОНИЧЕСКОГО ВИРУСНОГО ГЕПАТИТА С НА ИММУННЫЙ СТАТУС ВИЧ-ИНФИЦИРОВАННЫХ ПОТРЕБИТЕЛЕЙ ИНЪЕКЦИОННЫХ НАРКОТИКОВ // Современные проблемы науки и образования. – 2014. – № 4.;
URL: https://science-education.ru/ru/article/view?id=14151 (дата обращения: 12.05.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник


