Экспериментальная модель цирроза печени
Аннотация:
Изобретение относится к экспериментальной медицине, а именно к экспериментальной токсикологии и гепатологии, и касается моделирования цирроза печени. Для этого проводят внутрижелудочное введение лабораторным животным в течение 3-х недель, через день, 40% этанола в дозе 3 г/кг. Одновременно осуществляют внутрибрюшинное введение в течение 4-х последовательных дней каждой недели 1% раствора N-нитрозодиметиламина в дозе 5 мг/кг. Способ позволяет повысить воспроизводимость, сократить срок моделирования цирроза печени и приблизить модель к клиническому течению данной патологии у человека. 3 табл.
Изобретение относится к медицине, направлено на моделирование хронического токсического поражения печени в виде фиброза и цирроза и может быть использовано для изучения токсических поражений печени в доклиническом исследовании гепатозащитных препаратов и при разработке новых способов лечения цирроза печени. В настоящее время в экономически развитых странах заболеваемость циррозом печени составляет около 20-40 больных на 100 тыс. населения, и этот показатель неуклонно растет, от данного заболевания погибают около 350 тыс. человек в год. Чаще цирроз развивается при длительной интоксикации алкоголем (по разным данным, от 40 до 80% случаев). Существующие средства и схемы терапии цирроза печени не всегда оказываются эффективными и характеризуются большим количеством противопоказаний и побочных эффектов. Одна из возможных причин подобного состояния дел — отсутствие адекватных экспериментальных моделей цирроза печени. Роль алкоголя как этиологического фактора в развитии цирроза печени общепризнана.
Известен способ инициации токсического поражения печени путем перорального введения 40% этилового спирта в дозе 14 мл/кг в течение 60 суток [Доркина Е.Г. Гепатопротекторные свойства флавоноидов: автореф. дис. … д-ра биол. наук / Е.Г. Доркина. — Волгоград, 2010. — 45 с.].
Недостатком данного способа является длительность введение 40% этанола — 60 сут и более, а также то, что в результате подобного воздействия обычно развивается только токсический гепатит и/или жировой гепатоз, но никак не фиброз и цирроз. В связи с этим, при моделировании алкоголь-индуцированного экспериментального цирроза печени, согласно данным литературы, возникает необходимость усиливать гепатотоксическое повреждающее действие этанола с помощью других гепатотоксикантов и наоборот [Popper Н. Histogenesis of alcoholic fibrosis and cirrhosis in the baboon / H. Popper, C.S. Lieber // Am. J. Pathol. — 1980. — Vol. 98, №3. — P. 695-716].
Известен способ создания модели токсического гепатита и цирроза печени млекопитающих, согласно которому в качестве гепатотоксиканта внутрижелудочно вводят 50% раствор совтола-1 на оливковом масле из расчета 0,25 мл на 100 г массы тела и ежедневно в течение 1 мес вместо воды животным дают для питья 10% раствор этанола (Патент на изобретение RU №2197018, 2003]. Применение в этой модели этанола позволяет добиться развития хронического токсического гепатита, а совтол предназначен для быстрого токсического поражения печени. При сочетании двух компонентов их токсические эффекты суммируются, что в итоге приводит к развитию как токсического гепатита, так и цирроза печени через 4-6 недель после начала введения токсикантов.
Недостатком данного способа моделирования цирроза печени является то, что замена водного питьевого режима алкоголем не является физиологичной, в связи с чем, по данным литературы, около 30% животных отказываются от приема алкоголя [Патент на изобретение RU №2373927, 2007; Филатова Е.В. Влияние социальных условий на формирование предпочтения этанола у крыс / Е.В. Филатова [и др.] // Доклады Академии наук. — 2010. — Т. 430, №4. — С. 35-37].
Известен способ, при котором водный раствор диметилнитрозамина вводят интрагастрально из расчета 50-100 мг/кг массы животного 1 раз в неделю на протяжении 2-3 месяцев, при этом исследование печени обычно проводят через 2 недели после последнего введения. Другим вариантом этого же способа является введение водного раствора диметилнитрозамина интраперитонеально на протяжении 2-3 месяцев каждую неделю три дня подряд с последующим 4-дневным перерывом [Арутюнян И.В. Моделирование цирроза печени на лабораторных животных / И.В. Арутюнян [и др.] // Клиническая и экспериментальная морфология. — 2012. — №2. — С. 45-50].
Недостатком способа является длительность эксперимента.
Известен способ моделирования повреждения печени в эксперименте путем однократного введения крысам N-нитрозодиметиламина внутрибрюшинно в дозах 7 и 15 мг/кг [Томилин Н.В. Экспериментальная оценка генотоксического действия N-нитрозодиметиламина при однократном введении в токсических дозах белым крысам / Н.В. Томилин [и др.] // Актуальные проблемы диагностики, профилактики и лечения профессионально обусловленных заболеваний: Сборник материалов Всероссийской научно-практической конференции, Сочи, 14-15 октября 2013 года. — Сочи, 2013. — С. 423-425].
Однако при действии таких доз N-нитрозодиметиламина при однократном введении фиброз и цирроз печени не развиваются, а эффект повреждения этого органа регистрируется только по цитогенетическим показателям.
При введении диметилнитрозамина в дозах 5,0-7,5 мг/кг в течение 2-3 недель у всех грызунов развивается хронический токсический гепатит, а у значительной части (50-70%) еще и фиброз, но формирования цирроза печени не происходит [Constandinou С. Modelling liver fibrosis in rodents / С. Constandinou, N. Henderson, J.P. Iredale // Methods Mol. Med. — 2005. — Vol. 117. — P. 237-250].
Известен способ моделирования цирроза печени, который представляет собой введение в желудок лабораторного животного два раза в неделю в течение месяца 50%-ного раствора совтола-1 на оливковом масле из расчета 0,25 мл на 100 г массы тела и 10%-ного раствора этанола вместо воды для питья [Патент на изобретение RU №2197018, МПК G09B 23/28, 20.01.2003].
Недостатком известного способа является невысокая степень точности воспроизведения поражения печени в эксперименте.
Техническим результатом разработанного изобретения является повышение воспроизводимости и приближение модели экспериментального цирроза к клиническому течению данной патологии печени у человека.
Технический результат достигается тем, что для получения модели цирроза печени в эксперименте включают дозированное введение этанола крысам, причем этанол вводят внутрижелудочно в течение 3-х недель через день в дозе 3 г/кг и одновременно осуществляют внутрибрюшинное введение 1% раствора диметилнитрозамина (ДМНА) в дозе 5 мг/кг.
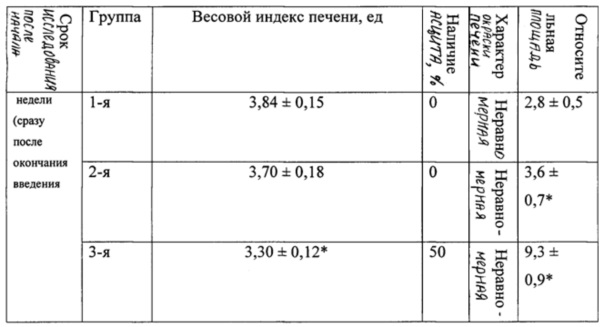
В таблице 1 представлена динамика веса животных в ходе эксперимента.
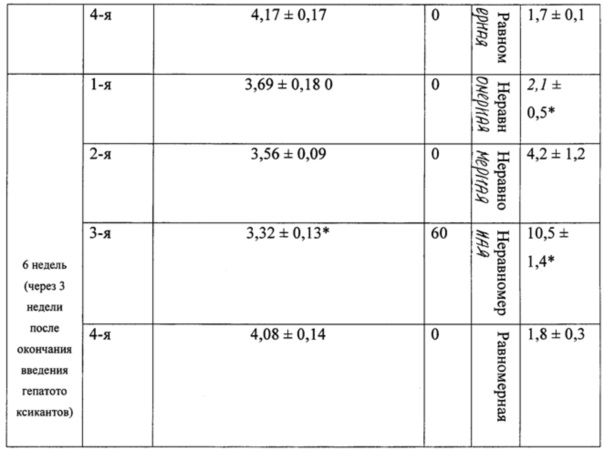
В таблице 2 представлены морфологические показатели у животных при моделировании экспериментального токсического цирроза печени.
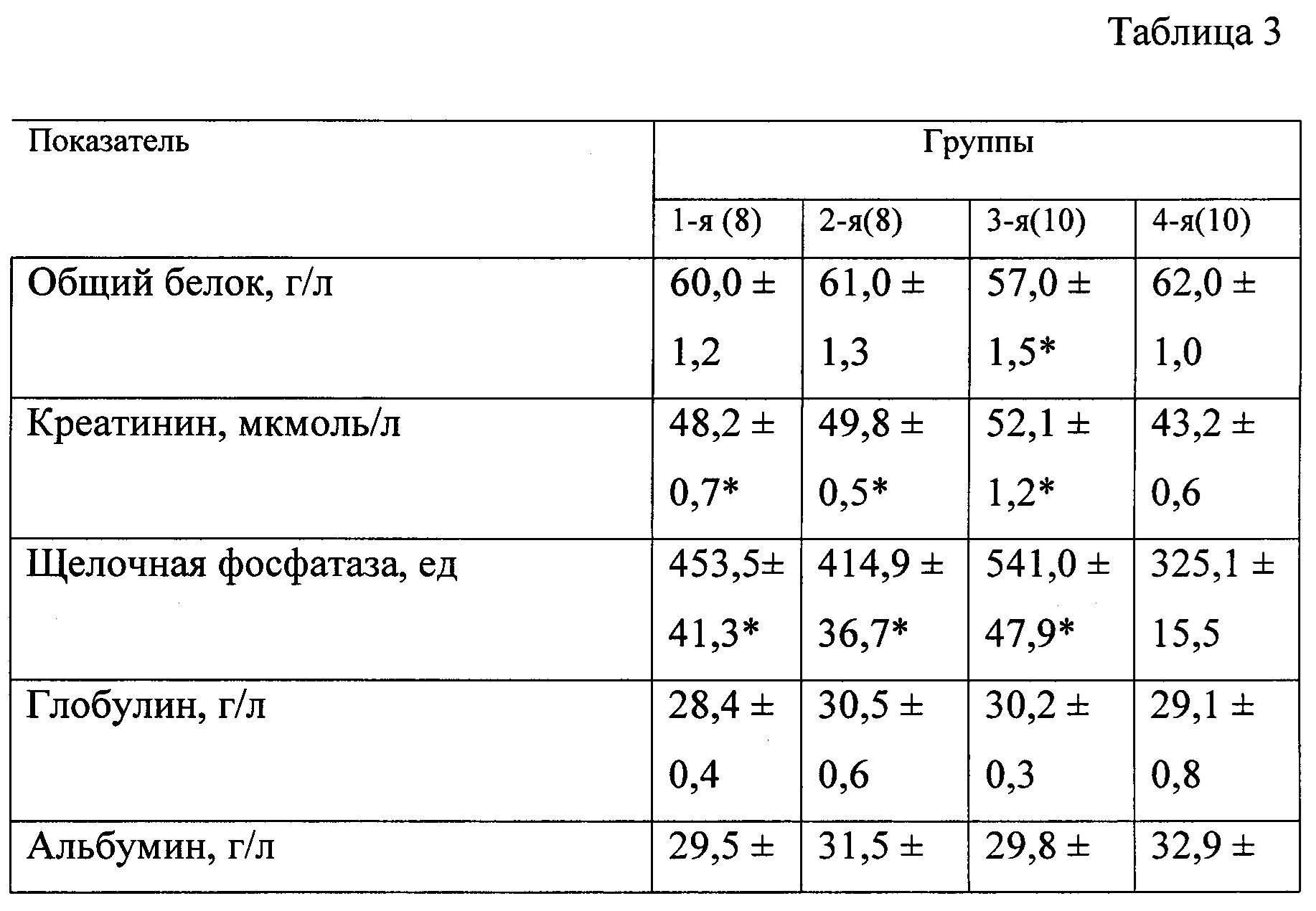
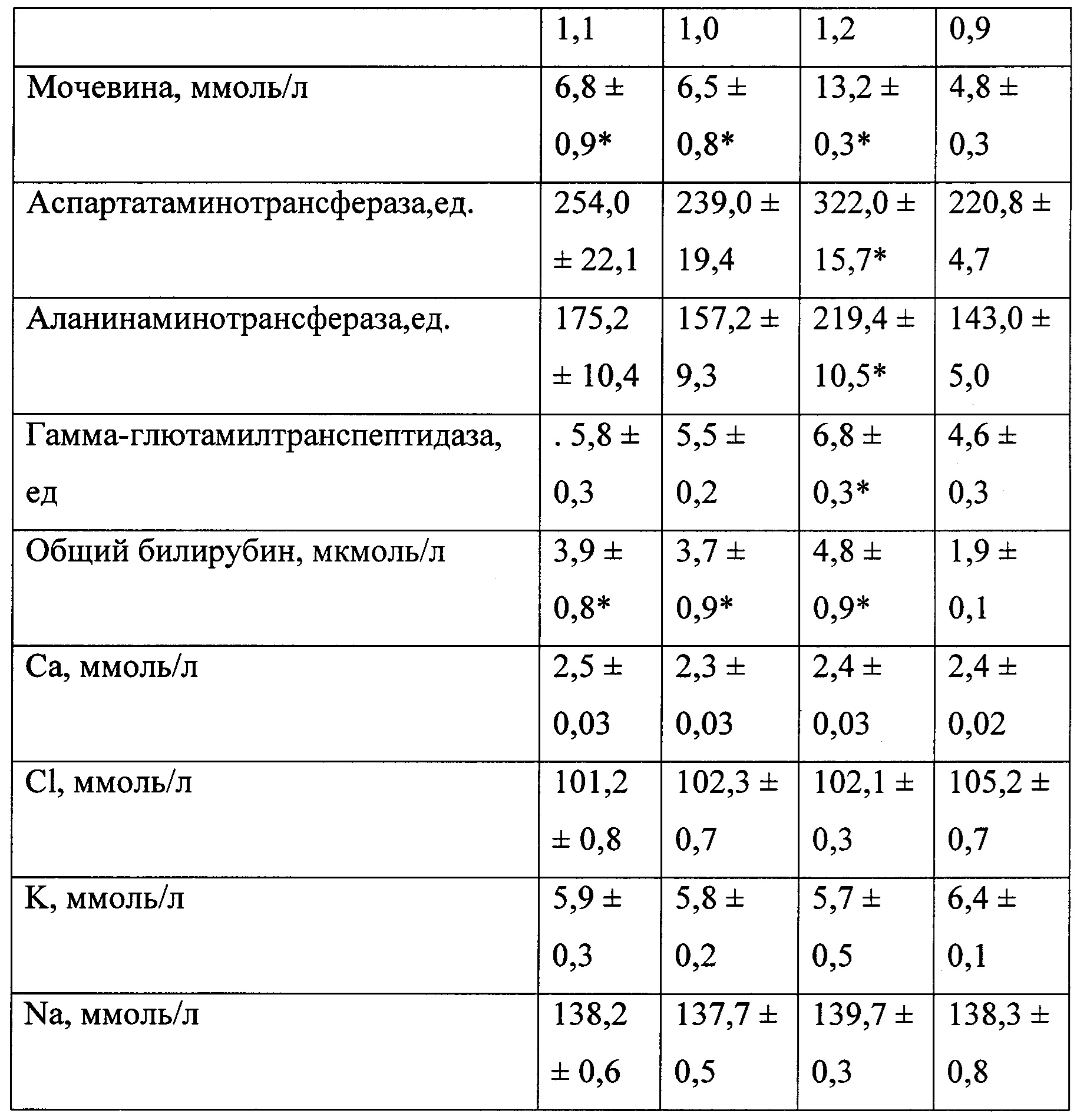
В таблице 3 представлены биохимические показатели у животных при моделировании экспериментального токсического цирроза печени.
Способ осуществляется следующим образом.
Для получения модели цирроза печени экспериментальным животным вводят этанол внутрижелудочно в течение 3-х недель через день в дозе 3 г/кг и одновременно осуществляют внутрибрюшинное введение 1% раствора диметилнитрозамина (ДМНА) в дозе 5 мг/кг.
Для доказательства соответствия заявленного технического решения критериям изобретения был проведен эксперимент на 80 белых беспородных крысах-самцах массой 180-220 г. Животные были разделены на четыре группы:
— 1-я группа (n=20) — внутрижелудочно вводили 40% этанол в дозе 3 г/кг в течение 3-х недель через 1 сут;
— 2-я группа (n=20) — внутрибрюшинно вводили 1% раствор N-нитрозодиметиламина (ДМНА) в дозе 5 мг/кг течение 4-х последовательных суток каждой недели в течение 3-х недель;
— 3-я группа (n=20) — внутрижелудочно вводили 40% этанол в дозе 3 г/кг в течение 3-х недель через 1 сут и одновременно внутрибрюшинно вводили 1% раствор N-нитрозодиметиламина (ДМНА) в дозе 5 мг/кг течение 4-х последовательных суток каждой недели;
— 4-я группа (n=20) — контрольная группа; животным вводили внутрижелудочно по 0,5 мл физиологического раствора через 1 день и внутрибрюшинно по 0,5 мл физиологического раствора в течение 4-х последовательных суток каждой недели в течение 3-х недель.
Наблюдение за лабораторными животными осуществляли в течение 2-х недель до эксперимента (карантин), в ходе 3-недельного внутрижелудочного и внутрибрюшинного введения гепатотоксикантов, а также в течение 3-х недель после окончания их введения. Оценка клинико-лабораторных и морфологических показателей у лабораторных животных опытных и контрольной групп проводилась до эксперимента, через 3 и 6 недель после начала введения гепатотоксикантов (второе исследование было выполнено для уточнения возможности возобновления процессов спонтанного фиброзобразования после отмены гепатотоксикантов).
Животных содержали в стандартных условиях вивария на обычном пищевом рационе, со свободным доступом к воде. Масса тела животных 1-3-й группы перед началом эксперимента была (147,9±5,2) г, 4-й (контрольной) группы — (148,0±6,3) г. Исходные клинико-лабораторные показатели у животных опытных и контрольной групп также не различались.
Наличие и выраженность токсического повреждения печени оценивали путем визуального наблюдения клинической картины интоксикации, изучения биохимических показателей периферической крови и морфологического исследования препаратов печени.
В качестве биохимических показателей, характеризующих основные функции печени, изучали: общий белок, креатинин, мочевину, глюкозу, билирубин, калий, натрий, хлор, кальций, аланинаминотрансферазу, аспартатаминотрансферазу, гамма-глютамилтранспептидазу и индикатор холестаза — щелочную фосфатазу. Оценку биохимических показателей осуществляли с помощью анализатора «Roche Omni С».
Для подтверждения факта развития экспериментального цирроза печени через 1, 2 и 3 недели после начала эксперимента проводили эвтаназию животных (по 5 особей из каждой группы) и осуществляли забор образцов печени с последующим гистологическим исследованием по стандартным методикам. Срезы печени оценивали с использованием исследовательских микроскопов «Polyvar» и «Leica DMRE», цифрового комплекса видеонаблюдения и программы анализа изображений «Видеотест-4». Морфологическую оценку степени повреждения печени проводили по результатам измерения площади, занимаемой соединительной тканью, в пределах 5-7 печеночных долек на 6 срезах печени, окрашенных по ван Гизону [Руководство по проведению доклинических исследований лекарственных средств / под ред. А.Н. Миронова. — М.: Гриф и К., 2012. — 944 с.]. С помощью компьютерной обработки сканированного изображения среза печени рассчитывали относительную площадь, занимаемую в ткани печени сформировавшимся коллагеном.
Значимость межгрупповых различий средних величин параметрических показателей оценивали с помощью t-критерия Стьюдента. В таблицах данные представлены в виде средней арифметической величины и ошибки средней величины (М±m).
Эксперименты показали (табл. 1), что уже к концу 3-й недели комбинированное воздействие этанола и ДМНА сопровождалось значительным ростом (более чем на 30 г по сравнению с фоновыми значениями) массы тела у животных 3-й группы.
При вскрытии через 3 недели после начала эксперимента у 50% животных 3-й группы отмечали наличие развитого асцита с большим количеством (около 6-8 мл) серозной жидкости в брюшной полости (табл. 2). Весовой коэффициент печени у крыс 3-й группы был статистически значимо меньшим, чем у крыс 4-й (контрольной) группы (р<0,05), влажность печени у животных 3-й группы была понижена.
Повышение воспроизводимости в формировании фиброза и цирроза печени достигается за счет потенцирования N-нитрозодиметиламином гепатотоксического эффекта этанола и наоборот. Кроме того, моделирование токсического фиброза и цирроза печени осуществляется в более короткие сроки, а развивающаяся при этом клинико-лабораторная и морфологическая картина поражения в значительной степени приближена к клиническому течению данной патологии печени у человека.
При использовании нашей модели формирование клинико-лабораторной и морфологической картины цирроза печени с развитием выраженного асцита (до 6-8 мл жидкости в брюшной полости) у 50% лабораторных животных начинается уже через 3 недели после начала сочетанного введения двух гепатотоксикантов — N-нитрозодиметиламина и этанола. У оставшихся 50% лабораторных животных в эти же сроки также формируется фиброз и цирроз печени, но в брюшную полость выпотевает до 1-2 мл жидкости. Таким образом, предлагаемая модель позволяет сократить сроки моделирования цирроза печени по сравнению со стандартной длительностью эксперимента в среднем в два раза (с 6 недель до 3 недель), а также повысить точность воспроизведения клинико-лабораторной и морфологической картины токсического фиброза и цирроза печени.
Комбинированное воздействие гепатотоксикантов способствует формированию у крыс экспериментального цирроза печени уже через 3 недели после начала инъекций, что проявляется в увеличении количества соединительной ткани в печени, цирротическом ее перерождении и развитии асцита. При этом, в первую неделю после начала комбинированного воздействия этанола и N-нитрозодиметиламина в ткани печени отмечается центральный геморрагический некроз, затем происходит формирование септ и волокнистой соединительной ткани (2-я неделя), а спустя 3 недели — мелкоузелкового цирроза. Таким образом, разработанная нами модель позволяет проследить последовательное развитие всех морфологических признаков повреждения вплоть до развития цирроза.


Способ моделирования экспериментального цирроза печени, включающий дозированное введение этанола крысам, отличающийся тем, что этанол вводят внутрижелудочно в течение 3-х недель через день в дозе 3 г/кг, одновременно осуществляют внутрибрюшинное введение в течение 4-х последовательных дней каждой недели 1% раствора диметилнитрозамина (ДМНА) в дозе 5 мг/кг.
Источник
Известен
ряд экспериментальных методов,
используемых для изучения функций
печени в физиологических и патологических
условиях.
Наложение
фистулы Экка —
метод, примененный в 1877 г. русским
исследователем Экком в лаборатории
Н.В. Тарханова. Он заключается в следующем:
между нижней полой и воротной венами у
собак создается анастомоз. Воротная
вена выше соустья перевязывается, и вся
кровь, оттекающая из органов брюшной
полости, поступает непосредственно в
нижнюю полую вену, минуя печень (рис.
18-4). Этот эксперимент позволил изучить
обезвреживающую, а также мочевинообразовательную
функции печени.
После
операции Экка у животных уже через 3-4
дня при кормлении мясной пищей или через
10-12 дней при использовании молочно-растительной
диеты появлялись атаксия, манежные
движения, периодически клонические и
тонические судороги. В крови нарастало
содержание аммиака, который в норме
обезвреживается в печени, уменьшался
синтез белков, нарушался обмен холестерина
и образование желчи.
 Рис.
Рис.
18-4. Схема
наложения фистулы Экка и Экка-Павлова
(по К.М. Быкову): А — расположение сосудов
до операции; Б — фистула Экка; В — фистула
Экка-Павлова
Обратная
фистула Экка-Павлова. В
1893 г. И.П. Павлов предложил после наложения
соустья на воротную и нижнюю полую вены
перевязывать выше соустья не воротную,
а нижнюю полую вену. При этом в печень
устремлялась кровь не только из
пищеварительного тракта по воротной
вене, но и из задней половины туловища.
Животные с такой фистулой живут годами.
На этой экспериментальной модели
изучается функциональное состояние
печени в разных условиях пищевой
нагрузки.
Полное
удаление печени. Производится
в два приема. Вначале воспроизводится
обратная фистула Экка-Павлова. Последствием
этой операции является развитие
коллатерального кровообращения. В
результате часть венозной крови из
задней части тела через v. azygos и внутренние
грудные вены отводится в верхнюю полую
вену, минуя печень. Через 3-4 недели после
первой операции проводят вторую: воротная
вена перевязывается и печень удаляется.
В ближайшие часы после удаления печени
у собак появляется мышечная слабость,
адинамия, резко понижается содержание
сахара в крови и при снижении его ниже
2,5 ммоль/л возможно развитие гипогликемической
комы с последующей гибелью животного.
Введением глюкозы можно несколько
продлить жизнь животного. Одновременно
в крови нарастает количество аммиачных
соединений и понижается содержание
мочевины. Собаки после такой операции
живут не более 12-15 ч. Удаление печени
является, по существу, экспериментальной
моделью печеночной комы. После частичного
удаления печени (до 3/4органа) очень резких нарушений обмена
не происходит ввиду того, что оставшаяся
часть печени сохраняет свои функции и
реализует компенсаторные возможности.
При
изучении функциональной роли печени в
норме и при патологии применяется также
ангиостомический
метод Е.С. Лондона, предложенный
в 1919 г. К стенкам крупных кровеносных
сосудов (воротная и печеночная вены)
пришиваются металлические канюли
(нержавеющие или серебряные), свободные
концы которых выводятся через покровы
брюшной стенки наружу. Канюли позволяют
систематически брать кровь из сосудов
и вводить в них различные вещества.
Метод ангиостомии дал много ценного
при изучении роли печени в
билирубинообразовании, углеводном,
белковом, жировом и солевом обменах.
Экспериментальной
моделью является и метод
перфузии изолированной печени. Донорами
печени являются преимущественно
лабораторные животные: крысы, кролики,
кошки. В настоящее время для этих целей
используется и печень крупных животных:
собак, свиней и телят. Эта экспериментальная
модель применима для изучения роли
печени в процессах метаболизма, а также
в решении вопросов трансплантации
органа.
Для
экспериментального воспроизведения
заболеваний печени пользуются введением
в организм инфекционных и токсических
агентов. Сильным
гепатотропным ядом является CCl4
(четыреххлористый углерод). Парентеральное
введение 0,2 мл/100 г 80% масляного раствора
этого вещества вызывает альтерацию и
некробиоз гепатоцитов в центральных
зонах печеночных долек. Для указанных
целей используют также хлороформ, семена
гелиотропа. Жировой гепатит воспроизводится
путем введения сернокислого гидразина
и алкоголя. Токсическое действие алкоголя
на печень выражается в сосудистых
расстройствах и очаговых
дистрофическидеструктивных изменениях
паренхимы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник

