Перекисное окисление липидов при гепатите
ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ И АНТИОКСИДАНТНАЯ ЗАЩИТА У БОЛЬНЫХ ХРОНИЧЕСКИМ ВИРУСНЫМ ГЕПАТИТОМ С
- Авторы
- Файлы
Плахтий Л.Я.
Нагоев Б.С.
Отараева Б.И.
Тадеева А.К.
Цховребов А.Ч.
Актуальность проблемы вирусных гепатитов, особенно хронических гепатитов В и С, является серьезной проблемой современного здравоохранения. По данным ВОЗ в настоящее время в мире насчитывается более 170 млн. больных хроническим вирусным гепатитом, а количество инфицированных HCV достигает 500 млн. человек [1-3].
Особенность гепатита С — это способность к длительному персистированию в организме, обусловливающая высокий хронический потенциал. Важным механизмом персистирования вируса является изменчивость с образованием мутантных штаммов, ускользающих из-под иммунного процесса. В связи с особенностями персистенции вирусных частиц в сыворотке крови наблюдается накопление продуктов перекисного окисления липидов (ПОЛ) различной степени с образованием активных форм кислорода (АФК) на фоне снижения активности антиоксидантной защиты (АОЗ).
Оксидантно-антиоксидантный баланс клеток напрямую взаимосвязан с системой перекисного окисления липидов (ПОЛ). При хронических вирусных гепатитах происходит активация процессов ПОЛ и дисбаланс некоторых неферментных систем антиоксидантной защиты сыворотки крови [1, 3]. Антиоксидантная система предназначена для инактивации негативного воздействия продуктов ПОЛ на клетки и ткани. Учитывая патогенетическую значимость дисбаланса оксидантной и антиоксидантной систем в обеспечении общего гомеостаза организма, при прогрессировании различных заболеваний необходимо своевременно диагностировать проявления окислительного стресса. Для адекватной клинической интерпретации получаемых при исследовании состояния систем антиоксидантной защиты результатов немаловажное значение имеют показатели состояния антиоксидантнои системы.
Целью исследования явилось изучение показателей прооксидантной системы и антиоксидантной защиты у больных с HСV-инфекцией, в зависимости от периода заболевания и тяжести патологического процесса.
Материал и методы: состояние прооксидантной системы организма оценивали по МДА, который является одним из конечных продуктов и показателем активности процессов перекисного окисления липидов в сыворотке крови по реакции с тиобарбитуровой кислотой.. Антиоксидантный статус оценивали исследуя активность каталазы.
Под наблюдением находилось 31 больной с хроническим вирусным гепатитом С.
Было сформировано 3 группы пациентов: 1-ю составили больные HСV-ХГ с минимальной активностью процесса, 2-ю больные HСV- ХГ с умеренной выраженной активностью, 3-ю больные HСV- ХГ с выраженной активностью. Условно здоровые люди составили 40 человек (18,3±3,1 год).
Результаты и обсуждение
В динамике заболевания наблюдалось повышение уровня малонового диальдегида у всей группы обследованных с максимальным значением на высоте клинических проявлений, т.е. в периоде разгара заболевания. Во втором периоде параллельно положительной динамике, средний показатель МДА превышал таковой в контрольной группе, хотя был достоверно ниже, чем в периоде разгара. В период ранней реконвалесценции у больных с легкой формой, отмечено снижение показателей до нормы. За аналогичный период у групп больных со средней и тяжелой формами наблюдалась тенденция к снижению, но не до уровня контрольных цифр (табл. 1).
Таблица 1.
Показатели малонового диальдегида у больных вирусным гепатитом С
в зависимости от тяжести заболевания
Тяжесть заболевания | n | Период болезни | М± m | Р |
Здоровые | 41 | 41,35±0,72 | ||
Легкая форма | 12 | I | 62,81±2,89 | |
12 | II | 51,51±2,63 | р<0,005 | |
12 | III | 41,78±3,25 | р<0,001 | |
Среднетяжелая форма | 8 | I | 63,17±4,20 | |
8 | II | 53,77±2,03 | р<0,05 | |
8 | III | 45,56±3,16 | р<0,005 | |
Тяжелая форма | 11 | I | 61,54±6,84 | |
11 | II | 58,86±1,44 | р>0,005 | |
11 | III | 46,20±4,23 | р<0,05 |
ПРИМЕЧАНИЕ: здесь и далее — периоды болезни соответствуют:
I-разгару болезни, II — периоду угасания заболевания, III- периоду ранней реконвалесценции.
В результате проведенных исследований у больных хроническим вирусным гепатитом С наблюдалось существенное угнетение активности каталазы в периоде разгара, степень которой зависело от степени тяжести заболевания больных. В периоде угасания клинических симптомов, параллельно улучшению общего состояния больных происходило существенное возрастание активности фермента, однако, нормализация показателей каталазы наступила лишь в период ранней реконвалесценции (табл. 2).
Таким образом, в процессе заболевания хроническим вирусным гепатитом С наблюдается закономерное повышение содержания малонового диальдегида в плазме крови, и снижение уровня каталазы. Обнаруженное повышение активности процессов ПОЛ зависело от периода заболевания, клинического течения, степени тяжести патологического процесса, наличии сопутствующих заболеваний и осложнений. При легкой форме хронического вирусного гепатита С происходит повышение активности антиоксидантной системы, при среднетяжелой и тяжелой — на фоне высокого уровня продуктов ПОЛ наблюдается дефицит антиоксидантной защиты организма. Наблюдаемое увеличение содержания каталазы эритроцитов имеет компенсаторное значение и зависит от тяжести заболевания и от степени активизации процессов ПОЛ. Выявлена тесная корреляция между накоплением продуктов перекисного окисления липидов в тканях жизненно важных органов, плазме, эритроцитах, что позволяет использовать полученные данные для суждения об интенсивности перекисного окисления в организме больных, а также прослеживается увеличение значения каталазы к периоду реконвалесценции, приближаясь к нормальным показателям, по сравнению со значениями малонового диальдегида в этом же периоде, которые имели тенденцию к постепенному снижению.
Таблица 2.
Показатели каталазы в эритроцитах больных вирусным гепатитом С
в зависимости от тяжести заболевания
Тяжесть заболевания | n | Период болезни | М± m | Р |
Здоровые | 36 | 16,49±0,33 | ||
Легкая форма | 12 | I | 13,73±0,96 | |
12 | II | 14,91±1,49 | р>0,05 | |
12 | III | 16,15±0,84 | р<0,05 | |
Среднетяжелая форма | 8 | I | 12,51±0,74 | |
8 | II | 14,87±1,87 | р<0,05 | |
8 | III | 16,06±1,80 | р<0,05 | |
Тяжелая форма | 11 | I | 9,97±0,44 | |
11 | II | 13,17±1,07 | р<0,005 | |
11 | III | 15,80±0,94 | р<0,001 |
СПИСОК ЛИТЕРАТУРЫ
- Антонова Т.В., Николаенко С.А.. Лиознов Д.А. Клиническая лабораторная диагностика. — 1999. — №7.- С.23-24.
- Бурлаков Е.Б. Свободнорадикальное окисление в норме и патологии. М., 1976. — С. 18-19.
- Нагоев Б.С., Иванова М.Р. Вирусные гепатит С.-Нальчик, 2002.
- Шальгильдян И.В., Михайлов М.И., Онищенко Г.Г. Парентеральные вирусные гепатиты (эпидемиология, диагностика, профилактика), — М., 2003.
Библиографическая ссылка
Плахтий Л.Я., Нагоев Б.С., Отараева Б.И., Тадеева А.К., Цховребов А.Ч. ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ И АНТИОКСИДАНТНАЯ ЗАЩИТА У БОЛЬНЫХ ХРОНИЧЕСКИМ ВИРУСНЫМ ГЕПАТИТОМ С // Успехи современного естествознания. – 2010. – № 9. – С. 141-143;
URL: https://natural-sciences.ru/ru/article/view?id=8845 (дата обращения: 27.03.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
УЧАСТИЕ СИСТЕМЫ ГЛУТАТИОНА И ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ В ПАТОГЕНЕЗЕ ХРОНИЧЕСКИХ ПОРАЖЕНИЙ ПЕЧЕНИ
Киселёв Дмитрий Олегович
студент 4 курса, каф. Химии и биохимии, каф. Факультетской терапии
Иркутский Государственный Медицинский Университет, г. Иркутск
E—mail: Rancevich89@mail.ru
Колесниченко Лариса Станиславовна
научный руководитель, д.м.н., профессор, кафедра Химии и биохимии
Иркутский Государственный Медицинский Университет, г. Иркутск
Променашева Татьяна Евгеньевна
научный руководитель, аспирант, кафедра Факультетской терапии
Иркутский Государственный Медицинский Университет, г. Иркутск
Печень[ 3, c. 102-122] – самая крупная железа в организме человека, с массой до полутора килограмм. Это не просто орган исключительной значимости в процессах обмена веществ [1, c. 318, 322, 393, 395, 400, 406, 408, 439, 444], энергетического обмена, метаболизма ксенобиотиков [1 c. 616-617] и лекарственных средств, но и орган системного значения, крупнейший экспортёр, формирующий, наряду с некоторыми другими клетками и тканями, белковый состав плазмы крови (альбуминовые и глобулиновые фракции, транспортные белки, плазменные пептидазы, компоненты системы гемостаза и калликреин-кининовой системы). В печени осуществляется синтез 80% эндогенного холестерина – (источника стероидных гормонов и кальцитриола), липопротеидов, фосфо и гликолипидов). Таким образом, функция печени определяется совокупностью как катаболических, так и анаболических процессов.
Модифицированные макрофаги печени – клетки Купфера, принимают участие в синтезе желчных кислот, определяющих судьбу гидрофобных соединений в организме (всасывание жирорастворимых витаминов, жирных кислот, выведение холестерина).
Через печень осуществляется метаболизм гемоглобина, названный пигментным обменом.
В печени депонируется до 20% объёма циркулирующей крови. Альбумин, синтезируемый в печени, формирует онкотическое давление крови, что в свою очередь чрезвычайно важно в регуляции общей гемодинамики.
Отдельного внимания заслуживает эмбриональная печень.
Содержание работы:
Многообразие физиологических явлений отражается многообразием патологических процессов, которые, так или иначе, затрагивают печёночную ткань.
В работе затронуты распространённые явления изменения показателей окислительно-восстановительного гомеостаза, получающие своё выражение через активацию свободнорадикального окисления, перекисного окисления липидов (ПОЛ), сопровождающего хронические воспаления. [2]
Роль ПОЛ в повреждении биомембран показана для инфаркта миокарда, панкреатита, хронических поражений лёгких, почек, гастритов. Немало наблюдений собрано и в условиях хронических поражений печени. [4], [5], [6], [8].
Образование свободных радикалов – важный механизм повреждения клеток. Свободнорадикальные формы кислорода образуются при стимуляции клеток Купфера и секвестрации полиморфно-ядерных нейтрофилов. При истощении резервов макроэргов или окислительном стрессе ксантиноксидаза, циклооксигеназа и липоксигеназа способны генерировать супероксидный радикал и синглетный кислород в процессе биосинтеза простаноидов и лейкотриенов (производных арахидоновой кислоты). Супероксидный радикал может образовываться в митохондриях, микросомах и пероксисомах. До 2% потреблённого кислорода в митохондриях посредством коэнзима Qи НАДН-коэнзим Q- редуктазного комплекса может превращаться в супероксидный радикал. Продукция последнего возрастает в митохондриях при нарушении цепи переноса электронов. С помощью супероксиддисмутазы он быстро превращается в перекись водорода. Образующийся гидроксильный радикал способен повреждать нуклеотиды, аминокислоты и липиды. При атаке гидроксильным радикалом ненасыщенных жирных кислот фосфолипидов мембран возникает цепная реакция ПОЛ. Гидроксильный радикал способен, также, повреждать ультраструктуру ДНК, что в ряде случаев при хроническом воспалении приводит к канцерогенезу.
Антиоксидантные системы призваны предотвратить эти драматические последствия и лимитировать эффекты окислительного стресса. Перекись водорода инактивируется ферментами глутатионпероксидазой (ГПО) и каталазой, супероксидный радикал – супероксиддисмутазой. Прочие активные формы кислорода элиминируются ГПО и глутатионтрансферазой (ГТ).
Эти ферменты определяют устойчивость гепатоцитов к действию свободных радикалов. Гибель клеток при окислительном стрессе не обязательна, но повышение чувствительности к другим повреждающим агентам несомненно присутствует. [7, c. 40-41]
Биохимические исследования зачастую позволяют составить общую картину патологического процесса с точки зрения всего организма, а не повреждённого органа. Наиболее практично наблюдать за изменениями системы крови, потому как, показатели крови, по принципам гомеостаза изменяются только когда исчерпаны компенсаторные возможности тканей.
Так, для оценки свободного перекисного окисления липидов используют методики определения продуктов реакции (малонового альдегида и других молекул, образующих стойкие соединения, определяемые в длинноволновой (красной) области спектра, ТБК-активные соединения). В данной работе определялся уровень малонового альдегида (МДА) по методу Стокса в модификации Волчегорского в плазме крови.
Безусловно, для оценки функционального состояния печени и изменении системы крови целесообразно определение показателей также в форменных элементах – эритроцитах. Поэтому, активность ферментов системы глутатитона определяли в плазме крови и эритроцитах.
В работе использованы методики определения активности глутатионредуктазы (Mannervik B. et al) и глутатионтрансферазы (Habigetal).
Также определяли содержание восстановленного глутатиона (GSH) в плазме крови и эритроцитах по методу Андерсона.
Все обозначенные методики относятся к стандартным спектрофотометрическим методам. Содержание общего белка в пробе определяли по методу Лоури. Результаты обработаны с применением математической статистики (по Стьюденту), представлены только значимые различия с группой контроля.
Эксперимент проводился в рамках клинического ведения больных с хроническими заболеваниями печени на базе факультетских клиник Иркутского Государственного Медицинского Университета (ИГМУ). Для сравнительного исследования была подобрана группа контроля из практически здоровых людей.
Результаты:
Изменения показателей системы крови коснулись в основном форменных элементов. В эритроцитах было отмечено снижение активности глутатионредуктазы на 15,5%, а также снижение активности глутатионтрансферазы на 78,7%. Содержание восстановленного глутатиона увеличилось на 36,1%.
Со стороны плазмы крови значимых изменений активности ферментов обнаружено не было. Наблюдалось снижение содержания восстановленного глутатиона на 20,5%. Содержание малонового альдегида в плазме крови не составило различий с контролем.
Заключение:
Увеличения содержание малонового альдегида в плазме крове не обнаружено, поэтому первоначальная гипотеза об активации ПОЛ не находит своего подтверждения на данном этапе исследования.
Снижение активности глутатионтрансферазы, может указывать на нарушение детоксикационной функции печени, так как активность этого фермента в эритроцитах отражает процессы происходящие в самих гепатоцитах. [9].
Резкое снижение активности глутатионтрансферазы может быть причиной увеличения восстановленного глутатиона, который в этих условиях используется неэффективно (мало). [10]
Увеличение содержания восстановленного глутатиона в клетках в свою очередь обуславливает снижение активности глутатионредуктазы по принципу отрицательной обратной связи, так как функция этого фермента – восстановление глутатиона из окисленной формы. [10]
Список литературы:
- Биохимия: учебник для вузов/под ред. Е.С.Северина – 5 изд., — М.: ГЭОТАР-Медиа, 2009. – 768с.
- Заболевания печени и жёлчных путей/Ш. Шерлок., Дж. Дули, — М.: ГЭОТАР Медицина, 1999. – 864с.
- Клиническая биохимия/В. Дж. Маршалл, С.К. Бангерт, — 6 изд., перераб. и доп./Пер. с англ. – М. – СПб.: БИНОМ-Диалект, 2011. – 408с.
- Российский журнал Гастроэнтерологии, Гепатологии и Колопроктологии. – научно-практический журнал. – М.: М-Вести. – 2001. — №4.
- Хронический панкреатит/ И. В. Маев, А.Н. Казюлин, Ю.А. Кучерявый, — М.: Медицина, 2005. – 502с.
- Хронические гепатиты и циррозы печени/А. С. Логинов, Ю.Е. Блок, — М.: Медицина, 1987. – 272с.
- Ф. Х. Мансурова, Х. Ш. Мутихова, С. О. Олимова Перекисное окисление липидов и антиоксидантная защита у больных с хроническим гепатитом С/Клиническая медицина. – 2005. — №5. – с. 39-42.
- Э.И. Белобородова Метаболические аспекты прогнозирования исходов хронического вирусного гепатита/Клиническая медицина. – 2005. — №2. – с. 53-57.
- Baneriee R., Becker D., Dickman M. et al./Redox biochemistry. – New Jersy: John Wiley SV Sons, 2008 – 318p.
- Lu S.C. /Regulation of glutathione synthesis/ Mol. Aspects. Med. — 2009. vol. 30, n. 1-2, p. 42-59.
Источник
Поступая в организм различными путями, пестициды накапливаются в тканях человека и животных, оказывая на них токсическое действие. При интоксикации пестицидами поражаются все ткани и органы, но в наибольшей степени их влиянию подвержена печень. Клетки этого органа, активно участвуя в метаболизме ксенобиотиков, становится основной мишенью этих препаратов. Из клеточных органелл в большей степени подвержены действию этих соединений митохондрии и микросомы. Учитывая важную роль этих органелл, можно полагать, что повреждение их мембран, имеет важное значение в общей цепи повреждения клетки и организма в целом.
В результате многочисленных исследований последнего десятилетия сложились представления о том, что строение и функции биологических мембран теснейшим образом связаны с процессом перекисного окисления липидов (ПОЛ), составляющих структурную основу бислоя. Установлено, что многие деструктивные процессы сопряжены с механизмами окислительных превращений липидов [9]. Нарушения процесса ПОЛ и его регуляцию рассматривают в настоящее время в качестве патогенетического маркера целого ряда заболеваний [2-5].
Таким образом, изучение состояния дыхательной цепи при токсическом гепатите является актуальной проблемой. Вместе с тем на наш взгляд важно изучить состояние дыхательной цепи митохондрий в ранний период развития патологии, когда компенсаторные механизмы клетки активированы в ответ на повреждающее воздействие токсических веществ. Такие данные могут помочь в разработке адекватной тактики лечения токсического гепатита.
Патологические процессы, развивающиеся в печени при токсическом гепатите, как вследствие непосредственного воздействия токсинов, так и в результате нарушения механизма их детоксикации, приводят к окислительному стрессу [8,10,11]. Окислительный стресс приводит к повышению внутриклеточной генерации активных форм кислорода (АФК) и окислительному повреждению молекулярных компонентов клетки [1].
Хроническая интоксикация крыс этанолом и Сcl4 в течение месяца приводит к развитию гепатита, фиброза и жировой дистрофии ткани печени, усилению процессов перекисного окисления липидов, а также гипертрофия гепатоцитов. Активность антиоксидантной системы митохондрий гепатоцитов при токсическом гепатите снижена [7].
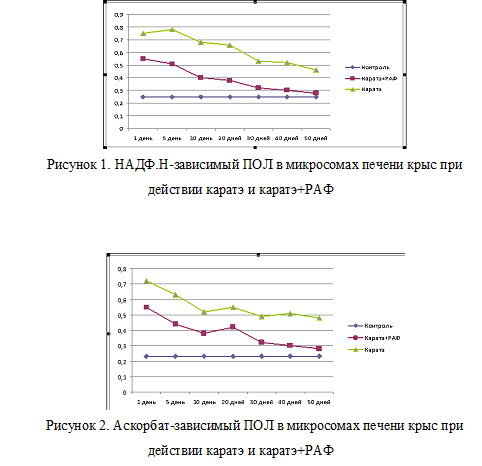
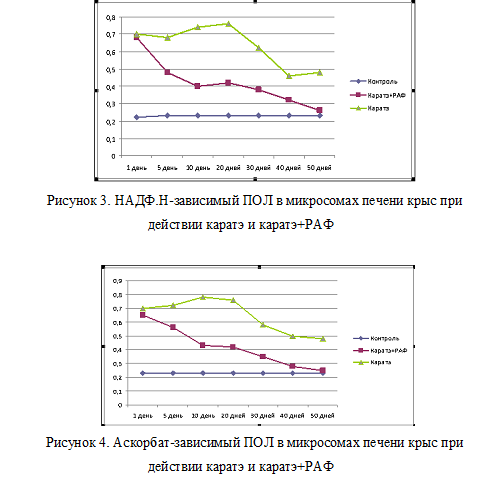
Нами было изучено влияние пиретроида каратэ на ПОЛ в митохондриях и микросомах гепатоцитов крыс и изменение этих показателей под действием растительного антиоксидантного фактора РАФ, введенного через 30 мин после проведения затравки.
Активность аскорбат-зависимого и НАДФ.Н-зависимого перекисного окисления липидов в микросомах и митохондриях определяли по содержанию малонового диальдегида (МДА). Интенсивность процессов ПОЛ выражали в мкмоль/мин/мг белка соответствующей фракции.
Исследования проводились на трех группах крыс: 1-я группа- отравленные пестицидом крысы; 2-я- отравленные крыс, которым спустя 30 мин после затравки перорально вводили 1 мл РАФ; 3-я группа- контрольная, включала в себя интактных крыс.
Растительный антиоксидантный фактор также вводился в течение 3-х дней после затравки пестицидом перорально крысам 2-ой группы.
Исследования проводились на 1, -5, -10, -20, -30, -40, -50-й дни после однократного введения пиретроида каратэ и однократного введения пиретроида каратэ с последующим введением РАФ.
Установлено, что на 1-й день после затравки пиретроидом каратэ НАДФ.Н- зависимый и аскорбат-зависимый ПОЛ в микросомальной фракции возрастает на 213 и 203 % от контроля (рис. 1,2). Содержание продуктов ПОЛ в митохондриальной фракции резко увеличивается соответственно на 197 и 199% от контроля (рис. 3,4). У крыс 2-й группы, т. е. защищенных РАФом, также увеличен показатель ПОЛ, однако значительно меньше 1-й группы: на 134 и 130%- в микросомах, 176 и 178%- в митохондриях относительно контроля.
На 5-й день отравления наблюдается такой же высокий уровень НАДФ.Н- зависимого и аскорбат- зависимого ПОЛ, который состовляет: 233 и 10%- в микросомах, 171 и 216% в митохондриях у крыс 1-й группы; 124 и 93% — в микросомах, 94 и 145% в митохондриях 2-й группы отностельно контороля соответственно.
Высокое содержание ферментативного ПОЛ в микросомах гепатоцитов, можно объяснить тем, что при НАДФ.Н-зависимом ПОЛ субстратом в микросомах являются полиненасыщенные жирные кислоты- ацилы фосфолипидов, локализованные вблизи компонентов цепи переноса электронов, а при аскорбат-зависимом – другие жирные кислоты.
На 10-20-е дни наблюдается повышение количества содержания МДА в митохондриях на 218, 255 и 213, 233%, в микросомах на 201, 195,128, 136% от контроля соответственно.
На 1-й день после отравления у крыс, защищенных РАФ, наблюдается наименее выраженный процесс ПОЛ, чем у опытных крыс 1-й группы. Уже на 5-е сутки прослеживается резкое уменьшение содержание продуктов процесса ПОЛ в митохондриях, в случае с микросомами нормализация процесса ПОЛ проходит еще интенсивнее. По видимому, это связано с тем, что микросомы являются основными компонентами клеток, которые активно участвуют в выведении токсических веществ.
Начиная с 5-х суток, у животных, защищенных РАФом наблюдается ярко выраженная тенденция к снижению содержание продуктов ПОЛ, вплоть до снижения показателей ПОЛ до норме.
О возможности коррекции патологических процессов ПОЛ, говорится и в исследованиях К.А. Тулаганова и Т.С. Саатова, где изучено влияние арахиса, как антиоксиданта, на состав спермальной жидкости мужчин[5].
Употребление арахиса приводило к снижению в 2.2 раза по сравнению с контролем продуктов ПОЛ спермальной жидкости и повышало активность ферментов антиоксидантной системы.
Таким образом, полученные нами результаты дают возможность говорить о токсическом влиянии пестицида каратэ, обусловленном изменениями липидного состава мембранных структур, что в свою очередь служит одной из причин нарушения мембранных функций. Использованный в процессах исследований в качестве антиоксиданта РАФ, дал положительный эффект, заметно снизив уровень продуктов ПОЛ у отравленных пестицидом крыс. В результате исследований мы пришли к выводу, что РАФ корректирует токсическое действие пестицида каратэ, уменьшая изменения структуры митохондрий и микросом, снижению продуктов перекисного окисления липидов. Это позволяет использовать РАФ, при остром отравлении пестицидом каратэ, коррекции его токсического влияния на организм, в частности на мембраны гепатоцитов, митохондрии и микросомы клеток печени.
ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
1.Андреев и др Биохимия 2005 с. 246 — 264
2.Баглей Е.А. Свободнорадикальное окисление в норме и патологии//Материалы симпозиума. М.,1976. С-65
3.Бондаренко В.А. ПОЛ в мембранах митохондрий под влиянием низких температур. Дис. канд. биол. наук. Харьков, 1981.
4.Гвозденко Е.С., Внуков В.В. Влияние пестицидов нового поколения на состояние глутатионовой системы у рыб.// Известия ВУЗов. Северо-кавказский регион. №12 2006. – с. 55-59.
5.Зайцев В.Г. Модельные системы перекисного окисления липидов и их применение для оценки антиоксидантного действия лекарственных препаратов: Дис. канд. биолог. наук : Волгоргад : 2001- 139 с.
6.Левина И.Л., Москвичев Д.В., Щербакова Н.И., Гвозденко Е.С. Особенности биохимической адаптации брюхоногих моллюсков к воздействию пестицидов новых поколений. // В сбор. Современные проблемы физиологии и биохимии водных организмов. – Петрозаводск 2004 — С. 80-81.
7.Ширяева, Анна Петровна Функциональное состояние дыхательной цепи митохондрий гепатоцитов крыс при экспериментальном токсическом гепатите: Дис. канд. биолог. наук : Санкт-Петербург, 2008. — 112 с
8.Esrcfoglu at al 2007 Exp Toxicol Pathol 58(5) P. 367 — 374
9.Moskvichov D.V., Levina I.L., Gvozdenko E.S. Lipid peroxidation and activity of antioxidant enzymes in tadpole of clawed frog under the action of diazole pesticides.// Reactive oxygen and nitrogen species, antioxidants and human health. – Smolensk, Russia, 2003 – P. 194-195.
10.Noyan el al 2006 Cell Biol Toxicol 22(6) P. 381-391
11.Raja at al 2007 J Ethnophamiacol 109(1) P. 41-47
ДЕЙСТВИЕ ПЕСТИЦИДОВ НА ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ В МИТОХОНДРИЯХ И МИКРОСОМАХ ГЕПАТОЦИТОВ КРЫС
Written by: Мирхамидова П., Исабекова М.А., Сейдалиева Л.Т.
Published by: БАСАРАНОВИЧ ЕКАТЕРИНА
Date Published: 05/05/2017
Edition: ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 28.02.2015_02(11)
Источник


