Размер частицы вируса гепатита с
Вирус гепатита С (анг. HCV, Hepatitis C Virus) – вирус-возбудитель гепатита С у человека и шимпанзе. РНК-содержащий вирус, относящийся к семейству Flaviviridae (род hepacivirus; в этот же род входят вирусы, вызывающие гепатит С-подобные заболевания у собак и лошадей[1][2]). Открыт в 1989 г. методом клонирования ДНК-копии вируса, вызывавшего парентеральный гепатит “ни А ни В” у инфицированных шимпанзе. Это первый вирус, идентифицированный на основании расшифровки последовательности нуклеотидов задолго до его электронно-микроскопической визуализации[3][4]. Согласно классификации вирусов по Балтимору относится к классу IV.
Строение[править | править код]
Геном[править | править код]
Геном вируса представлен однонитевой линейной (+)РНК размером около 9400 нуклеотидов, которая способна выполнять функцию как мРНК, так и служить матрицей для синтеза дочерних копий вирусного генома. В геноме содержится всего один ген, который кодирует 9 различных белков. Изначально РНК вируса гепатита С транслируется с образованием полипептида длиной около 3000 аминокислот. В геноме вируса содержится два некодирующих региона и одна большая открытая рамка считывания, кодирующая структурные и неструктурные белки. Гены, кодирующие структурные белки, расположены в области 5′-конца цепочки РНК, а неструктурные – в области 3′-конца. К структурным белкам относятся core, Е1 и Е2 белки. Сore-белок является белком нуклеокапсида, он обладает РНК-связывающей активностью, модулирует транскрипцию и трансляцию некоторых клеточных генов и обладает онкогенным потенциалом. Именно с core-белком связывают выраженность прямого цитопатического эффекта вируса гепатита С. Е1 и Е2 белки — гликопротеины внешней оболочки вируса высоковариабельны, а их С-концевые части гидрофобны и могут принимать участие во взаимодействии с клеточной мембраной. В структурной зоне кодируется также пептид р7, играющий важную роль в высвобождении вириона из инфицированной клетки. Неструктурная область вирусного генома кодирует 6 белков — NS2, NS3, NS4A, NS4B, NS5A и NS5B. Функции NS2 и NS4 предположительно связывают с клеточной мембраной. Кроме того, белок NS2 является вирусной цинк-зависимой протеиназой и вместе с клеточными пептидазами участвует в аутокаталитическом нарезании самого себя из вирусного полипротеина. Белок NS3 — это вирусная протеиназа, играющая важную роль в процессинге вирусных белков. Белок NS4A действует как эффектор или кофактор для NS3, он регулирует фосфорилирование белка NS5A, который обладает функцией репликазы. Имеется ряд доказательств, что от NS5A зависит резистентность к IFN-α, так как в нем выделен регион, участвующий в ингибировании индуцируемой IFN-α протеинкиназы. Белок NS5B является вирусной РНК-зависимой РНК-полимеразой. Согласно современным представлениям, в инфицированной клетке белки NS4A, NS4B, NS5A и NS5B вместе с белком NS3 ассоциируются в некую структуру, которая играет важную роль в вирусной репликации. Высокая консервативность 5′- и 3′- некодирующих регионов и их важная роль в репликации вируса делают их перспективными мишенями для разработки средств лечения и профилактики вирусного гепатита С.
Одной из важнейших особенностей генома HCV является его выраженная гетерогенность, обусловленная высоким уровнем репродукции и частотой возникновения ошибок при репликации. Скорость продукции вирусных частиц достигает 1011-1012 в сутки с периодом полужизни вирусных частиц от 2,2 до 7,2 ч. (в среднем около 3 ч.). Оценочно каждый заражённый гепатоцит ежесуточно продуцирует около 50 вирионов. Подверженность мутациям отдельных участков генома различна (наиболее вариабельными являются области, кодирующие гликопротеины внешней оболочки Е2 и Е1). Подобная мультивариантность HCV приводит к постоянному состязанию между образованием новых антигенных вариантов и продукцией нейтрализующих антител, что обеспечивает «ускользание» из-под иммунологического надзора, а также формирование резистентности к противовирусным препаратам и длительную многолетнюю хроническую персистенцию HCV в организме.
Структурно-функциональная организация генома вируса гепатита С
Считается, что генетический материал HCV не способен интегрироваться в геном инфицированных клеток[3][4][5].
Структура вириона[править | править код]
Размер вирионов составляет 30-50 нм.
В крови около 75% вирусных частиц ассоциированы с липопротеинами низкой и очень низкой плотности. Синтез липопротеинов происходит в эндоплазматическом ретикулюме (ЭПР) гепатоцитов, где они, предположительно, взаимодействуют с белковолипидной оболочкой HCV, образуя комплекс (т.н. липовирусные частицы). В составе такого комплекса вирусные частицы защищены от воздействия антител и, за счёт взаимодействия с рецепторами ЛПН, проникают в клетки (в первую очередь в гепатоциты). Также в механизмах проникновения липовирусных частиц вируса гепатита С в клетки участвует рецептор SR-BI (рецептор липопротеинов высокой плотности).
Частицы вируса имеют белково-липидную оболочку, сформированную липидами инфицированных клеток и поверхностными белками вируса. Под оболочкой располагается нуклеокапсид, который сформирован сердцевинным (core) белком и содержит вирусную РНК. Размеры нуклеокапсида составляют 33–40 нм.
Детальное строение вируса гепатита С до сих пор не выяснено, что обусловлено низким содержанием вируса в крови инфицированных людей и животных (в клеточных культурах вирус не размножается) и способностью вирусных частиц образовывать комплексы с антителами и липопротеинами крови[3][4][5].
Жизненный цикл вируса[править | править код]
РНК вируса, составляющая материальную основу его генома, может выступать в качестве мРНК, целиком транслирующейся на рибосомах ЭПР инфицированных клеток. В результате такой полной трансляции образуется полипротеин, содержащий в себе все вирусные белки. Полипротеин расщепляется на функциональные белки с помощью клеточных и вирусных протеаз. Процессы фолдинга и пострансляционых модификаций белков Е1 и Е2 целиком проходят в пространстве ЭПР.
На геномной РНК вируса, выступающей в качестве матрицы для воспроизведения, происходит и синтез дочерних копий вирусного генома при участии специфической вирусной РНК-полимеразы, образующейся в результате расщепления полипротеина. Благодаря этому геномная РНК вируса гепатита С обладает самостоятельной инфицирующей способностью (она способна инфицировать клетки даже попадая в них в «голом виде», т.е. не в составе зрелых вирионов), что впрочем, характерно для всех вирусов класса IV классификации Балтимора. Дочерние копии вирусного генома, в свою очередь, могут выступать как в роли мРНК, так и входить в состав новых вирионов, продуцируемых инфицированными клетками[6].
Сборка частиц ВГС осуществляется в мембранах эндоплазматического ретикулума, вакуолях аппарата Гольджи и цитоплазме. Сердцевинный белок остается на цитоплазматической поверхности ЭПР и в липидных вакуолях цитоплазмы, а оболочечные белки частично проникают во внутреннюю полость ЭПР. В эндоплазматической сети белки Е1 и Е2 формируют комплекс и подвергаются процессингу, который, вероятно, заканчивается в секреторных вакуолях аппарата Гольджи. Нуклеокапсид после упаковки РНК покрывается оболочкой, и вирус выпочковывается в цистерны ЭПР. Сформировавшиеся вирусные частицы покидают клетку в составе секреторных вакуолей. Скорость образования вирионов у пациентов с хронической ВГС-инфекцией может достигать 1012 частиц в сутки.
Помимо рецептора ЛПН, в механизмах проникновения вируса в клетки участвует рецептор CD81 (экспонированный на поверхности большинства клеток). Считается, что посредством связывания с этим рецептором в клетки проникают вирусные частицы, не ассоциированные с липопротеинами.
HCV обладает тропизмом не только к печени, но и к некоторым другим тканям и органам. Он способен, в частности, реплицироваться в клетках иммунной системы, включая моноциты/макрофаги и В-клетки, в дендритных клетках, гематопоэтических клетках-предшественниках, микроглии, кардиомиоцитах, кишечном эпителии, остеобластах и В-клеточных фолликулах лимфатических узлов. Показано, что инфицированные лимфоидные клетки могут быть причиной заражения здоровой печени при ее трансплантации. Внепечёночный резервуар инфекции может служить источником реактивации болезни после прекращения интерферонотерапии, а также играть роль в развитии таких патологических процессов иммунной системы, как лимфома В-клеток и смешанная криоглобулинемия[3][4].
Подтипы вируса[править | править код]
Известно 8 основных генотипов HCV, которые, на основании различий в первичной структуре РНК, подразделяются более чем на 100 подтипов. Типы вируса гепатита С обозначаются арабскими цифрами (1-8), а подтипы – латинскими буквами (1a, 1b, 2a и т.д.). Каждый из вирусных генотипов обладает своими особенностями патогенеза и путей передачи, что обуславливает важность правильной и точной диагностики и существенные различия в применяемой антивирусной терапии. 1b-генотип чаще приводит к развитию цирроза и гепатоцеллюлярной карциномы печени. Подтипы 1a и 3b передаются, преимущественно, “шприцевым” методом, в силу чего наиболее распространены у лиц, принимающих внутривенные наркотики. 1b подтип чаще всего передаётся при переливаниях крови.
Генотипы HCV значительно различаются по своей географической распространённости. Так, к примеру, генотип 6 распространён, преимущественно, в Юго-Восточной Азии. Генотип 4 – в Северной и Центральной Африке, 5- в Южной Африке. В Японии преобладает генотип 1b. В США – 1a генотип. В европейской части России преобладают 1b и 3a генотипы[3][7].
Инфицирование одним генотипом не дает иммунитета против инфицирования другим типом, поэтому возможно одновременное заражение двумя и более штаммами. В большинстве из этих случаев, один из штаммов доминирует над другим[5].
Все существующие генотипы, по всей видимости, произошли от генотипа 1b. Современные методы молекулярно-эволюционных исследований показывают, что генотипы 2-6 образовались около 300-400 лет назад, а деление их на подтипы началось около 200 лет назад[8][9]. Окончательно современный спектр подтипов вируса гепатита С сформировался к середине 20 века, что было связано с повсеместным распространением вируса в человеческой популяции, вызванным массовым внедрением в медицинскую практику технологий переливания крови и её компонентов (начавшемуся в начале 20 века).
Устойчивость во внешней среде[править | править код]
Устойчив к температурам до 500С, но инактивируется при более высоких температурах, под действием органических растворителей, УФ-излучения и распространённых дезинфектантов. В целом вирус малоустойчив во внешней среде[6].
Иммуногенность[править | править код]
HCV обладает слабой иммуногенностью, в силу чего вызывает лишь мало выраженный и растянутый во времени иммунный ответ (специфические антитела, к тому же обладающие слабым вируснейтрализующим действием, начинают образовываться не ранее чем через 2 недели после попадания вируса в организм). Это же обстоятельство является причиной того, что HCV способен вызывать повторную инфекцию у людей, переболевших в острой форме и выздоровевших. До 60% людей, перенесших вирусный гепатит С с выздоровлением, не имеют антител к антигенам HCV уже через 3 года (а у тех индивидуумов, в крови которых антитела обнаруживаются более длительный срок, они содержатся в низком титре)[3][6].
Вакцина против вируса гепатита С[править | править код]
Попытки создания вакцины, несмотря на активные исследования практически с момента идентификации возбудителя в 1989 г., до сих пор не привели к успеху. Большинство специалистов скептически относится к самой возможности создания классической вакцины против гепатита С. В настоящее время основные усилия в этой области сосредоточены в поиске и разработке средств стимуляции клеточных механизмов противовирусного иммунитета посредством, в частности, ДНК-вакцин[3][7][6][10].
- ↑ A. Kapoor, P. Simmonds, G. Gerold, N. Qaisar, K. Jain. Characterization of a canine homolog of hepatitis C virus (англ.) // Proceedings of the National Academy of Sciences. — National Academy of Sciences, 2011-07-12. — Vol. 108, iss. 28. — P. 11608—11613. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.1101794108.
- ↑ P. D. Burbelo, E. J. Dubovi, P. Simmonds, J. L. Medina, J. A. Henriquez. Serology-Enabled Discovery of Genetically Diverse Hepaciviruses in a New Host (англ.) // Journal of Virology. — 2012-06-01. — Vol. 86, iss. 11. — P. 6171—6178. — ISSN 0022-538X. — doi:10.1128/JVI.00250-12.
- ↑ 1 2 3 4 5 6 7 Л.И. Николаева. Вирус гепатита С: антигены вируса и реакция на них иммунной системы макроорганизма:
информационно-методическое пособие. — Новосибирск: Вектор-Бест, 2009. — 78 с. - ↑ 1 2 3 4 Научная электронная библиотека. monographies.ru. Дата обращения 2 апреля 2020.
- ↑ 1 2 3 Ксения Щербак. Вирус гепатита С (HCV, ВГС). Гепатит С — сайт и форум о диагностике и лечении вирусных гепатитов. Дата обращения 2 апреля 2020.
- ↑ 1 2 3 4 А.И. Зинченко, Д.А. Паруль. Основы молекулярной биологии вирусов и антивирусной терапии. — Минск: Вышэйшая школа, 2005. — С. 164. — 214 с. — ISBN 985-06-1049-2.
- ↑ 1 2 А. И. Мигунов. Гепатит. Современный взгляд на лечение и профилактику. — Спб.: Весь, 2014. — С. 39. — 128 с. — ISBN 978-5-9573-0519-4.
- ↑ Muhammad T Sarwar, Humera Kausar, Bushra Ijaz, Waqar Ahmad, Muhammad Ansar. NS4A protein as a marker of HCV history suggests that different HCV genotypes originally evolved from genotype 1b // Virology Journal. — 2011-06-23. — Т. 8. — С. 317. — ISSN 1743-422X. — doi:10.1186/1743-422X-8-317.
- ↑ Marco Salemi, Anne-Mieke Vandamme. Hepatitis C Virus Evolutionary Patterns Studied Through Analysis of Full-Genome Sequences (англ.) // Journal of Molecular Evolution. — 2002-01-01. — Vol. 54, iss. 1. — P. 62—70. — ISSN 1432-1432. — doi:10.1007/s00239-001-0018-9.
- ↑ Обезвредить ласкового убийцу. Когда появится вакцина от гепатита С. РИА Новости (20190728T0800+0300). Дата обращения 2 апреля 2020.
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 31 декабря 2018;
проверки требуют 3 правки.
Ви́рус гепати́та B (англ. Hepatitis B virus, HBV) — ДНК-содержащий вирус из семейства гепаднавирусов, возбудитель вирусного гепатита B. В мире по различным оценкам от 3 до 6 % людей инфицировано вирусом гепатита B. Носительство вируса не обязательно сопровождается гепатитом, однако носитель вируса может заражать других людей.
Классификация[править | править код]
Выделяют 10 генотипов вируса: A, B, C, D, E, F, G, H, I и J. Различия между генотипами составляют более 8 %. Генотипы A и D распространены повсеместно; генотипы C и B характерны для Юго-Восточной Азии и Японии. Генотип Е распространен преимущественно в Африке. Генотип F был найден среди коренного населения Южной Америки и на Аляске. Генотип G спорадически встречается в различных частях света, в частности в Соединенных Штатах Америки и во Франции. Генотипы Е и G характеризуются низкой вариабельностью в последовательности нуклеотидов в геноме, по сравнению с другими генотипами.
Генотипы вируса гепатита B могут обладать различными биологическими свойствами. В последнее время все большое значение придаётся генотипу вируса в клинических аспектах течения вирусной инфекции, а также чувствительности к антивирусным препаратам. На сегодняшний день установлено, что инфекция, вызванная вирусом гепатита B генотипов В и С, коррелирует с повреждением печени; а инфекция, обусловленная вирусом гепатита B генотипа А, эффективно излечивается терапевтическими методами с использованием интерферона
Строение вирусной частицы[править | править код]
Вирион (вирус вне клетки хозяина) состоит из нуклеопротеида, капсида и суперкапсида. Капсид — икосаэдр размером 28 нм, внутри которого заключена ДНК вируса (нуклеопротеид). В состав капсида входит основной белок ядра (HBcAg — от «Hepatitis B core Antigen»). Суперкапсид представляет собой липидную мембрану, в которую встроены молекулы белка наружной оболочки — поверхностного антигена (HBsAg — от «Hepatitis B surface Antigen»). Диаметр вирусной частицы — 42 нм.
Строение генома[править | править код]
Геном вируса гепатита B представляет собой одну двуцепочечную кольцевую ДНК длиной около 3200 нуклеотидов (длина генома различна у разных изолятов). Одна из цепей («плюс-цепь») ДНК короче другой (её длина составляет 1700—2800 нуклеотидов). Вторая цепь тоже не является замкнутой и к её 5’-концу ковалентно присоединена молекула полимеразы (P).
В геноме вируса найдено 4 гена: S, С, Р, X, кодирующих соответственно HBsAg, HBcAg, полимеразу и белок-регулятор экспрессии генов. Кроме того, там есть регуляторные последовательности ДНК, ответственные за синтез белков и репликацию вируса. Гены частично перекрываются, что обусловливает малый размер генома.
Отличительной особенностью генома вируса гепатита В является его высокая информационная ёмкость (особенно на фоне того, что его ДНК является наименьшей по размеру среди всех известных ДНК-содержащих вирусов). Это достигается тем, что в молекуле ДНК, заключающей в себе геном данного вируса, имеется 6 перекрывающихся рамок считывания генов[2].
Репликация вируса[править | править код]
Несмотря на то, что вирус гепатита B является ДНК-содержащим вирусом, в его жизненном цикле имеется РНК-стадия. После проникновения вируса в клетку вирусная ДНК перемещается в клеточное ядро и транскрибируется с образованием полноразмерной прегеномной РНК трёх мРНК меньшей длины. Синтезированные РНК перемещаются в цитоплазму, где мРНК транслируются и прегеномная РНК вместе с полимеразой упаковывается в белковую оболочку. Полимераза вируса гепатита B способна осуществлять обратную транскрипцию, и на матрице прегеномной РНК синтезируется вирусная минус-цепь, а на её матрице — плюс-цепь.
Кроме того, геном вируса полностью или частично может интегрироваться в геном гепатоцита. При этом могут повреждаться гены гепатоцита, что приводит к раку печени.[источник не указан 3522 дня] По другим данным, вирус находится в клетке в эписомном состоянии, а онкогенным эффектом обладает белок Х — транскрипционный фактор, рекрутирующий транскрипционную машину клетки для синтеза РНК вируса[3]
Профилактика[править | править код]
Упомянутый выше поверхностный HBsAg-антиген, находящийся в наружной оболочке, применяют для производства высокоэффективной профилактической вакцины.
Примечания[править | править код]
Источник

Вирусная нагрузка при гепатите С – мера тяжести заболевания, которая определяется путем подсчета количества вирусов в 1 миллилитре крови. Показатель выражается численно, а измеряется в международных единицах на 1 мл (МЕ/мл). Инфекционная нагрузка указывает степень инфицирования, концентрацию вирусных частиц в организме и влияет на вероятность человека заразить окружающих.
Кому и когда назначают анализ на вирусную нагрузку
Вирусная нагрузка – один из важнейших критериев оценки состояния пациентов, зараженных гепатитом. Для выявления РНК вируса в крови прибегают к разным видам полимеразной цепной реакции (ПЦР) – генотипированию, количественной, качественной. Анализ выполняется при:
- оценке общего состояния людей с выявленным вирусным гепатитом;
- положительном тесте на антитела к HCV;
- подборе дозы препарата для уничтожения возбудителя гепатита.
По результатам обследования врач-инфекционист определяет степень активности возбудителя в организме пациента. Количественная ПЦР-диагностика выполняется до и во время лечения антивирусными лекарствами. В первом случае уточняют дозу и продолжительность лечения, а во втором – эффективность назначенной терапии. Снижение инфекционной нагрузки указывает на положительный терапевтический ответ и высокую вероятность полного выздоровления.
Подготовка к сдаче крови
Для подсчета количества частиц вируса гепатита С (ВГС) исследуют кровь, взятую из локтевой вены. Забор образцов для ПЦР-диагностики выполняют в процедурном кабинете. При соблюдении правил антисептики исключается риск занесения инфекции в биоматериал извне. Выполнение всех процедурных условий предотвращает недостоверные результаты.
По данным исследования удается охарактеризовать вирусный процесс – определить активность возбудителя гепатита, специфичность иммунного ответа.
Сдаче крови предшествует несложная подготовка:
- за сутки отказываются от приема медикаментов;
- в день обследования ограничивают физические нагрузки;
- за 8 часов исключают прием пищи и красящих напитков;
- анализ сдают до полудня натощак;
- перед входом в процедурный кабинет необходимо спокойно посидеть 15-20 минут.
Погрешности в результатах анализа чаще всего связаны с:
- неправильным хранением биоматериала;
- приемом лекарств перед забором крови;
- допущением ошибки лаборантами.
При необходимости повторного проведения ПЦР-диагностики кровь сдают в той же лаборатории.
Современные методы выявления количества вируса
Для определения степени активности вирусного гепатита необходимо подсчитать количество РНК в организме больного. С этой целью выполняют разные виды тестов, отличающихся по степени чувствительности.
При определении количества РНК возбудителя гепатита удается подобрать минимальную терапевтическую дозу, необходимую для уничтожения инфекции.
Методы определения количества возбудителя гепатита С в крови:
- Количественная ПЦР-диагностика. Тест высокой чувствительности выявляет вирусные РНК в сыворотке крови от 50 МЕ/мл. К нему прибегают несколько раз – до начала терапии, во время приема антивирусных препаратов, после завершения лечения. — рекомендуемый
- Метод транскрипционной амплификации. Один из самых чувствительных тестов применяется для обнаружения и подсчета количества вирусных частиц. По полученным данным удается выявить минимальную инфекционную нагрузку – до 10 МЕ/мл.
- Радиоиммунологический анализ. Суть теста заключается в использовании меченых изотопов, которые вступают в реакцию с вирусной частицей. Во время радиометрии подсчитывают количество вирионов в крови.
- Метод разветвленной ДНК. Сегодня гибридизационный анализ используется крайне редко, что связано с его невысокой чувствительностью – от 500 МЕ/мл. К преимуществам метода относят невысокую стоимость, быстрое получение результатов. Метод разветвленной ДНК используется инфекционистами только при подтвержденном вирусном гепатите С для определения динамики лечения.
- Способ иммуноблоттинга. Этот тест чувствительнее иммуноферментного анализа. Для определения количества вирионов сначала отделяют плазму от клеток крови. В ходе исследования выявляют не только вирусные частицы, но и антитела к ним. Для выполнения теста нужно от 3 часов до 2 дней.
Для уточнения диагноза определяют генотипы ВГС. В соответствии с результатами теста составляют подходящую схему терапии, оценивают шансы на выздоровление.
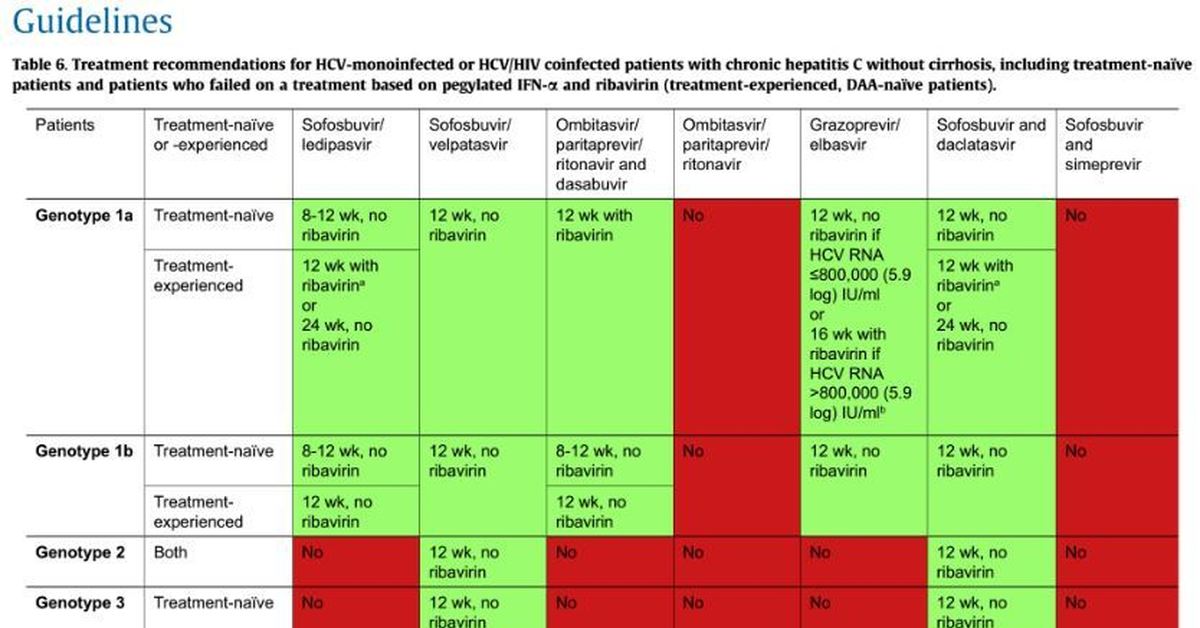
В вирусологии зарегистрировано 11 генотипов HCV, которые имеют подтипы. На территории РФ чаще выявляются 1a, 1b и 3b генотипы. В первом случае риск хронизации воспаления и рецидива вирусной инфекции очень высокий. Однако с момента появления на рынке современных противовирусных препаратов первые 6 генотипов вируса поддаются лечению с вероятностью выше 96%, даже при циррозе печени, самые распространенные схемы лечения (ссылка).
Расшифровка вирусной нагрузки при гепатите С
Результаты лабораторных исследований интерпретируют врачи разных специализаций – гастроэнтеролог, инфекционист, гепатолог. В зависимости от содержания вирионов определяют степень прогрессирования гепатита. Высокая вирусная нагрузка свидетельствует об остром воспалении печени. При правильном подборе медикаментов и успешном лечении она снижается.
В результатах анализов очень часто можно увидеть степени, которые обозначаются как «^», например, 6*10^5 МЕ/МЛ, 10 в пятой степени это 100 тысяч, соответственно 6*10^5 МЕ/МЛ = 600 000 МЕ/МЛ.
Для упрощения подсчетов:
10^2 = 100
10^3 = 1000
10^4 = 10 000
10^5 = 100 000
10^6 = 1 000 000
Подставляйте результат вашего анализы, который стоит перед знаком умножить, и вы получите количество вируса на миллилитр крови. Учтите, что единицы измерения могут отличаться (копий/мл, ме/мл).
Если затрудняетесь или есть вопросы, вы всегда можете написать нашему дежурному врачу-инфекционисту (чат в правом нижнем углу экрана). Он бесплатно расшифрует ваши анализы и проконсультирует.
Таблица вирусной нагрузки при гепатите С:
| Вирусная нагрузка, в МЕ/мл | Оценка нагрузки | Характер репликации (самокопирования) ВГС |
| 600-30 000 | низкая | неактивная |
| 30 000 — 800 000 | средняя | активная |
| свыше 800 000 | высокая | высокоактивная |
Впервые тест выполняют при подтверждении диагноза для оценки общего состояния. В зависимости от типа и количества РНК ВГС выбирают подходящие препараты, дозу и сроки терапии. Спустя 2 недели делают повторный анализ, чтобы определить эффективность лечения. При снижении инфекционной нагрузки схему терапии не меняют.
При назначении препаратов прямого противовирусного действия (ПППД) курс лечения занимает 8, 10, 12 или 24 недели.
Что значит для больного высокая или низкая нагрузка
Инфекционная нагрузка – показатель, отражающий степень активности вирионов и опасность больного человека для окружающих. Если она низкая, это свидетельствует о хорошей сопротивляемости организма возбудителю гепатита. От концентрации РНК HCV во многом зависит результативность и продолжительность лечения.
По результатам повторного теста определяют необходимость внесения корректив в схему лечения. Если тест дает положительный результат, то есть уровень вирионов в плазме крови снижается, терапию продолжают без изменений. Лечение гепатита С с любой вирусной нагрузкой проводят лекарствами, которые связываются с белками ВГС и препятствуют их самокопированию:
- Софосбувир и Даклатасвир
- Софосбувир и Ледипасвир
- Софосбувир и Велпатасвир
Если выявляют более 400 000 МЕ/мл, это свидетельствует об интенсивной репликации вирионов. При высокой активности инфекционных агентов возрастает риск осложнений – холестаза, фиброза и цирроза печени, печеночной энцефалопатии, брюшной водянки, гепатоцеллюлярной карциномы.
Могут ли быть ошибки в результатах анализа
Погрешности в ПЦР-диагностике – редкость. Но если полученные данные противоречат результатам других исследований, проводят повторный анализ. Не исключены ложноположительные результаты при:
- приеме лекарств от ВИЧ-инфекции;
- обострениях инфекционных болезней;
- беременности;
- аутоиммунных нарушениях.
Небольшая нагрузка при повышенном уровне печеночных ферментов в 90% случаев свидетельствует о ложноотрицательном результате.
Ошибки в измерениях иногда связаны с:
- нарушением правил асептики при заборе крови;
- неправильным хранением биоматериала;
- загрязнением исследуемой крови химическими реагентами;
- низкой квалификацией лаборантов;
- забором крови во время лечения препаратами гепарина.
Незначительные погрешности возможны при проведении ПЦР-исследования в разных лабораториях. Поэтому гепатологи и гастроэнтерологи советуют в течение всего периода лечения гепатита сдавать анализы в одной и той же клинике.
Инфекционная нагрузка отражает тяжесть течения болезни. По полученным данным определяют подходящую дозу противовирусных лекарств, оценивают результативность терапии. В случае параллельного генотипирования вируса удается не только подобрать медикаменты от гепатита, но и спрогнозировать терапевтический ответ.
Что делать дальше, как избавиться от вируса?
Главное не паниковать, сейчас гепатит лечится не сложней гриппа. Для назначения терапии современными препаратами необходимы следующие данные:
- Вирусная нагрузка (Количественный анализ методом ПЦР)
- Генотип вируса (Анализ на генотипирование)
- Уровень фиброза (Фибросканирование, эластография)
Когда у вас на руках есть результаты всех этих анализов, вы можете по таблице определиться со схемой лечения. Мы рекомендуем обратиться к лечащему врачу и проконсультироваться на предмет назначения терапии современными противовирусными препаратами прямого действия. Многие врачи до сих пор назначают малоэффективную терапию интерферонами + рибавирином, имейте ввиду, и настаивайте на терапии новыми лекарствами.
Сколько стоит терапия новыми препаратами?
В среднем от 29 700 до 54 000 рублей, в зависимости от схемы лечения. У нас на сайте полный курс лечения индийскими препаратами на 12 недель стоит 33 000 рублей, препаратами из Шри-Ланки — 29 700 рублей.
Спасибо за то, что дочитали до статью конца. Если остались вопросы, дежурный врач-инфекционист всегда готов ответить на них (чат в правом нижнем углу экрана).
Источник