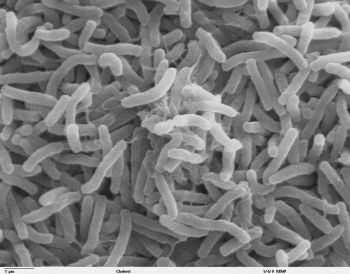
Возбудители кишечных инфекций в воде бассейна это
В разделе: Вода
2018-05-2424.05.2018

Вода является неотъемлемой составляющей всех живых систем. В среднем, человек потребляет 2,5 литра воды в день. Наряду с полезным кальцием, магнием и калием вода несет в себе и вредные для здоровья человека элементы, такие как нитраты, нитриты, кадмий и тому подобное. Характеристики употребляемой нами жидкости определяют качество и продолжительность жизни. Согласно докладу Всемирной организации здравоохранения (WHO, 2007), около 1,1 миллиарда человек не имеют доступа к безопасным источникам водоснабжения, а около 2 миллиона человек ежегодно умирают от заболеваний, передающихся через питьевую воду. Тошнота и диарея – не самое опасное, что вызывают микроорганизмы. Бактерии и вирусы в прямом смысле могут отравлять нашу жизнь, вызывая болезни с летальным исходом (например, Clostridium botulinum – возбудитель ботулизма) или опосредовано приводя к смертельным случаям (Helicobacter pylori – возможная причина рака ЖКТ). В Российской Федерации состояние воды регламентируются несколькими нормативами в зависимости от предназначения (смотреть таблицу).
Требования к микробиологическим показателям качества воды в Российской Федерации в зависимости от хозяйственной деятельности человека
| Показатель | Природная вода1 | Вода бассейнов2 | Нецентр. водоснаб.3 | Центр. водоснаб.4 | Бутилированная вода5 |
|---|---|---|---|---|---|
| Общая микробная численность (ОМЧ), КОЕ / 1 мл | – | – | не более 100 | не более 50 | не более 20 |
| Общие колиформные бактерии (ОКБ), КОЕ / 100 мл | не более 1000 (питьевая вода) не более 500 (рекреационное назначение) | не более 1 | отсутствие в 100 мл | отсутствие в 100 мл | отсутствие в 300 мл |
| Термо-толерантные колиформные бактерии (ТКБ), КОЕ / 100 мл | не более 100 | отсутствие в 100 мл | отсутствие в 100 мл | отсутствие в 100 мл | отсутствие в 300 мл |
| Колифаги, БОЕ / 100 мл | не более 10 | отсутствие в 100 мл | отсутствие в 100 мл | отсутствие в 100 мл | отсутствие в 1000 мл |
| Споры сульфит-редукторов | – | – | – | отсутствие в 20 мл | отсутствие в 20 мл |
| Возбудители кишечных инфекций | отсутствие в 1000 мл | отсутствие в 1000 мл | отсутствие в 1000 мл | отсутствие в 1000 мл | отсутствие в 1000 мл |
| Синегнойная палочка (Pseudomonas aeruginosa) | – | отсутствие в 100 мл | – | – | отсутствие в 1000 мл |
| Золотистый стафилококк (Staphylococcus aureus) | – | отсутствие в 100 мл | – | – | – |

- СанПиН 2.1.5.980-00 «Гигиенические требования к охране поверхностных вод»
- СанПиН 2.1.2.1188-03 «Плавательные бассейны. Гигиенические требования к устройству, эксплуатации и качеству воды. Контроль качества»
- СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников»
- СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества»
- СанПиН 2.1.4.1116-02 «Питьевая вода. Гигиенические требования к качеству воды, расфасованной в емкости. Контроль качества»
Оценка качества по микробиологическим показателям сводится к определению в объекте доли микроорганизмов, связанных с человеком и его продуктами жизнедеятельности.
Прежде всего, определим единицы измерения количества микробов. КОЕ/мл (колониеобразующие единицы) – количество жизнеспособных микробных клеток в миллилитре. Если производится оценка вирусных частиц в среде, то указывается БОЕ/мл (бляшкообразующие единицы) – количество вирусных частиц в миллилитре.
Общие показатели
Общая микробная численность бактерий (ОМЧ) базовый показатель
Выявляет бактерии, потенциально способные причинить вред здоровью. Этот показатель достаточно информативен, так как высокая ОМЧ является индикатором загрязнения органическими соединениями (например, содержащихся в фекалиях) и различными формами азота. С другой стороны, в ОМЧ входят как опасные бактерии (например, высокопатогенный штамм кишечной палочки Escherіchіa colі), так и практически безвредные и повсеместно встречаемые сенные палочки (Bacillus subtillis).
Общие колиформные бактерии (ОКБ) колодцы, скважины, родники
Группу ОКБ формируют бактерии семейства Enterobacteriacea (Citrobacter, Enterobacter, Klebsiella). Многие представители этой группы относятся к нормальной микрофлоре желудка, поэтому превышение ОКБ может говорить о возможном фекальном загрязнении, связанном с деятельностью человека. Однако в данной группе могут встречаться и свободноживущие микробы, которые не представляют опасности для здоровья.
Термотолерантные колиформные бактерии (ТКБ) колодцы, скважины, родники
ТКБ – более достоверный индикатор загрязнения продуктами жизнедеятельности. Этот показатель свидетельствует о свежем фекальном загрязнении. В большинстве случаев в этой группе обнаруживается кишечная палочка Escherіchіa colі.
Колифаги колодцы, открытые источники
Колифаги являются вирусами палочки Escherichia coli и рассматриваются эпидемиологами как более чувствительный метод определения загрязнения жидкости микроорганизмами группы кишечной палочки. Вирусные частицы более устойчивы к окружающей среде, чем бактерии, в которых они обитают, поэтому этот показатель качества служит достоверной меткой давнего фекального загрязнения. Содержание колифагов свидетельствует о наличии опасных для человека энтеровирусов в воде.
Рекомендуется проводить исследование этой характеристики в случае, если ранее источник не был проверен, а также для оценки эффективности методов дезинфекции источников и систем подачи-распределения воды.
Споры сульфитредукторов бытовые нужды
Спорообразующие клостридии (Clostridium botulinum, Clostridium perfringens, Clostridium tetani) являются дополнительным микробиологическим показателем фекального загрязнения. Клостридии встречаются в кишечнике, однако при попадании в организм в большом количестве могут вызывать пищевые отравления и смертельные заболевания, в том числе, ботулизм. В отличие от относительно неустойчивых ОКБ и ТКБ, споры клостридий могут сохраняться долгое время, поэтому этот микробиологический показатель, как и колифаги, свидетельствует о наличии давнего загрязнения. Относительно высокая устойчивость позволяет использовать споры в качестве индикатора эффективности проведения водоподготовки (хлорирования, озонирования и т.п.).
Определение этого микробиологического показателя качества воды рекомендуется проводить при наличии посторонних запахов и образовании чёрного налёта на трубах, а также для оценки эффективности методов дезинфекции источников и систем подачи-распределения жидкости.
Синегнойная палочка бассейны, колодцы, родники
Pseudomonas aeruginosa – распространённый организм, который встречается практически во всех средах, в т. ч. входит в состав микрофлоры кожи. Однако при снижении иммунитета человека и высоком содержании в воде синегнойная палочка может вызывать серьёзные заболевания, поражая лёгкие и почки и приводя к сепсису. Присутствие Pseudomonas aeruginosa в бассейне или ванне является основанием для полной замены содержимого резервуара. Особенность синегнойной палочки – её чрезвычайная устойчивость к нагреванию, дезинфицирующим средствам и антибиотикам.
Золотистый стафилококк бассейны, колодцы, кулеры, родники
Staphylococcus aureus – тесно связанная с человеком бактерия, которая в основном образует колонии на коже, половых органах, респираторном и желудочно-кишечном трактах. Как и синегнойная палочка, золотистый стафилококк встречается у здоровых людей, однако может вызвать развитие болезни при ослаблении иммунитета.
Возбудители кишечных инфекций специфические показатели
В действующих нормативных документах не прописаны конкретные возбудители кишечных инфекций. В эту группу входят микроорганизмы, заражение которыми происходит через жидкие среды (Escherichia, Shigella, Vibrio, Salmonella). Процесс определения этого параметра трудоёмок и требует специальной квалификации микробиолога.
Микробиологические показатели качества воды, не регулируемые СанПиН
Развитие и удешевление технологий и новых методов приводит, с одной стороны, к расширению контролируемых параметров, с другой, к выбору более конкретных микроорганизмов-показателей. Например, руководство ВОЗ рекомендует использовать в качестве индикатора фекального загрязнения наличие кишечной палочки (Escherіchіa colі), а не ОКБ и ТКБ. В странах ЕС помимо палочки определяют наличие энтерококков – специфичной группы микроорганизмов обитателей кишечника человека. Ниже приведены группы микроорганизмов, которые имеют индикаторное значение при оценке микробиологического качества воды.
Энтерококки колодцы, скважины, родники
Enterococcus spp. – широкая группа микроорганизмов, проживающая в кишечнике человека. Наряду с золотистым стафилококком энтерококки являются причиной внутрибольничных инфекций, вызывают у человека (менингит, эндокардит). Ввиду более высокой устойчивости этих микроорганизмов к засолению и температуре, по сравнению с ТКБ, энтерококки – более надежный индикатор фекального загрязнения морей и солёных озёр. Согласно нормативу ЕС, эта группа не должна обнаруживаться в 250 мл. Согласно законодательству США, при превышении содержания Enterococcus spp. 35 КОЕ / 100 мл вводится запрет на купание людей.
Условно-патогенные дрожжи и микромицеты колодцы, родники, поверхностные воды
К условно-патогенным дрожжам и микромицетам (плесени) относят большую неоднородную группу грибных организмов. В неё входят Candida albicans и Cryptococcus neoformans, которые вызывают оппортунистические заболевания, в т. ч. грибковые заболевания кожи и молочницу. Другие организмы-микромицеты (Cladosporium cladosporioides, Aspergillus niger) усиливают аллергические реакции, а иногда вызывают их. Особенно опасны плесневые грибы (Penicillium spp., Aspergillus spp., Fusariam spp., Alternaria spp. and Claviceps spp), образующие канцерогенные микотоксины (патулин, афлотоксин). Исследователи из Европейского союза пришли к выводу, что водопроводная вода не является распространителем микотоксинов, однако в стоячих источниках (например, накопительных резервуарах) могут создаться условия для благоприятного развития грибов. В некоторых странах ЕС содержание грибов строго регламентируется, например, в Швеции в питьевой воде их не может быть более 100 КОЕ / 100 мл.
Сине-зелёные водоросли (цианобактерии) бытовые нужды, воды для купания, кормление животных
Микроорганизмы, содержащие зелёный пигмент хлорофилл – обитатели богатых питательными элементами стоячих водоемов. Сами микроорганизмы не заражают человека, но синтезируют и выделяют в среду цианотоксины, вызывающие поражение внутренних органов млекопитающих: гепатотоксины (Microcystis, Anabaena, Oscillatoria, Nodularia, Nostoc, Cylindrospermopsis и Umezakia), нейротоксины (Aphanizomenon и Oscilatoria), почечные токсины (Cylindroapermopsis raciborski).
Таким образом, микробиологические показатели качества воды отражают несколько важных показателей:
- Общее загрязнение микроорганизмами источника воды (ОМЧ).
- Наличие фекального загрязнения и продуктов жизнедеятельности (ОКБ, ТКБ, колифаги, сульфитредукторы, энтерококки).
- Возможное наличие энтеровирусов (колифаги).
- Наличие потенциально опасных микроорганизмов (золотистый стафилококк, синегнойная палочка, условно-патогенные дрожжи, энтерококки, сульфитредукторы).
- Наличие потенциальных продуцентов микотоксинов и цианотоксинов (грибы и цианобактерии).
- Наличие патогенных микроорганизмов (Shigella, Vibrio, Salmonella).
![]()
Поделиться в социальных сетях:
Источник
Методические указания
по обнаружению возбудителей кишечных инфекций
бактериальной природы в воде
(утв.
Министерством здравоохранения СССР 28 мая 1980 г.)
Питьевую воду отбирают в количестве 3 л.
Воду открытых водоемов — в количестве 1 л.
Сточную воду — 100 мл.
Пробы воды для бактериологического анализа отбирают с
соблюдением правил стерильности: в стерильные бутылки или стерильными приборами
— батометрами.
Для отбора воды из открытых водоемов, сточных вод, воды из
бассейнов, колодцев удобен так называемый бутылочный батометр.
При отборе проб сточной жидкости используют металлические
черпаки на деревянных или другого металла ручках либо бутыли, укрепленные
винтовым зажимом на деревянном или металлическом стержне.
Пробы воды из кранов отбирают после их стерилизации путем
фламбирования пламенем горящего тампона, смоченного спиртом, и последующего
спуска воды в течение 10 — 15 минут при полном открытом кране. В случае, если
кран оголовка скважины находится в заглубленной части шахты, то воду из него
сливать не следует (избегая затопления шахты), а использовать только обжиг
крана. Если отбираемая вода содержит следы остаточного хлора, то для
нейтрализации хлора необходимо перед отбором во флаконы добавить 1,5 %
стерильный раствор тиосульфата (гипосульфита натрия) из расчета 4 мл на 1 л
воды.
При отборе проб воды из открытых водоемов следует
предусмотреть следующие точки: в месте застоя и в месте наиболее быстрого
течения (с поверхности и на глубине 50 — 100 см).
При отборе проб сточной жидкости следует предусмотреть точки
на этапах ее очистки; воду из колодцев отбирают с поверхности и на глубине 20 —
30 см, воду централизованного водоснабжения — из кранов по разводящей сети. При
отборе воды из артезианских скважин предусматривают следующие точки: из крана
оголовка скважины, из крана на выходе водоразборных сооружений, из крана после
подземного резервуара, перед поступлением в сеть, по разводящей сети.
Отбор проб в бассейнах производят при водообмене, в местах
водозабора, на этапах очистки и обеззараживания, перед подачей воды в бассейн,
на сливе воды из бассейна, в ванне бассейна — с поверхности и на глубине 20 —
30 см.
Отобранные пробы воды должны сопровождаться документом,
содержащим:
1. Наименование пробы воды.
2. Точное наименование места отбора проб воды.
3. Дату и время отбора, а также дату и время доставки пробы
воды в лабораторию.
4. Указание температуры отобранной воды.
5. Указание, по чьему заданию и с какой целью производится
исследование.
6. Кем произведен отбор пробы воды (фамилия, должность).
Пробы воды доставляют в лабораторию не позднее 5 часов с
момента взятия пробы.
1. Прямой посев исследуемой воды на диагностические среды
для определения шигелл.
1.1. Питьевая вода.
Воду предварительно фильтруют через мембранные фильтры № 3 в
объеме не менее 500 мл. Фильтры помещают на поверхность питательных сред: агара
с эозин-метиленовым синим (ЭМС) и бактоагара Плоскарева — антибиотиком и без
него. Выбор антибиотика зависит от того, к каким антибиотикам устойчивы штаммы
шигелл, выделяемые в данном районе. Посевы подращивают 18 — 24 часа при 37 °C.
1.2. Вода открытых водоемов.
Воду предварительно фильтруют через мембранные фильтры № 3 в
объеме не менее 500 мл. Дальнейшее исследование проводят так же, как и при
анализе питьевой воды.
1.3. Сточная вода.
Исследуемую воду в количестве 0,1 мл помещают на чашки с
дифференциально-диагностической средой (не менее 5 чашек) и растирают шпателем.
Посевы инкубируют в термостате при 37 °C 18 — 24 часа.
Дальнейшая идентификация бактерий проводится по общепринятой
методике.
2. Посев воды в накопительные среды.
Используют не менее двух сред накопления. Для сальмонелл:
магниевую среду, среду Кауфмана, селенитовый бульон, среду с охмеленным суслом.
Для шигелл: селенитовый бульон, среду с охмеленным суслом, а также 1 %
мясопептонный бульон и 10 % желчный бульон (метод Ростовского-на-Дону НИИЭМГ).
2.1. Посев питьевой воды.
Исследуемую воду фильтруют через мембранный фильтр № 3
(количество фильтров зависит от скорости фильтрации). Фильтры укладывают на
поверхность питательной среды Эндо, разлитой в чашки Петри (поверхность фильтра
с задержавшимися бактериями остается верхней). Посев подращивают при 37 °C 18 —
24 часа.
После учета выросших на мембранных фильтрах колоний кишечных
палочек для определения коли-титра производят следующее: мембранные фильтры, на
которых имелся рост мелких единичных бесцветных колоний, помещают в среды
накопления — селенитовый бульон или магниевую среду обычной концентрации,
разлитые в пробирки по 10 мл, в среду с охмеленным суслом, предварительно
разбавленную стерильной водопроводной водой 1:4 и разлитую в пробирки по 10 мл.
Посев помещают в термостат на 18 — 24 часа при 37 °C.
При отсутствии мембранных фильтров исследуемую воду
распределяют по 500 мл во флаконы и вносят в среды накопления согласно прописям
сред. Посевы помещают в термостат на 18 — 24 часа при 37 °C.
2.2. Посев воды открытых водоемов.
Исследуемую воду в количестве 1 л делят на две порции по 500
мл. В каждую порцию вносят накопительные среды по прописям, после чего воду с
накопительной средой разливают поровну в 5 флаконов и помещают в термостат на
18 — 24 часа при 37 °C.
2.3. Посев сточной воды.
Сточную воду в количестве 100 мл вносят в накопительные
среды по прописям и разливают во флаконы на 10 равных порций. Посевы воды
помещают в термостат на 18 — 24 часа при 37 °C.
2.4. Посев воды по методу Ростовского-на-Дону НИИЭМГ (по
Р.С. Хомик и А.А. Рындич). Применяется только для шигелл.
В 0,5 — 1 л исследуемой воды добавляют 5 — 10 мл 1 %
мясопептонного бульона и помещают в термостат при 37 °C на 18 — 24 часа. Затем
произвести посев на среду Эндо, ЭСМ-агар и бактоагар Плоскирева петлей. В этот
же день провести посев подращенный в мясопептонном бульоне воды в среды
накопления: 10 % желчный бульон или селенитовый бульон, произведя разведение до
10-8 (берут 0,5 мл воды на 4,5 мл среды накопления). Из разведений
делают высев на среды Эндо и ЭМС-агар (по 0,1 мл на каждую чашку) и бактоагар
Плоскирева. Чашки с посевами и разведения, откуда делали высев, помещают в
термостат при 37 °C на 18 — 24 часа. На следующий день просматривают чашки, а
из разведений делают еще один высев на те же плотные среды. Дальнейшее
исследование — по общепринятой методике определения шигелл.
3. Высев на дифференциально-диагностические среды.
3.1. Для определения сальмонелл.
Используют висмут-сульфитный агар. Высев из сред накопления
производят бактериологической петлей на 2 — 3 чашки. Посевы инкубируют при 37
°C 18 — 24 часа. Просматривают рост на чашках и дальнейшее исследование
проводят по общепринятой методике.
3.2. Для определения шигелл.
Используют агар с эозин-метиленовым синим с антибиотиками и
без них, бактоагар Плоскирева. Высев из сред накопления производят
бактериологической петлей на не менее 5 чашек. Посевы инкубируют в термостате
при 37 °C 18 — 24 часа. Просматривают рост на чашках и дальнейшее исследование
проводят по общепринятой методике.
4. Ускоренные методы определения сальмонелл и шигелл в воде.
Ускоренные методы определения патогенных энтеробактерий в
воде рекомендуется использовать при повторном контроле воды централизованного и
нецентрализованного водоснабжения, из которой ранее были выделены сальмонеллы
или шигеллы.
4.1. Ускоренный сигнальный метод индикации патогенных
энтеробактерий в питьевой воде.
Питьевую воду отбирают в количестве 1 — 2 л. Для посева воды
используют параллельно не менее двух сред накопления: среду с охмеленным
суслом, магниевую или селенитовую среды. 500 мл исследуемой воды засевают в
равное количество магниевой или селенитовой сред двойной концентрации или среды
с охмеленным суслом по прописи. Навеску сухой среды с охмеленным суслом в
количестве 10 г вносят в 500 мл воды, взбалтывают до растворения в воде. Посевы
инкубируют при 37 °C 18 — 24 часа.
Через 6 часов инкубации (ранний высев) из сред накопления
три объема по 10 мл фильтруют через мембранные фильтры № 3. На первый фильтр
наносят агглютинирующую специфическую сыворотку в количестве 0,5 мл. С помощью
бактериологической петли смывают осадок с фильтра, переносят на предметное
стекло и проводят реакцию агглютинации. Два фильтра укладывают на поверхность
висмутсульфитного агара для подращивания сальмонелл и на ЭМС-агар — для шигелл.
Посевы на чашках инкубируют при 37 °C 18 — 24 часа.
Положительная реакция агглютинации может служить сигнальным
ответом на наличие соответствующих патогенных энтеробактерий.
Для подтверждения сигнального ответа:
1. На следующий день просматривают рост на фильтрах и, если
есть четкие колонии, с каждой проводят пробную реакцию агглютинации на стекле с
соответствующей специфической агглютинирующей сывороткой, готовят мазок и
окрашивают по Граму. При обнаружении грамотрицательных палочек, дающих реакцию
со специфической сывороткой, может быть дан предварительный положительный
ответ. Все колонии, которые дали положительную реакцию агглютинации, пересевают
на чашки с дифференциально-диагностическими средами и дальнейшее выделение и
идентификацию бактерий проводят по общепринятой методике.
2. Наряду с этим, через 18 — 24 часа из сред накопления
производят высев петлей на плотные питательные среды: висмут-сульфитный агар и
ЭМС-агар с антибиотиком и без него, в зависимости от того, какие штаммы
выделяются в данном районе -антибиотикоустойчивые или чувствительные. Посевы
инкубируют при 37 °C 18 — 24 часа. Дальнейшее исследование и идентификация
выделенных бактерий проводятся по общепринятой методике выделения сальмонелл и
шигелл.
4.2. Ускоренное обнаружение сальмонелл в воде
централизованного и нецентрализованного водоснабжения с использованием метода
люминесцирующих антител.
С помощью красителя бисмарк браун приготавливают
нелюминесцирующие мембранные фильтры по способу (Л.Е. Корш и Т.З. Артемовой (1972)).
Пробы воды, подозрительные на наличие сальмонелл, фильтруют по 100 мл через 5
мембранных фильтров. Поверхность фильтров обрабатывают кроличьей
агглютинирующей специфической сальмонеллезной сывороткой или смесью сывороток.
Через 10 — 15 мин препарат помещают на 20 мин во влажную камеру, после чего
подсушивают на воздухе. Затем фильтры обрабатывают люминесцирующей сывороткой
против глобулинов кролика, время окраски — от 15 до 30 мин во влажной камере
при комнатной температуре. Фильтры высушивают на воздухе, помещают на
предметное стекло между слоями нелюминесцирующего иммерсионного масла
(парафинового или вазелинового), накрывают покровным стеклом, на которое
помещают еще каплю иммерсионного масла, и препарат микроскопируют.
Для люминесцентных микроскопов МЛ-2 используют светофильтры
БС 8-2, СС 15-2, ФС 1-2, запирающий фильтр Т-2-Н, окуляторы компенсационные К5Х
или К7Х. Препарат просматривают в падающем свете под ахроматическим
иммерсионным объектом 90×1,25 Л.
При специфическом свечении наблюдается люминесценция по
периферии микробной клетки, четко контрастирующая с телом клетки. Окрашенные и
высушенные препараты могут храниться в темном месте в течение нескольких
недель.
При использовании микроскопа МЛ-2Б возможно ориентировочное
количественное определение сальмонелл в воде, для чего в один из измерительных
окуляров К7Х вставляется окулярная сетка Гаженко. Определение ведут
по формуле:
![]()
где X — количество сальмонелл в 1 мл воды,
S — площадь фильтрующей поверхности в мкм,
S1 — площадь 1 квадрата сетки Гаженко в
мкм,
n — количество клеток
сальмонелл в 1 квадрате (среднее арифметическое из 20 квадратов),
V — объем профильтрованной воды в мл.
Для повышения специфичности результатов анализа воды
бактерии, задержавшиеся на нелюминесцирующих фильтрах, подращивают на
висмут-сульфитном агаре в течение 3 — 4 часов при 37 °C. Образовавшиеся
микроколонии обрабатывают и микроскопируют так же, как и отдельные бактерии.
Для получения достоверных результатов необходим контроль специфичности.
Затраты времени на анализ: без подращивания — 1 — 1,5 час.,
с подращиванием — до 5 часов.
1. Магниевая среда.
Навески | 500 | 100 |
Магний хлористый кристаллический | 19,5 | 3,9 |
Натрий хлористый | 4,0 | 0,8 |
Калий фосфорнокислый однозамещенный | 0,8 | 0,16 |
Пептон, 10 % раствор | 25 | 5 |
Дрожжевой экстракт | 11,0 | 2,5 |
Бриллиантовый зеленый, 0,1 % водный | 2,5 | 0,5 |
Все ингредиенты вносят в
исследуемую воду, растворяют.
2. Среда с охмеленным суслом.
Готовится ex temporae.
125 мл охмеленного сусла наливают в стерильную посуду,
добавляют 6,25 г пептона, размешивают, ставят на огонь, доводят до кипения и
варят на медленном огне в течение 10 мин, остужают, приливают 500 мл
исследуемой воды, 8,7 мл 0,1 % раствора бриллиантового зеленого, приблизительно
15 капель 20 % раствора NaOH, доводя pH содержимого до
7,2 — 7,4.
3. Селенитовый бульон.
а) Приготовление основного раствора (буфера).
В стерильную колбу наливают 1 л дистиллированной воды,
добавляют 10 г пептона, растворяют нагреванием, добавляют 6 г натрия
фосфорнокислого однозамещенного безводного, 14 г натрия фосфорнокислого
двузамещенного безводного, 8 г лактозы. Тщательно перемешивают, фильтруют,
стерилизуют при 0,5 атм. Основной раствор хранится в холодильнике 1 — 2 месяца.
б) Приготовление 10 % раствора натрия кислого
селенистокислого.
В 100 мл дистиллированной воды растворяют 10 г натрия
кислого селенистокислого. Раствор готовят ex temporae. К 500 мл исследуемой
воды добавляют 500 мл основного раствора, 40 мл 10 % раствора натрия кислого
селенистокислого.
4. Среда Кауфмана.
К 1000 мл среды Мюллера добавляют 50 мл стерильной бычьей
желчи, 10 мл 0,1 % водного раствора бриллиантового зеленого. Перемешивают и
разливают в стерильную посуду.
5. Агар с эозин-метиленовым синим с антибиотиком.
На 1 л свежеприготовленной среды (до застывания) добавляют 8
мл 0,5 % раствора синтомицина или 5 мл 0,5 % раствора левомицетина, после чего
среду разливают на чашки.
6. Трехсахарный агар с мочевиной (среда Олькеницкого).
Дистиллированной воды 100 мл,
сухого питательного агара 2,5 г, лактозы 1 г, сахарозы 1 г, глюкозы 0,1 г,
мочевины 1 г, соли Мора 0,02 г, тиосульфата натрия 0,03 г, 0,4 % водного
раствора фенолового красного 0,4 мл. Все тщательно перемешивают, устанавливают
pH 7,2 — 7,4, разливают в пробирки и стерилизуют текучим паром в течение 20 мин
3 дня подряд. После стерилизации среду скашивают, оставляя столбик высотой 5
см. Готовая среда — бледно-розового цвета.
Начальник | В.П. |
СОДЕРЖАНИЕ
Источник