Цитопатогенное действие вируса гепатита в
В патогенезе гепатита В можно выделить несколько ведущих звеньев патогенетической цепи:
- внедрение возбудителя — заражение;
- фиксация на гепатоците и проникновение внутрь клетки;
- размножение вируса и «выталкивание» его на поверхность гепатоцита, а также в кровь;
- включение иммунологических реакции, направленных на элиминацию возбудителя;
- иммунокомплексное поражение органов и систем;
- формирование иммунитета, освобождение от возбудителя, выздоровление.
Поскольку заражение при гепатите В всегда происходит парентеральным путем, можно считать, что момент инфицирования практически равнозначен проникновению вируса в кровь. Попытки некоторых исследователей выделять при гепатите В энтеральную и региональную фазу малообоснованы. Больше оснований считать, что с током крови вирус сразу попадает в печень.
Тропизм вируса гепатита В к ткани печени предопределен наличием в составе НВsАg специального рецептора — полипептида с молекулярной массой 31 000 Да (РЗ1), обладающего альбумин связывающей активностью. Аналогичная зона альбумина находится и на мембране гепатоцитов печени человека и шимпанзе, чем по существу и определяется тропизм НВV к печени человека и шимпанзе.
При проникновении вируса внутрь гепатоцита происходит высвобождение вирусной ДНК, которая, попадая в ядро гепатоцита и исполняя роль матрицы для синтеза нуклеиновых кислот, запускает ряд последовательных биологических реакций, чьим итогом становится сборка нуклеокапсида вируса. Нуклеокапсид мигрирует через ядерную мембрану в цитоплазму где и происходит окончательная сборка частиц Дейна — полного вируса гепатита В.
Следует, однако, отметить, что при заражении гепатоцита процесс может пойти двумя путями — репликативным и интегративным. В первом случае развивается картина острого или хронического гепатита, а во втором — вирусоносительство.
Причины, предопределяющие два вида взаимодействия вирусной ДНК и гепатоцита, точно не установлены. Вероятнее всего, тип реагирования генетически детерминирован.
Итогом репликативного взаимодействия становятся сборка структур коровского антигена (в ядре) и сборка полного вируса (в цитоплазме) с последующей презентацией полного вируса или его антигенов на мембране или в структуре мембраны гепатоцитов.
Принято считать, что репликация вируса не приводит к поражению клетки на уровне гепатоцита, поскольку вирус гепатита В не обладает цитопатическим действием. Это положение нельзя считать бесспорным, так как оно основывается на экспериментальных данных, которые, хотя и свидетельствуют об отсутствии цитопатического действия вируса гепатита В, но получены на культурах тканей и поэтому не могут быть полностью экстраполированы на вирусный гепатит В у человека. Во всяком случае, вопрос об отсутствии поражения гепатоцитов в ходе репликативной фазы нуждается в дополнительном изучении.
Однако, независимо от характера взаимодействия вируса с клеткой, в дальнейшем печень обязательно включается в иммунопатологический процесс. При этом поражение гепатоцитов связано с тем, что в результате экспрессии вирусных антигенов на мембране гепатоцитов и выхода вирусных антигенов в свободную циркуляцию происходит включение цепи последовательных клеточных и гуморальных иммунных реакций, направленных в конечном итоге на удаление вируса ил организма. Этот процесс осуществляется в полном соответствии с общими закономерностями иммунного ответа при вирусных инфекциях. Для элиминации возбудителя включаются клеточные цитотоксические реакции, опосредованные различными классами клеток-эффекторов: К-клеток, Т-клеток, естественных киллеров, макрофагов. В ходе этих реакций происходит разрушение инфицированных гепатоцитов, что сопровождается высвобождением вирусных антигенов (НВсАg, НВeАg, НВsАg), запускающих систему антителогенеза, вследствие чего в крови накапливаются специфические антитела, прежде всего к коровому — анти-НВс и е-антигену — анти-НВЕ. Следовательно, освобождение печеночной клетки от вируса происходит в процессе ее гибели за счет реакций клеточного цитолиза.
Одновременно с этим накапливающиеся в крови специфические антитела связывают антигены вируса, образуя иммунные комплексы, фагоцитируемые макрофагами и выделяющиеся почками. При этом могут возникать различные иммунокомплексные поражения в виде гломерулонефрита, артериита, артралгий, кожных высыпаний и др. С участием специфических антител происходит очищение организма от возбудителя и наступает полное выздоровление.
В соответствии с изложенной концепцией патогенеза гепатита В все многообразие клинических вариантов течения болезни принято объяснять особенностями взаимодействия вируса и кооперацией иммунокомпетентных клеток, иначе говоря, силой иммунного ответа на присутствие вирусных антигенов. По современным представлениям, сила иммунного ответа генетически детерминирована и сцеплена с антигенами гистосовместимости локуса НLA первого класса.
Принято считать, что в условиях адекватного иммунного ответа на антигены вируса клинически развивается острый гепатит с циклическим течением и полным выздоровлением. На фоне снижения иммунного ответа к антигенам вируса иммуноопосредованный цитолиз выражен незначительно, поэтому не происходит эффективной элиминации инфицированных клеток печени, что приводит к слабовыраженным клиническим проявлениям с длительной персистенцией вируса и, возможно, развитию хронического гепатита. При этом, наоборот, в случае генетически детерминированною сильного иммунного ответа и массивности инфицирования (гемотрансфузии) возникают обширные зоны поражения печеночных клеток, чему клинически соответствуют тяжелые и злокачественные формы болезни.
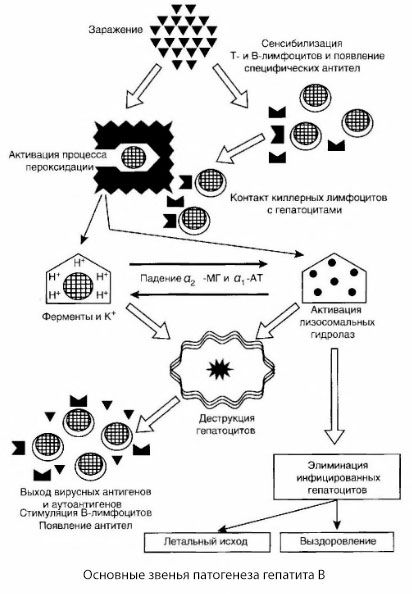
Представленная схема патогенеза гепатита В отличается стройностью, тем не менее в ней имеется ряд спорных и малоисследованных моментов.
Если следовать концепции гепатита В как иммунопатологического заболевания, можно было бы ожидать усиления реакций клеточной цитотоксичности с нарастанием тяжести заболевания. Однако, при тяжелых формах показатели клеточного звена иммунитета резко снижены, в том числе отмечается многократное падение, по сравнению с таковыми у здоровых детей, и показателя К-клеточной цитотоксичности. При злокачественной форме в периоде развития массивного некроза печени и особенно печеночной комы отмечается полная неспособность лимфоцитов к бластной трансформации под влиянием фитогематтлютинина, стафилококкового эндотоксина и НВsAg. Кроме того, отсутствует способность лейкоцитов к миграции по данным реакции торможения миграции лейкоцитов (РТМЛ), и выявляется резкое увеличение проницаемости мембран лимфоцитов по результатам исследований их с помощью флюоресцентного зонда тетрациклина.
Так, если показатели флюоресценции лимфоцитов здоровых людей составляют 9,9±2%, а при типичном гепатите В с доброкачественным течением они повышаются до 22,3±2,7%, то при злокачественных формах число флюоресцирующих лимфоцитов достигает в среднем 63,5±5,8%. Поскольку повышение проницаемости клеточных мембран однозначно оценивается в литературе как достоверный показатель их функциональной неполноценности, можно заключить, что при гепатите В, особенно при злокачественной форме, возникает грубое повреждение лимфоцитов. Об этом же свидетельствуют и показатели К-клеточной цитотоксичносги. При тяжелой форме на 1-2-й неделе заболевания цитотоксичность составляет 15,5±8,8%, а при злокачественной форме на 1-й неделе — 6.0±2,6, на 2-й — 22.0±6,3% при норме 44,8±2,6%.
Представленные данные однозначно свидетельствуют о выраженных нарушениях в клеточном звене иммунитета у больных с тяжелыми формами гепатита В. Очевидно также, что эти изменения возникают вторично, в результате поражения иммунокомпетентных клеток токсическими метаболитами и, возможно, циркулирующими иммунными комплексами.
Как показали исследования, у больных с тяжелыми формами гепатита В, особенно в случае развития массивного некроза печени, в сыворотке крови происходит падение титра HВsАg и НВeАg и одновременно начинают обнаруживаться в высоких титрах антитела к поверхностному антигену, что совершенно нехарактерно для доброкачественных форм болезни, при которых анти-НВV появляются лишь на 3-5-м месяцев болезни.
Быстрое исчезновение антигенов вируса гепатита В при одновременном появлении высоких титров противовирусных антител позволяет предполагать интенсивное образование иммунных комплексов и возможное их участие в патогенезе развития массивного некроза печени.
Таким образом, фактические материалы не позволяют однозначно трактовать гепатит В только с позиций иммунопатологической агрессии. И дело не только в том, что при этом не обнаруживается связи между глубиной и распространенностью морфологических изменений в печени, с одной стороны, и выраженностью клеточных факторов иммунитета — с другой. Теоретически это обстоятельство можно было бы объяснить поздними сроками исследования показателей клеточного иммунитета, когда иммунокомпетентные клетки подверглись мощному токсическому воздействию в связи с нарастающей функциональной недостаточностью печени. Можно, конечно, допустить, что иммунный цитолиз гепатоцитов происходит на самых ранних этапах инфекционного процесса, возможно, еще до появления клинических симптомов тяжелого поражения печени. Однако такое предположение маловероятно, поскольку у больных с острейшим (молниеносным) течением болезни выявлялись аналогичные показатели клеточного иммунитета и, кроме того, при морфологическом исследовании ткани печени не обнаруживалось массивной лимфоцитарной инфильтрации, в то же время выявлялись сплошные поля некротизированного эпителия без явлений резорбции и лимфоцитарной агрессии.
Объяснить морфологическую картину при остром гепатите только с позиций иммунного клеточного цитолиза весьма сложно, поэтому в ранних работах не исключали цитотоксическое действие вируса гепатита В.
В настоящее время это предположение нашло частичное подтверждение благодаря открытию вируса гепатита В. Как показали исследования, частота обнаружения маркеров гепатита D находится в прямой зависимости от тяжести заболевания: при легкой форме они обнаруживаются у 14%, среднетяжелой — у 18, тяжелой — 30, злокачественной — у 52% больных. Учитывая, что вирус гепатита D обладает некрозогенным цитопатическим эффектом, можно считать установленным, что в развитии фульминантных форм гепатита В большое значение имеет коинфекция вирусами гепатита В и D.
Патогенез гепатита В можно представить следующим образом. После проникновения вируса гепатита В в гепатоциты индуцируется иммунологическая атака на инфицированные гепатоциты Т-киллеров, выделяющих лимфотоксины в направлении печеночных клеток.
Интимные механизмы поражения гепатоцигов при гепатите В до настоящего времени не установлены. Ведущую роль играют активированные процессы перекисного окисления липидов и лизосомальные гидролазы. Пусковым моментом могут быть лимфотоксины, высвобождающиеся из эффекторных клеток при их контакте с гепатоцитами, но не исключено, что инициатором процессов переоксидации может выступать и сам вирус. В дальнейшем патологический процесс вероятнее всего развивается в следующей последовательности.
- Взаимодействие фактора агрессии (лимфотоксины или вирус) с биологическими макромолекулами (возможно, с компонентами мембран эндоплазматической сети, способными принимать участие в процессах детоксикации, по аналогии с другими повреждающими агентами, как это было показано по отношению к четыреххлористому углероду).
- Образование свободных радикалов, активация процессов перекисного окисления липидов и повышение проницаемости всех гепатоцеллюлярных мембран (синдром цитолиза).
- Движение биологически активных веществ по градиенту концентрации — потеря ферментов различной внутриклеточной локализации, донаторов энергии, калия и др. Накопление в клетках натрия, кальция, сдвиг pH в сторону внутриклеточного ацидоза.
- Активация и выход лизосомальных гидролаз (РНК-аза, ДНК-аза, катепсины и др.) с распадом печеночной клетки и высвобождением аутоантигенов.
- Стимуляция Т- и В-систем иммунитета с формированием специфической сенсибилизации Т-лимфоцитов к печеночному липопротеину, а также образование противопеченочных гуморальных аутоантител.
В предложенной схеме патогенеза гепатита В в качестве пускового фактора выступают вирусные антигены, чья интенсивная продукция наблюдается на самых ранних этапах заболевания и весь острый период, за исключением злокачественных форм, при которых продукция вирусных антигенов практически прекращается в момент развития массивного некроза печени, что и предопределяет быстрое снижение репликации вируса.
Очевидно также, что вирусные антигены активируют Т- и В-системы иммунитета. В ходе этого процесса возникает характерное перераспределение субпопуляций Т-лимфоцитов, направленное на организацию адекватного иммунного ответа, элиминацию инфицированных гепатоцитов, нейтрализацию вирусных антигенов, саногенез и выздоровление
При взаимодействии иммунокомпетентных клеток с вирусными антигенами на мембранах гепатоцитов или в ходе репродукции вируса внутри гепатоцита, возникают условия для активации процессов перекисного окисления липидов, управляющий как известно, проницаемостью всех клеточных и субклеточных мембран,
С этих позиций становится понятным столь закономерное и в высшей степени характерное для вирусных гепатитов возникновение синдрома цитолиза — повышенной проницаемости клеточных мембран
Конечным исходом синдрома цитолиза может быть полное разобщение окислительного фосфорилирования, истечение материала клетки, гибель печеночной паренхимы.
Однако в подавляющем большинстве случаев эти процессы не приобретают столь фатального развития. Только при злокачественных формах болезни патологический процесс протекает лавинообразно и необратимо, поскольку возникают массивное заражение, выраженный иммунный процесс, чрезмерная активация процессов переоксидации и лизосомальных гидродаз, явления аутоиммунной агрессии.
Эти же механизмы наблюдаются и при благоприятном течении гепатита В, с той лишь особенностью, что все они реализуются на качественно ином уровне. В отличие от случаев массивного некроза печени, при благоприятном течении болезни количество инфицированных гепатоцитов, а следовательно, зона иммунопатологического цитолиза меньше, процессы перекисного окисления липидов усиливаются не столь значительно, активация же кислых гидролаз приводит лишь к ограниченному аутолизу с несущественным высвобождением аутоантигенов, а следовательно, без массивной аутоагрессии, то есть все этапы патогенеза при благоприятном течении осуществляются в рамках сохраняющейся структурной организации паренхимы печени и сдерживаются защитными системами (антиоксиданты, ингибиторы и др.) и поэтому не имеют столь разрушительного действия.
Причины возникновения симптомов интоксикации при вирусных гепатитах исследованы не до конца. Предложение различать так называемую первичную, или вирусную, интоксикацию и вторичную (обменную, или метаболическую) можно считать позитивным, хотя это не раскрывает интимного механизма возникновения общетоксического синдрома. Во-первых, вирусы гепатитов не обладают токсическими свойствами, а, во-вторых, концентрация многих метаболитов далеко не всегда коррелирует с тяжестью заболевания и степенью выраженности симптомов токсикоза. Известно также, что и концентрация вирусных антигенов строго не коррелирует с тяжестью интоксикации. наоборот, с увеличением тяжести заболевания, а следовательно, нарастания степени токсикоза, концентрация НВsАg снижается и бывает самой низкой при злокачественных формах в момент возникновения глубокой печеночной комы. Вместе с тем частота обнаружения и титры специфических противовирусных антител прямо зависят от тяжести заболевания.
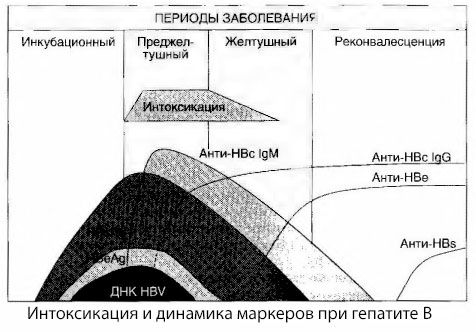
Интоксикация появляется не в момент регистрации вирусных антигенов, а в периоде циркуляции в крови противовирусных антител класса IgМ к коровскому антигену и антигену системы E. Более того, при тяжелых и особенно злокачественных формах у значительной части больных в крови появляются даже анти-НВs, чего обычно никогда не наблюдается при легких и среднетяжелых формах болезни.
Представленные данные дозволяют заключить, что синдром токсикоза при вирусных гепатитах, и гепатите В в частности, не возникает в результате появления в крови вирусных антигенов, а становится следствием взаимодействия вирусных антигенов с противовирусными антителами класса IgМ. Результат такого взаимодействия, как известно, — образование иммунных комплексов и, возможно, активных токсичных веществ.
Симптомы интоксикации возникают в момент появления в свободной циркуляции иммунных комплексов, но в дальнейшем такой корреляции не прослеживается.
Частичное объяснение этому можно найти при исследовании состава иммунных комплексов. У больных с тяжелыми формами в крови циркулируют преимущественно комплексы среднего размера, а в их составе на высоте токсического синдрома преобладают антитела класса тогда как в периоде спада клинических проявлений и реконвалесценции комплексы становятся более крупными, а в их составе начинают преобладать антитела класса IgG.
Представленные данные касаются механизмов развития токсического синдрома в начальном периоде заболевания, но при токсикозе, возникающем на высоте клинических проявлений, они имеют лишь частичное значение и особенно — при развитии печеночной комы.
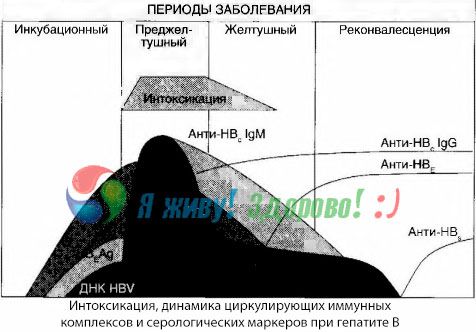
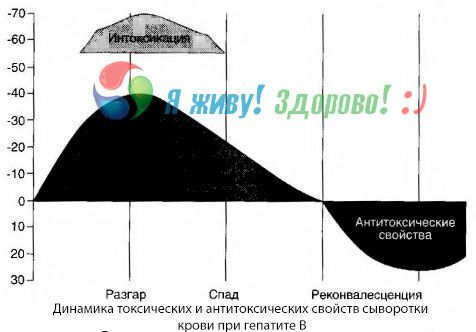
Методом гемокультур удалось показать, что при гепатите В в крови постоянно накапливаются токсины, высвобождающиеся из пораженной распадающейся печеночной ткани. Концентрация этих токсинов пропорциональна тяжести заболевания,они имеют белковую природу.
В периоде реконвалесценции в крови появляются антитела к этому токсину; но в случае возникновения печеночной комы концентрация токсина в крови резко возрастает, а антитела в крови не обнаруживаются.
Источник
Гепатит В –
инфекционное заболевание человека,
характеризуется избирательным поражением
печени и вызывается гепадновирусом
(семейство Hepadnaviridae,
род
Orthohepadnavirus).
Морфология
и структура.
Вирионы гепатита В человека имеют
сферическую форму, диаметр 42 нм, кубический
тип симметрии, состоят из 180 капсомеров.
Геном образует кольцевая двухнитевая
молекула ДНК, состоящая из 3200 нуклеотидов,
но ее «плюс»-нить на 20-50% короче
«минус»-нити. Полный вирион состоит из
внешней липид-гликопротеидной оболочки
(суперкапсид), включающей белковые
молекулы, несущие поверхностный АГ –
HBs АГ
(рис.32).
Суперкапсид HВV
состоит из главного или основного
S-белка, среднего М-белка и большого или
длинного L-белка; имеется внутренний
нуклеокапсид (ядро) диаметром 25-27 нм,
фермент ДНК-полимераза и HBc
АГ, который
содержится в сердцевине вирионов. При
протеолитическом гидролизе белка
капсида образуется полипептид – НВе
АГ – который
отщепляется от НВс АГ при прохождении
его через мембрану гепатоцитов и
обнаруживается в крови.
В
составе поверхностного HBs АГ имеется
один общий АГ а
и две пары взаимоисключающих детерминант
d/у
и w/r.
Известны геномы HВV четырех основных
субтипов, названные по сочетанию АГных
эпитопов HBs Аg: adw,
ayw,
adr,
ayr.
АГы обеспечивают формирование общего
перекрестного иммунитета ко всем
субтипам вируса. Субтипы вируса имеют
различное распространение в регионах
мира. HBs АГ, его полипептидный фрагмент
preS2,
играет важную роль в прикреплении вируса
к гепатоцитам за счет связывания их с
альбуминовым рецептором. Полипептид
preS1
обладает иммуногенными свойствами и
используется для приготовления вакцины.
В зараженной клетке HBs АГ синтезируется
в цитоплазме и участвует в сборке
вирионов. Наряду с полными вирионами
(частицами Дейна) в сыворотке инфицированных
лиц присутствует свободный HBs Аg в виде
сферических частиц диаметром 20-22 нм или
волокнистых образований до 200 нм. Эти
частицы не содержат вирусной ДНК и
являются неинфекционными. Ядерный АГ
HBс АГ в свободной форме локализован в
ядре гепатоцитов и экспрессируется на
поверхности зараженных гепатоцитов,
на которых и может быть обнаружен, но
не выявляется в сыворотке крови больного.
При попадании HBс
АГ в кровь он трансформируется в HBе АГ,
что свидетельствует о высокой инфекционной
опасности больного.
HBх АГ
менее изучен. Считают, что он имеет
отношение к раковой трансформации
гепатоцитов.
Резистентность.Вирус
гепатита В обладает высокой устойчивостью
к температуре, выдерживает кипячение
в течение 15-20 минут, 600С
– несколько часов, в комнатной температуре
сохраняет жизнеспособность в течение
3 месяцев, в замороженном виде – несколько
лет. Вирус погибает при обработке 3%
Н2О2,
5% хлорамином, при УФ-облучении, при
обработке сухим жаром при 180°С в течение
60 минут.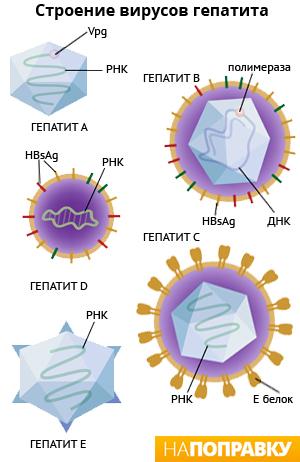
Эпидемиология.
Источником заражения является больной
человек и вирусоноситель. Заражение
может происходит при медицинских
манипуляциях, при переливании крови;
при половом контакте, плод может
заражаться трансплацентарно или через
инфицированные пути матери. Инфицирование
возможно через зубные щетки.
Репродукция.
Вирус гепатита В не репродуцируется в
культурах клеток и куриных эмбрионах.
Репликация происходит в ядрах гепатоцитов.
Она является весьма сложной и состоит
из нескольких этапов. Первоначально
ДНК-полимераза достраивает короткую
(+)цепь ДНК до полной молекулы. Эта ДНК
проникает в ядро клетки, где с нее
синтезируется РНК-копия, получившая
название прегенома.
После этого вирусная ДНК-полимераза
начинает строить на матрице РНК прегенома
его ДНК-копию (обратная транскрипция).
Прегеном одновременно разрушается. Эта
ДНК может встраиваться в геном гепатоцита
(интегративная инфекция). С
вирусного генома транслируется информация
для синтеза на рибосомах гепатоцитов
HBs АГ, HBе АГ, капсидных белков,
вирусспецифических ферментов. Новая
вирусная частица выходит из гепатоцита
(рис. 33). Наряду с вновь образованными
вирусными частицами из инфицированной
клетки высвобождаются также «пустые»
вирусные частицы, содержащие HBs АГ и HBе
АГ. При типичной острой форме гепатита
В в крови появляются HBs АГ, HBе АГ, и АТ
IgM, IgG анти-HBс АГ, анти-HBе АГ и анти-HBs АГ.
Патогенез и
клиника.
Входными путями служат кровеносные
сосуды слизистых оболочек. Вирус попадает
в кровь, заносится в печень и фиксируется
на гепатоцитах. Вирус не обладает
цитопатогенным действием, поэтому
патологический процесс в печени возникает
не с момента внедрения возбудителя в
гепатоциты, а только после распознования
иммуноцитами его АГов на клеточной
мембране, которые индуцируют появление
аутоантител и Т-киллеров к клеткам
печени. Поэтому развивающийся хронический
гепатит и цирроз печени можно рассматривать
как аутоиммунное заболевание.
При развитии
иммунного ответа, представленные на
мембране макрофагов вирусные АГы
индуцируют гуморальный ответ, при
котором образуются АТ IgM и IgG-классов к
HBs АГ, HBс АГ, HBе АГ. Одновременно появляются
АГспецифические Т-киллеры, разрушающие
гепатоциты, на месте которых развивается
соединительная ткань, печень подвергается
склерозу, функция ее нарушается.
Инкубационный
период длится от 30 дней до 6 месяцев.
Болезнь может протекать в латентной
форме, выявляемой только лабораторными
методами, в типичной желтушной форме и
тяжелой («фульминантной») форме,
заканчивающейся летально от печеночной
недостаточности. На фоне увеличения
сывороточных аланиновой и аспарагиновой
аминотрансфераз у 30% взрослых больных
развивается желтуха, которая сохраняется
несколько недель, реже несколько месяцев.
В разгар заболевания и до 8 недель после
него определяются HBs АГ и HBе АГ. Почти
одновременно начинается продукция АТ
к HBс.
Опасность
представляет переход болезни в хроническую
форму, который возможен у 15% взрослых
больных и до 90% новорожденных от больных
матерей. В свою очередь, хронический
В-гепатит является фактором риска
развития цирроза и гепатоцеллюлярной
карциномы.
Лабораторная
диагностика
Для диагностики
применяют определение АГ и АТ в ИФА,
РИА, ПЦР:
—
НВs АГ –
основной маркер острой или хронической
формы инфекции, а также вирусоносительства;
— ДНК НВV –
непосредственный показатель инфицирования
НВV, свидетельствует о репликации вируса;
— Нbе
АГ – маркер острой формы гепатита,
кратковременно выявляемый в крови; его
сохранение более 2 месяцев служит
признаком развития хронического
гепатита;
— IgМ АТ анти-НВс –
главный маркер острой формы заболевания;
— АТ анти-НВs,
анти-НВс, анти-НВе – маркеры завершения
острой формы инфекции, указывающие на
формирование иммунитета к НВV; наличие
только IgG анти-НВs АГ может быть результатом
предшествующей вакцинации или ранее
перенесенной инфекции.
Cпецифическая
профилактика.
Вакцины получены геноинженерным путем,
содержат НВs АГ. По рекомендации ВОЗ
прививки против гепатита В являются
обязательными и должны проводиться
детям на первом году жизни. Используют
генноинженерную вакцину (например,
«Engerix
B»),
в которой использован рекомбинантный
клон дрожжей, содержащий ген НВs+
и вырабатывающий HBs АГ. Полный курс
прививки состоит из 3 инъекций: 1 доза –
сразу после рождения, 2 доза – через 1-2
месяца, 3 доза – до конца 1-го года жизни.
Вакцинировать
необходимо также лиц, которые имеют
повышенный риск инфекции: персонал
медицинских учреждений, больных, которым
проводилось переливание крови и др. Для
экстренной пассивной иммунопрофилактики
используют гамма-глобулин.
Для леченияинтерферон, ингибитор обратной
транскрипции ламивудин, а также
глюкокортикостероиды.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник

