Механизм гибели гепатоцитов при вирусном гепатите
Комментарии
Опубликовано в:
Вирусные гепатиты: Достижения и перспективы
Информационный бюллетень
А. О. Буеверов, Клиника пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко, Московская медицинская академия им. И.М. Сеченова
Численность популяции клеток в организме связана с двумя противоположно направленными процессами: митотическим размножением и гибелью клеток. Длительное время значение гибели клеток недооценивалось, однако в последнее время интерес к механизмам ее реализации значительно повысился, и эта проблема стала одной из наиболее интенсивно изучаемых областей биологии. На сегодняшний день установлено, что нарушение контроля клеточной гибели ведет к сдвигам гомеостаза и развитию различных патологических состояний.
На клеточном уровне постоянно протекающие деление и рост должны сопровождаться альтернативным процессом удаления старых, поврежденных, мутировавших и других нежелательных для организма клеток. Высокорегулируемую форму программированной смерти клетки с характерными морфологическими и биохимическими признаками определяют как апоптоз (греческое слово, соответствующее русскому «листопаду»: аро — отделение, ptosis — падение).
Апоптозу принадлежит важнейшая роль как в физиологических, так и в патологических условиях, ввиду того, что и подавление, и неадекватное усиление апоптоза ведет к патологическим изменениям органов и тканей. В то время как избыточная активация апоптоза, наблюдаемая, в частности, при инфицировании клеток печени гепатотропными вирусами, обусловливает разрушение печеночной ткани, ослабление апоптотической гибели клеток (вызванное, к примеру, мутацией гена, кодирующего проапоптогенный белок р53) служит одним из важнейших факторов канцерогенеза.
Что касается гепатита, наиболее важным диагностическим и прогностическим признаком при многих его формах считается некроз паренхимы, который, однако, значительно отличается от типичных признаков омертвения, наблюдаемых морфологом в других органах. Прежде всего в ткани печени отсутствуют некротизированные гепатоциты, а видны лишь участки печеночной дольки, замещенные мононуклеарными инфильтратами. Вторая особенность — отсутствие полиморфноядерных лейкоцитов (за исключением острого алкогольного гепатита) -стереотипной реакции на некроз во всех тканях. Следовательно, в большинстве случаев хронического поражения печени, в том числе при инфекции гепатотропными вирусами, основным механизмом гибели клеток служит апоптоз. За много лет до открытия апоптоза был описан характерный гистологический признак вирусного гепатита — округлые гомогенные эозинофильные образования, часто содержащие пикнотичное ядро. Эти образования, названные тельцами Каунсильмена, представляют собой не что иное, как гепатоциты в состоянии апоптоза [2]. Кардинальные отличия апоптоза от некроза приведены в таблице 1.
Таблица 1. Основные характеристики апоптоза и некроза
Апоптоз | Некроз |
Физиологический или патологический | Только патологический |
Регулируемый | Нерегулируемый или |
Плазматическая мембрана | Плазматическая мембрана |
Инфильтрация полиморфноядерными | Лейкоцитарная инфильтрация |
Кариопикноз, кариорексис, | Набухание (онкоз) цитоплазмы |
Образование апоптозных телец | Разрушение |
Первая стадия апоптоза — лиганд-рецепторное взаимодействие. Представление о функционировании рецепторов клеточной гибели служит теоретической базой для разработки оптимальной стратегии патогенетического лечения различных заболеваний, в том числе вирусных гепатитов.
Рецепторы клеточной гибели включают Fas-peцептор (Fas-R), TNF-R1, TNF-R2, «рецептор смерти-3» (DR-3) и 4 так называемых TNF-ассоциированных апоптоз-индуцирующих лиганд-рецептора [5]. Наиболее хорошо среди них изучены Fas-R и TNF-R1.
Fas-R (APO-1/CD95) экспрессируется в печени на гепатоцитах, холангиоцитах, активированных звездчатых ретикулоэндотелиоцитах и клетках Купфера и существует в мембраноассоциированной и растворимой формах. Растворимая форма Fas-R, вероятно, служит для связывания Fas-лиганда (Fas-L) не только на СD8+-цитотоксических лимфоцитах и NK-клетках, но и СD4+-Т-лимфоцитах-хелперах 1-го типа, которые, как было недавно установлено, также могут проявлять цитотоксические свойства [I]. Связывание Fas-L растворимым Fas-R уменьшает повреждение печени цитотоксическими иммунными клетками. Это подтверждается экспериментом S. Krams по инъекции мышам антител к Fas-R, что приводило к смерти животных от фульминантной печеночной недостаточности [8].
Экспрессия Fas-R на мембране гепатоцитов индуцируется рядом провоспалительных цитокинов, таких как интерлейкины (ИЛ-1, -2, -6), интерфероны (ИФН-γ), факторы некроза опухоли (TNF-α) и др. Таким образом, вероятно, что воспаление любой природы может способствовать Fas-R-зависимому повреждению печени. Более того, цитокины стимулируют увеличение количества молекул Fas-L на Т- и NK-лимфоцитах. Интересные данные были получены в работе, в которой культура.крысиных гепатоцитов подвергалась воздействию активированных ИЛ-2 NK-клеток и экспериментальных ингибиторов каспаз. Подавление активности каспаз предотвращало апоптоз гепатоцитов, но при этом усиливалась их гибель посредством некроза, что указывает на определенный баланс между этими путями элиминации клеток, осуществляемыми иммунной системой [5].
Связывание Fas-R ведет к его олигомеризации и активации адапторного белка FADD, что в свою очередь вызывает активацию специфического протеолитического фермента каспазы 8; этот ступенчатый процесс представляет собой основной механизм инициации как физиологического,так и патологического апоптоза клеток печени. На этом этапе дальнейшее развитие апоптоза может быть заблокировано активацией ряда факторов, таких как I-FLICE (эндогенная доминантно-негативная форма каспазы 8), bcl-2 и т.н. Х-связанные ингибиторы апоптоза [1, 2, 5].
Внутриклеточный домен TNF-R1 также интенсивно экспрессируется на гепатоцитах и клетках Купфера. Его экспрессия резко повышается при гепатите любой этиологии (вирусный, алкогольный, аутоиммунный и др.). Исследования F. Su и соавторов [10] продемонстрировали, что НВх-протеин вируса гепатита В сенсибилизирует культуру гепатоцитов к TNF-α-индуцированной цитотоксичности. Персистенция HBsAg также сенсибилизирует гепатоцит к TNF-опосредованному апоптозу.
Апоптоз, индуцированный связыванием TNF-α с TNF-R1, подобно взаимодействию Fas-R — Fas-L, требует олигомеризации рецептора и может осуществляться через путь FADD — каспаза 8, а также сходный с ним белок TRADD. Интересно, что гиперэкспрессия TRADD ведет не только к запуску процессов апоптоза, но и к активации ядерного фактора кВ (NFKB), который предотвращает TNF-индуцированную гибель клетки [2, 5].
Следует заметить, что даже в здоровой печени NK- и CD8+-T-лимфoциты печеночных синусоидов содержат больше мРНК ИЛ-15, -18, TNF-α, ИФН-γ по сравнению с периферическими клетками, что свидетельствует о повышенной готовности к осуществлению апоптоза гепатоцитов в случае возникновения их изменений, например, при инфицировании вирусом [7].
Экспрессия Fas-R существенно повышена на мембране гепатоцитов, инфицированных вирусами В и С, и тесно коррелирует с их гистологической активностью [б]. При вирусном гепатите апоптоз может быть как результатом прямого воздействия вируса, так и опосредованным иммунной реакцией. Запуск процессов апоптоза при проникновении в гепатоцит вируса следует рассматривать как своего рода защитный механизм, так как в мертвой клетке репликация вируса становится невозможной. Поэтому «в интересах» вируса — подавить апоптоз и сохранить клетки жизнеспособными. И действительно, некоторые кодируемые вирусами белки обладают антиапоптозной активностью, которая осуществляется подавлением функции проапоптогенного белка р53, инактивацией каспаз, а также усиленной экспрессией мощного ингибитора апоптоза bcl-2. Интересно, что в норме bcl-2 обнаружен в печени только в эпителии желчных протоков, постоянно контактирующих с желчью, но не в гепатоцитах [2].
Однако чаще причиной апоптоза при инфекции гепатотропными вирусами служит не прямое цитотоксическое действие вируса, а иммунная реакция NK- и Т-лимфоцитов на его антигены, расположенные на поверхности инфицированных гепатоцитов.
Т-лимфоциты могут вызывать апоптоз в клетках печени двумя путями. Первый реализуется за счет выброса из Т-клеток перфорина, который образует поры в плазматических мембранах гепатоцитов. Через них в клетки проникают гранзимы — протеазы Т-лимфоцитарных гранул, вызывающие расщепление ряда внутриклеточных ферментов, в том числе каспаз, запускающих апоптозный каскад.
Второй путь осуществления апоптоза под воздействием активированных Т-лимфоцитов связан с рассматривавшимся выше взаимодействием Fas-R -Fas-L (см. рисунок). Как уже упоминалось, Fas-R усиленно экспрессируется на мембране инфицированных гепатотропными вирусами гепатоцитов, но особенно часто их обнаруживают на гепатоцитах, окруженных лимфоцитами на границе ступенчатого некроза и паренхимы [6]. В свою очередь, на соответствующих лимфоцитах выявляется повышенная экспрессия Fas-L. О связи экспрессии Fas и последующего апоптоза с действием вируса гепатита С свидетельствует и то, что после успешного лечения а-интерфероном количество Fas-положительных клеток резко уменьшается и коррелирует как со снижением активности трансаминаз, так и с уменьшением выраженности портальной и лобулярной лимфоидной инфильтрации ткани печени [9]. Наконец, продуцируемый преимущественно макрофагами в избыточных количествах TNF-α также ведет к апоптозу клеток путем взаимодействия с соответствующим рецептором.
Рис. 1. Элиминация инфицированного гепатоцита цитотоксическим Т-лимфоцитом.
(ЦТЛ- цитотоксический Т-лимфоцит)
Понимание механизмов, ведущих к апоптозу клеток печени, в том числе при хроническом вирусном гепатите, позволит разработать новые методы терапии, в частности, уменьшающие избыточную гибель гепатоцитов. Одним из направлений в этой области может служить разработка ингибиторов т.н. проксимальных каспаз (2, 8, 10).
В заключение хотелось бы отметить, что, являясь универсальным биологическим механизмом, апоптоз при вирусных гепатитах может приводить к избыточной гибели не только гепатоцитов, но и других клеточных популяций, отражая либо системный иммуновоспалительный ответ на инфекцию, либо внепеченочную персистенцию вируса. В связи с этим определенный интерес представляют наши исследования апоптоза периферических лейкоцитов при хроническом гепатите. У больных хроническими гепатитами В и С и у здоровых доноров определялось количество лимфоцитов и гранулоцитов периферической крови в состоянии апоптоза непосредственно после выделения и после 24-часовой инкубации в культуральной среде методом проточной цитофлюориметрии, а также повреждение ДНК по скорости щелочной денатурации. Даннные исследования показали, что апоптоз как лимфоцитов, так и гранулоцитов был достоверно выше у больных ХГВ по сравнению с контролем как непосредственно после выделения, так и после суточной инкубации. Более интенсивный переход клеток в апоптоз наблюдался в подгруппе больных гепатитом С, хотя здесь следует учитывать роль разного количества пациентов в подгруппах (12с гепатитом В, 22 с гепатитом С). Выявлена также корреляция между степенью повреждения ДНК лимфоцитов и гранулоцитов и накоплением клеток в состоянии апоптоза после инкубации [3]. Помимо этого, после суточной инкубации количество лейкоцитов обеих популяций в апоптозе достоверно коррелировало с сывдроточной концентрацией TNF-α [4].
Полученные результаты свидетельствуют об усилении программированной гибели клеток периферической крови у больных хроническим вирусным гепатитом, что может отражать как повреждающее действие гепатотропных вирусов на лейкоциты (или их костномозговые предшественники), так и влияние системного действия провоспалительных цитокинов. Косвенным подтверждением последнего механизма служит корреляция интенсивности апоптоза с сывороточным уровнем TNF-α — наиболее мощного цитокина с проапоптогенным эффектом.
Литература
1. Аббасова С.Г., Липкин В.М., Трапезников Н.Н., Кушлинский Н.Е. Система FAS — FASL в норме и патологии // Вопр. биол., мед., фарм. химии. — 1999. — №3.-С.3-17.
2. Аруин Л.И. Апоптоз и патология печени // Росс. ж. гастроэнтерол., гепатол., колопроктол. — 1998. — №2. — С. 6-10.
3. Буеверов А.О., Тихонина Е.В., Москалева Е.Ю. и др. Апоптоз периферических лейкоцитов при хронических вирусных гепатитах // Росс. ж. гастроэнтерол., гепатол., колопроктол. — 2000. — №6. — С. 30-33.
4. Boueverov A.O., Mammaev S.N., Tikhonina E.V. et al. Enchanced apoptosis of peripheral blood leucocytes in chronic viral hepatitis // Gut. — 2000. — Vol.47 (suppl. 3). — A 181.
5. Faubion W.A., Gores G.J. Death receptors in liver biology and pathobiology // Hepatology. — 1999. — Vol.29. — P. 1-4.
6. Hayashi N., Mita E. Fas system and apoptosis in viral hepatitis//J. Gastroenterol. Hepatol. — 1997.-Vol.l2. — S.223-226.
7. Jonsson J.R., Edwards-Smith C.J., Catania S.C. et al. Expression of cytokines and factors modulating apoptosis by human sinusoidal leucocytes // J. Hepatol. — 2000. — Vol.32. -P.392-398.
8. Krams S.M., Fox S.K., Beatty P.R. et al. Human hepatocytes produce an isoform of FAS that inhibits apoptosis // Transplantation. — 1998. — Vol.65. — P.713-721.
9. Okazaki M., Hino K., Fujii К et al. Hepatic Fas-antigen expression before and after interferon therapy in patients with chronic hepatitis С // Dig. Dis. Sci. — 1996. — Vol.41. — P.2453-2458.
10. Su F, Schneider R.J. Hepatitis В virus HBx protein sensitizes cells to apoptotic killing by tumor necrosis factor alpha // Proc. Nat. Acad. Sci. USA. — 1997. — Vol.94. — P.8744-9.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
В патогенезе гепатита В можно выделить несколько ведущих звеньев патогенетической цепи:
- внедрение возбудителя — заражение;
- фиксация на гепатоците и проникновение внутрь клетки;
- размножение вируса и «выталкивание» его на поверхность гепатоцита, а также в кровь;
- включение иммунологических реакции, направленных на элиминацию возбудителя;
- иммунокомплексное поражение органов и систем;
- формирование иммунитета, освобождение от возбудителя, выздоровление.
Поскольку заражение при гепатите В всегда происходит парентеральным путем, можно считать, что момент инфицирования практически равнозначен проникновению вируса в кровь. Попытки некоторых исследователей выделять при гепатите В энтеральную и региональную фазу малообоснованы. Больше оснований считать, что с током крови вирус сразу попадает в печень.
Тропизм вируса гепатита В к ткани печени предопределен наличием в составе НВsАg специального рецептора — полипептида с молекулярной массой 31 000 Да (РЗ1), обладающего альбумин связывающей активностью. Аналогичная зона альбумина находится и на мембране гепатоцитов печени человека и шимпанзе, чем по существу и определяется тропизм НВV к печени человека и шимпанзе.
При проникновении вируса внутрь гепатоцита происходит высвобождение вирусной ДНК, которая, попадая в ядро гепатоцита и исполняя роль матрицы для синтеза нуклеиновых кислот, запускает ряд последовательных биологических реакций, чьим итогом становится сборка нуклеокапсида вируса. Нуклеокапсид мигрирует через ядерную мембрану в цитоплазму где и происходит окончательная сборка частиц Дейна — полного вируса гепатита В.
Следует, однако, отметить, что при заражении гепатоцита процесс может пойти двумя путями — репликативным и интегративным. В первом случае развивается картина острого или хронического гепатита, а во втором — вирусоносительство.
Причины, предопределяющие два вида взаимодействия вирусной ДНК и гепатоцита, точно не установлены. Вероятнее всего, тип реагирования генетически детерминирован.
Итогом репликативного взаимодействия становятся сборка структур коровского антигена (в ядре) и сборка полного вируса (в цитоплазме) с последующей презентацией полного вируса или его антигенов на мембране или в структуре мембраны гепатоцитов.
Принято считать, что репликация вируса не приводит к поражению клетки на уровне гепатоцита, поскольку вирус гепатита В не обладает цитопатическим действием. Это положение нельзя считать бесспорным, так как оно основывается на экспериментальных данных, которые, хотя и свидетельствуют об отсутствии цитопатического действия вируса гепатита В, но получены на культурах тканей и поэтому не могут быть полностью экстраполированы на вирусный гепатит В у человека. Во всяком случае, вопрос об отсутствии поражения гепатоцитов в ходе репликативной фазы нуждается в дополнительном изучении.
Однако, независимо от характера взаимодействия вируса с клеткой, в дальнейшем печень обязательно включается в иммунопатологический процесс. При этом поражение гепатоцитов связано с тем, что в результате экспрессии вирусных антигенов на мембране гепатоцитов и выхода вирусных антигенов в свободную циркуляцию происходит включение цепи последовательных клеточных и гуморальных иммунных реакций, направленных в конечном итоге на удаление вируса ил организма. Этот процесс осуществляется в полном соответствии с общими закономерностями иммунного ответа при вирусных инфекциях. Для элиминации возбудителя включаются клеточные цитотоксические реакции, опосредованные различными классами клеток-эффекторов: К-клеток, Т-клеток, естественных киллеров, макрофагов. В ходе этих реакций происходит разрушение инфицированных гепатоцитов, что сопровождается высвобождением вирусных антигенов (НВсАg, НВeАg, НВsАg), запускающих систему антителогенеза, вследствие чего в крови накапливаются специфические антитела, прежде всего к коровому — анти-НВс и е-антигену — анти-НВЕ. Следовательно, освобождение печеночной клетки от вируса происходит в процессе ее гибели за счет реакций клеточного цитолиза.
Одновременно с этим накапливающиеся в крови специфические антитела связывают антигены вируса, образуя иммунные комплексы, фагоцитируемые макрофагами и выделяющиеся почками. При этом могут возникать различные иммунокомплексные поражения в виде гломерулонефрита, артериита, артралгий, кожных высыпаний и др. С участием специфических антител происходит очищение организма от возбудителя и наступает полное выздоровление.
В соответствии с изложенной концепцией патогенеза гепатита В все многообразие клинических вариантов течения болезни принято объяснять особенностями взаимодействия вируса и кооперацией иммунокомпетентных клеток, иначе говоря, силой иммунного ответа на присутствие вирусных антигенов. По современным представлениям, сила иммунного ответа генетически детерминирована и сцеплена с антигенами гистосовместимости локуса НLA первого класса.
Принято считать, что в условиях адекватного иммунного ответа на антигены вируса клинически развивается острый гепатит с циклическим течением и полным выздоровлением. На фоне снижения иммунного ответа к антигенам вируса иммуноопосредованный цитолиз выражен незначительно, поэтому не происходит эффективной элиминации инфицированных клеток печени, что приводит к слабовыраженным клиническим проявлениям с длительной персистенцией вируса и, возможно, развитию хронического гепатита. При этом, наоборот, в случае генетически детерминированною сильного иммунного ответа и массивности инфицирования (гемотрансфузии) возникают обширные зоны поражения печеночных клеток, чему клинически соответствуют тяжелые и злокачественные формы болезни.
Представленная схема патогенеза гепатита В отличается стройностью, тем не менее в ней имеется ряд спорных и малоисследованных моментов.
Если следовать концепции гепатита В как иммунопатологического заболевания, можно было бы ожидать усиления реакций клеточной цитотоксичности с нарастанием тяжести заболевания. Однако, при тяжелых формах показатели клеточного звена иммунитета резко снижены, в том числе отмечается многократное падение, по сравнению с таковыми у здоровых детей, и показателя К-клеточной цитотоксичности. При злокачественной форме в периоде развития массивного некроза печени и особенно печеночной комы отмечается полная неспособность лимфоцитов к бластной трансформации под влиянием фитогематтлютинина, стафилококкового эндотоксина и НВsAg. Кроме того, отсутствует способность лейкоцитов к миграции по данным реакции торможения миграции лейкоцитов (РТМЛ), и выявляется резкое увеличение проницаемости мембран лимфоцитов по результатам исследований их с помощью флюоресцентного зонда тетрациклина.
Так, если показатели флюоресценции лимфоцитов здоровых людей составляют 9,9±2%, а при типичном гепатите В с доброкачественным течением они повышаются до 22,3±2,7%, то при злокачественных формах число флюоресцирующих лимфоцитов достигает в среднем 63,5±5,8%. Поскольку повышение проницаемости клеточных мембран однозначно оценивается в литературе как достоверный показатель их функциональной неполноценности, можно заключить, что при гепатите В, особенно при злокачественной форме, возникает грубое повреждение лимфоцитов. Об этом же свидетельствуют и показатели К-клеточной цитотоксичносги. При тяжелой форме на 1-2-й неделе заболевания цитотоксичность составляет 15,5±8,8%, а при злокачественной форме на 1-й неделе — 6.0±2,6, на 2-й — 22.0±6,3% при норме 44,8±2,6%.
Представленные данные однозначно свидетельствуют о выраженных нарушениях в клеточном звене иммунитета у больных с тяжелыми формами гепатита В. Очевидно также, что эти изменения возникают вторично, в результате поражения иммунокомпетентных клеток токсическими метаболитами и, возможно, циркулирующими иммунными комплексами.
Как показали исследования, у больных с тяжелыми формами гепатита В, особенно в случае развития массивного некроза печени, в сыворотке крови происходит падение титра HВsАg и НВeАg и одновременно начинают обнаруживаться в высоких титрах антитела к поверхностному антигену, что совершенно нехарактерно для доброкачественных форм болезни, при которых анти-НВV появляются лишь на 3-5-м месяцев болезни.
Быстрое исчезновение антигенов вируса гепатита В при одновременном появлении высоких титров противовирусных антител позволяет предполагать интенсивное образование иммунных комплексов и возможное их участие в патогенезе развития массивного некроза печени.
Таким образом, фактические материалы не позволяют однозначно трактовать гепатит В только с позиций иммунопатологической агрессии. И дело не только в том, что при этом не обнаруживается связи между глубиной и распространенностью морфологических изменений в печени, с одной стороны, и выраженностью клеточных факторов иммунитета — с другой. Теоретически это обстоятельство можно было бы объяснить поздними сроками исследования показателей клеточного иммунитета, когда иммунокомпетентные клетки подверглись мощному токсическому воздействию в связи с нарастающей функциональной недостаточностью печени. Можно, конечно, допустить, что иммунный цитолиз гепатоцитов происходит на самых ранних этапах инфекционного процесса, возможно, еще до появления клинических симптомов тяжелого поражения печени. Однако такое предположение маловероятно, поскольку у больных с острейшим (молниеносным) течением болезни выявлялись аналогичные показатели клеточного иммунитета и, кроме того, при морфологическом исследовании ткани печени не обнаруживалось массивной лимфоцитарной инфильтрации, в то же время выявлялись сплошные поля некротизированного эпителия без явлений резорбции и лимфоцитарной агрессии.
Объяснить морфологическую картину при остром гепатите только с позиций иммунного клеточного цитолиза весьма сложно, поэтому в ранних работах не исключали цитотоксическое действие вируса гепатита В.
В настоящее время это предположение нашло частичное подтверждение благодаря открытию вируса гепатита В. Как показали исследования, частота обнаружения маркеров гепатита D находится в прямой зависимости от тяжести заболевания: при легкой форме они обнаруживаются у 14%, среднетяжелой — у 18, тяжелой — 30, злокачественной — у 52% больных. Учитывая, что вирус гепатита D обладает некрозогенным цитопатическим эффектом, можно считать установленным, что в развитии фульминантных форм гепатита В большое значение имеет коинфекция вирусами гепатита В и D.
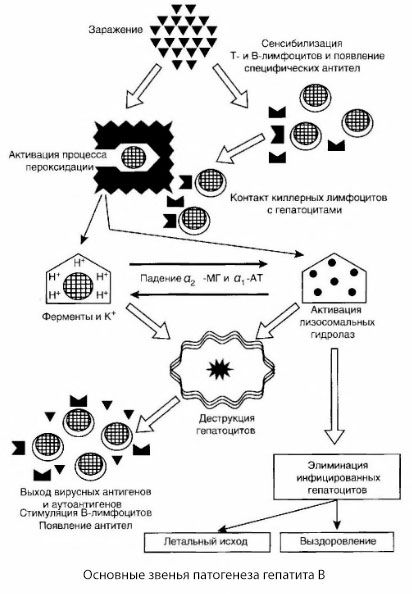
Патогенез гепатита В можно представить следующим образом. После проникновения вируса гепатита В в гепатоциты индуцируется иммунологическая атака на инфицированные гепатоциты Т-киллеров, выделяющих лимфотоксины в направлении печеночных клеток.
Интимные механизмы поражения гепатоцигов при гепатите В до настоящего времени не установлены. Ведущую роль играют активированные процессы перекисного окисления липидов и лизосомальные гидролазы. Пусковым моментом могут быть лимфотоксины, высвобождающиеся из эффекторных клеток при их контакте с гепатоцитами, но не исключено, что инициатором процессов переоксидации может выступать и сам вирус. В дальнейшем патологический процесс вероятнее всего развивается в следующей последовательности.
- Взаимодействие фактора агрессии (лимфотоксины или вирус) с биологическими макромолекулами (возможно, с компонентами мембран эндоплазматической сети, способными принимать участие в процессах детоксикации, по аналогии с другими повреждающими агентами, как это было показано по отношению к четыреххлористому углероду).
- Образование свободных радикалов, активация процессов перекисного окисления липидов и повышение проницаемости всех гепатоцеллюлярных мембран (синдром цитолиза).
- Движение биологически активных веществ по градиенту концентрации — потеря ферментов различной внутриклеточной локализации, донаторов энергии, калия и др. Накопление в клетках натрия, кальция, сдвиг pH в сторону внутриклеточного ацидоза.
- Активация и выход лизосомальных гидролаз (РНК-аза, ДНК-аза, катепсины и др.) с распадом печеночной клетки и высвобождением аутоантигенов.
- Стимуляция Т- и В-систем иммунитета с формированием специфической сенсибилизации Т-лимфоцитов к печеночному липопротеину, а также образование противопеченочных гуморальных аутоантител.
В предложенной схеме патогенеза гепатита В в качестве пускового фактора выступают вирусные антигены, чья интенсивная продукция наблюдается на самых ранних этапах заболевания и весь острый период, за исключением злокачественных форм, при которых продукция вирусных антигенов практически прекращается в момент развития массивного некроза печени, что и предопределяет быстрое снижение репликации вируса.
Очевидно также, что вирусные антигены активируют Т- и В-системы иммунитета. В ходе этого процесса возникает характерное перераспределение субпопуляций Т-лимфоцитов, направленное на организацию адекватного иммунного ответа, элиминацию инфицированных гепатоцитов, нейтрализацию вирусных антигенов, саногенез и выздоровление
При взаимодействии иммунокомпетентных клеток с вирусными антигенами на мембранах гепатоцитов или в ходе репродукции вируса внутри гепатоцита, возникают условия для активации процессов перекисного окисления липидов, управляющий как известно, проницаемостью всех клеточных и субклеточных мембран,
С этих позиций становится понятным столь закономерное и в высшей степени характерное для вирусных гепатитов возникновение синдрома цитолиза — повышенной проницаемости клеточных мембран
Конечным исходом синдрома цитолиза может быть полное разобщение окислительного фосфорилирования, истечение материала клетки, гибель печеночной паренхимы.
Однако в подавляющем большинстве случаев эти процессы не приобретают столь фатального развития. Только при злокачественных формах болезни патологический процесс протекает лавинообразно и необратимо, поскольку возникают массивное заражение, выраженный иммунный процесс, чрезмерная активация процессов переоксидации и лизосомальных гидродаз, явления аутоиммунной агрессии.
Эти же механизмы наблюдаются и при благоприятном течении гепатита В, с той лишь особенностью, что все они реализуются на качественно ином уровне. В отличие от случаев массивного некроза печени, при благоприятном течении болезни количество инфицированных гепатоцитов, а следовательно, зона иммунопатологического цитолиза меньше, процессы перекисного окисления липидов усиливаются не столь значительно, активация же кислых гидролаз приводит лишь к ограниченному аутолизу с несущественным высвобождением аутоантигенов, а следовательно, без массивной аутоагрессии, то есть все этапы патогенеза при благоприятном течении осуществляются в рамках сохраняющейся структурной организации паренхимы печени и сдерживаются защитными системами (антиоксиданты, ингибиторы и др.) и поэтому не имеют столь разрушительного действия.
Причины возникновения симптомов интоксикации при вирусных гепатитах исследованы не до конца. Предложение различать так называемую первичную, или вирусную, интоксикацию и вторичную (обменную, или метаболическую) можно считать позитивным, хотя это не раскрывает интимного механизма возникновения общетоксического синдрома. Во-первых, вирусы гепатитов не обладают токсическими свойствами, а, во-вторых, концентрация многих метаболитов далеко не всегда коррелирует с тяжестью заболевания и степенью выраженности симптомов токсикоза. Известно также, что и концентрация вирусных антигенов строго не коррелирует с тяжестью интоксикации. наоборот, с увеличением тяжести заболевания, а следовательно, нарастания степени токсикоза, концентрация НВsАg снижается и бывает самой низкой при злокачественных формах в момент возникновения глубокой печеночной комы. Вместе с тем частота обнаружения и титры специфических противовирусных антител прямо зависят от тяжести заболевания.
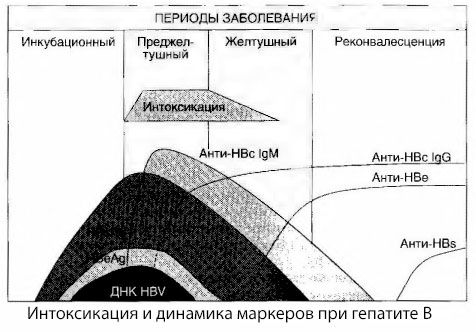
Интоксикация появляется не в момент регистрации вирусных антигенов, а в периоде циркуляции в крови противовирусных антител класса IgМ к коровскому антигену и антигену системы E. Более того, при тяжелых и особенно злокачественных формах у значительной части больных в крови появляются даже анти-НВs, чего обычно никогда не наблюдается при легких и среднетяжелых формах болезни.
Представленные данные дозволяют заключить, что синдром токсикоза при вирусных гепатитах, и гепатите В в частности, не возникает в результате появления в крови вирусных антигенов, а становится следствием взаимодействия вирусных антигенов с противовирусными антителами класса IgМ. Результат такого взаимодействия, как известно, — образование иммунных комплексов и, возможно, активных токсичных веществ.
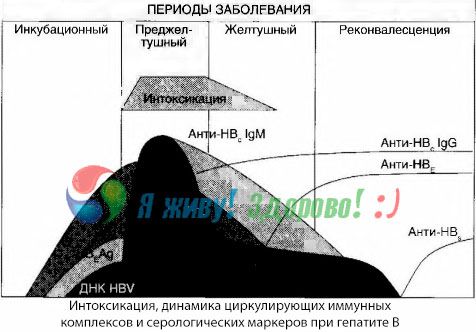
Симптомы интоксикации возникают в момент появления в свободной циркуляции иммунных комплексов, но в дальнейшем такой корреляции не прослеживается.
Частичное объяснение этому можно найти при исследовании состава иммунных комплексов. У больных с тяжелыми формами в крови циркулируют преимущественно комплексы среднего размера, а в их составе на высоте токсического синдрома преобладают антитела класса тогда как в периоде спада клинических проявлений и реконвалесценции комплексы становятся более крупными, а в их составе начинают преобладать антитела класса IgG.
Представленные данные касаются механизмов развития токсического синдрома в начальном периоде заболевания, но при токсикозе, возникающем на высоте клинических проявлений, они имеют лишь частичное значение и особенно — при развитии печеночной комы.
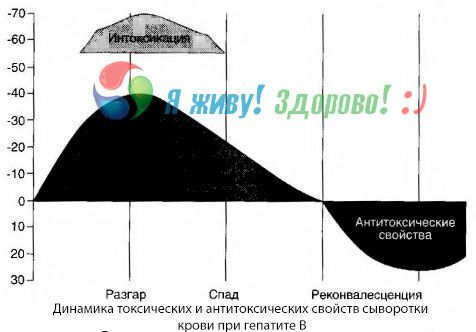
Методом гемокультур удалось показать, что при гепатите В в крови постоянно накапливаются токсины, высвобождающиеся из пораженной распадающейся печеночной ткани. Концентрация этих токсинов пропорциональна тяжести заболевания,они имеют белковую природу.
В периоде реконвалесценции в крови появляются антитела к этому токсину; но в случае возникновения печеночной комы концентрация токсина в крови резко возрастает, а антитела в крови не обнаруживаются.
Источник
