Модель экспериментального цирроза печени
Аннотация:
Изобретение относится к экспериментальной медицине, а именно к экспериментальной токсикологии и гепатологии, и касается моделирования цирроза печени. Для этого проводят внутрижелудочное введение лабораторным животным в течение 3-х недель, через день, 40% этанола в дозе 3 г/кг. Одновременно осуществляют внутрибрюшинное введение в течение 4-х последовательных дней каждой недели 1% раствора N-нитрозодиметиламина в дозе 5 мг/кг. Способ позволяет повысить воспроизводимость, сократить срок моделирования цирроза печени и приблизить модель к клиническому течению данной патологии у человека. 3 табл.
Изобретение относится к медицине, направлено на моделирование хронического токсического поражения печени в виде фиброза и цирроза и может быть использовано для изучения токсических поражений печени в доклиническом исследовании гепатозащитных препаратов и при разработке новых способов лечения цирроза печени. В настоящее время в экономически развитых странах заболеваемость циррозом печени составляет около 20-40 больных на 100 тыс. населения, и этот показатель неуклонно растет, от данного заболевания погибают около 350 тыс. человек в год. Чаще цирроз развивается при длительной интоксикации алкоголем (по разным данным, от 40 до 80% случаев). Существующие средства и схемы терапии цирроза печени не всегда оказываются эффективными и характеризуются большим количеством противопоказаний и побочных эффектов. Одна из возможных причин подобного состояния дел — отсутствие адекватных экспериментальных моделей цирроза печени. Роль алкоголя как этиологического фактора в развитии цирроза печени общепризнана.
Известен способ инициации токсического поражения печени путем перорального введения 40% этилового спирта в дозе 14 мл/кг в течение 60 суток [Доркина Е.Г. Гепатопротекторные свойства флавоноидов: автореф. дис. … д-ра биол. наук / Е.Г. Доркина. — Волгоград, 2010. — 45 с.].
Недостатком данного способа является длительность введение 40% этанола — 60 сут и более, а также то, что в результате подобного воздействия обычно развивается только токсический гепатит и/или жировой гепатоз, но никак не фиброз и цирроз. В связи с этим, при моделировании алкоголь-индуцированного экспериментального цирроза печени, согласно данным литературы, возникает необходимость усиливать гепатотоксическое повреждающее действие этанола с помощью других гепатотоксикантов и наоборот [Popper Н. Histogenesis of alcoholic fibrosis and cirrhosis in the baboon / H. Popper, C.S. Lieber // Am. J. Pathol. — 1980. — Vol. 98, №3. — P. 695-716].
Известен способ создания модели токсического гепатита и цирроза печени млекопитающих, согласно которому в качестве гепатотоксиканта внутрижелудочно вводят 50% раствор совтола-1 на оливковом масле из расчета 0,25 мл на 100 г массы тела и ежедневно в течение 1 мес вместо воды животным дают для питья 10% раствор этанола (Патент на изобретение RU №2197018, 2003]. Применение в этой модели этанола позволяет добиться развития хронического токсического гепатита, а совтол предназначен для быстрого токсического поражения печени. При сочетании двух компонентов их токсические эффекты суммируются, что в итоге приводит к развитию как токсического гепатита, так и цирроза печени через 4-6 недель после начала введения токсикантов.
Недостатком данного способа моделирования цирроза печени является то, что замена водного питьевого режима алкоголем не является физиологичной, в связи с чем, по данным литературы, около 30% животных отказываются от приема алкоголя [Патент на изобретение RU №2373927, 2007; Филатова Е.В. Влияние социальных условий на формирование предпочтения этанола у крыс / Е.В. Филатова [и др.] // Доклады Академии наук. — 2010. — Т. 430, №4. — С. 35-37].
Известен способ, при котором водный раствор диметилнитрозамина вводят интрагастрально из расчета 50-100 мг/кг массы животного 1 раз в неделю на протяжении 2-3 месяцев, при этом исследование печени обычно проводят через 2 недели после последнего введения. Другим вариантом этого же способа является введение водного раствора диметилнитрозамина интраперитонеально на протяжении 2-3 месяцев каждую неделю три дня подряд с последующим 4-дневным перерывом [Арутюнян И.В. Моделирование цирроза печени на лабораторных животных / И.В. Арутюнян [и др.] // Клиническая и экспериментальная морфология. — 2012. — №2. — С. 45-50].
Недостатком способа является длительность эксперимента.
Известен способ моделирования повреждения печени в эксперименте путем однократного введения крысам N-нитрозодиметиламина внутрибрюшинно в дозах 7 и 15 мг/кг [Томилин Н.В. Экспериментальная оценка генотоксического действия N-нитрозодиметиламина при однократном введении в токсических дозах белым крысам / Н.В. Томилин [и др.] // Актуальные проблемы диагностики, профилактики и лечения профессионально обусловленных заболеваний: Сборник материалов Всероссийской научно-практической конференции, Сочи, 14-15 октября 2013 года. — Сочи, 2013. — С. 423-425].
Однако при действии таких доз N-нитрозодиметиламина при однократном введении фиброз и цирроз печени не развиваются, а эффект повреждения этого органа регистрируется только по цитогенетическим показателям.
При введении диметилнитрозамина в дозах 5,0-7,5 мг/кг в течение 2-3 недель у всех грызунов развивается хронический токсический гепатит, а у значительной части (50-70%) еще и фиброз, но формирования цирроза печени не происходит [Constandinou С. Modelling liver fibrosis in rodents / С. Constandinou, N. Henderson, J.P. Iredale // Methods Mol. Med. — 2005. — Vol. 117. — P. 237-250].
Известен способ моделирования цирроза печени, который представляет собой введение в желудок лабораторного животного два раза в неделю в течение месяца 50%-ного раствора совтола-1 на оливковом масле из расчета 0,25 мл на 100 г массы тела и 10%-ного раствора этанола вместо воды для питья [Патент на изобретение RU №2197018, МПК G09B 23/28, 20.01.2003].
Недостатком известного способа является невысокая степень точности воспроизведения поражения печени в эксперименте.
Техническим результатом разработанного изобретения является повышение воспроизводимости и приближение модели экспериментального цирроза к клиническому течению данной патологии печени у человека.
Технический результат достигается тем, что для получения модели цирроза печени в эксперименте включают дозированное введение этанола крысам, причем этанол вводят внутрижелудочно в течение 3-х недель через день в дозе 3 г/кг и одновременно осуществляют внутрибрюшинное введение 1% раствора диметилнитрозамина (ДМНА) в дозе 5 мг/кг.
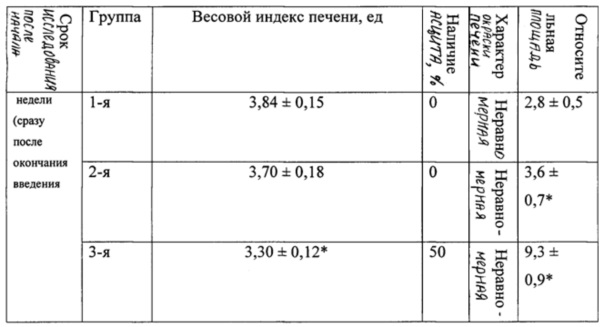
В таблице 1 представлена динамика веса животных в ходе эксперимента.
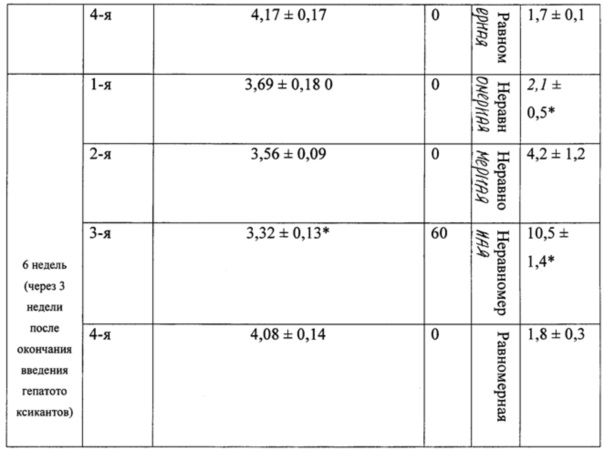
В таблице 2 представлены морфологические показатели у животных при моделировании экспериментального токсического цирроза печени.
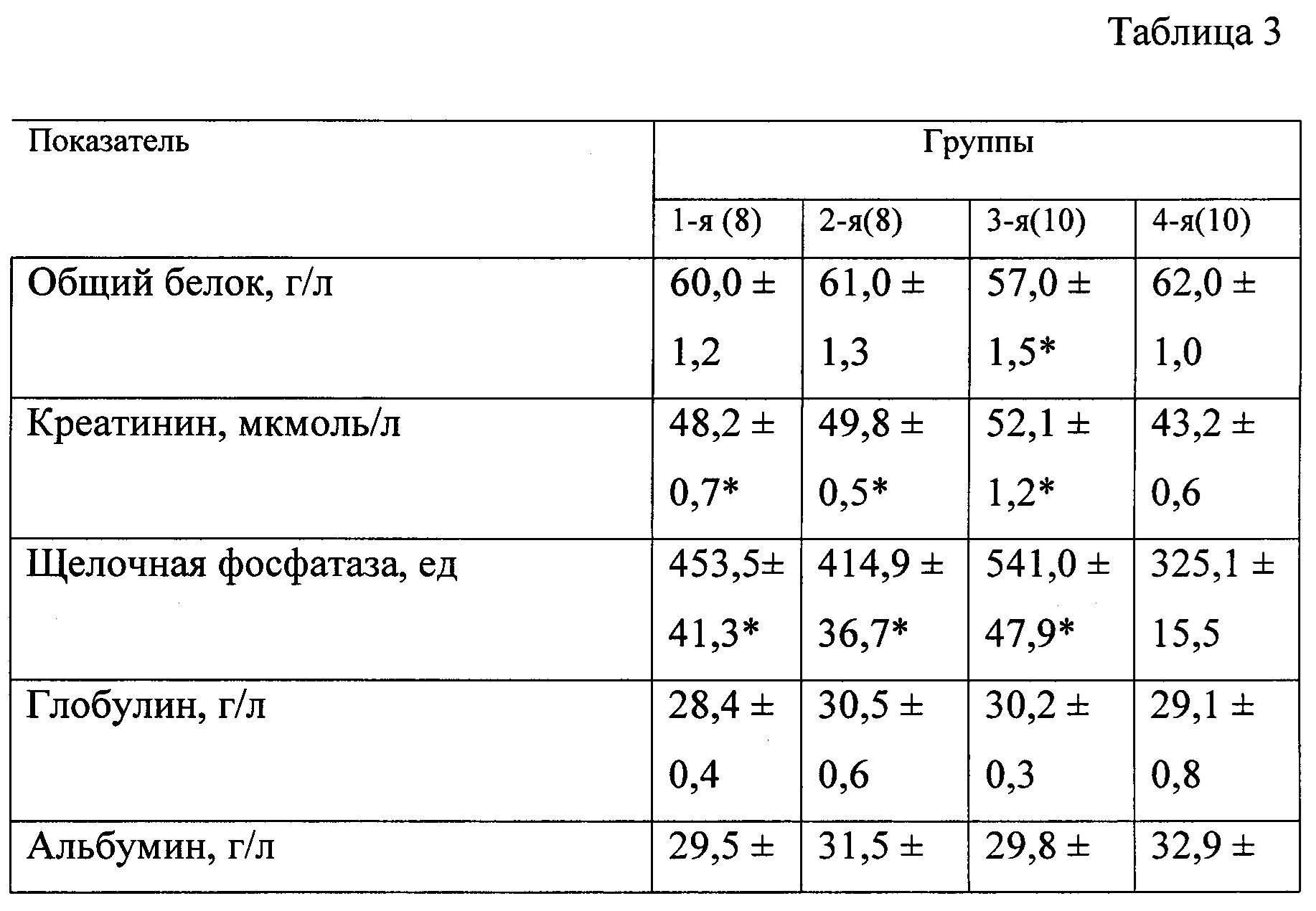
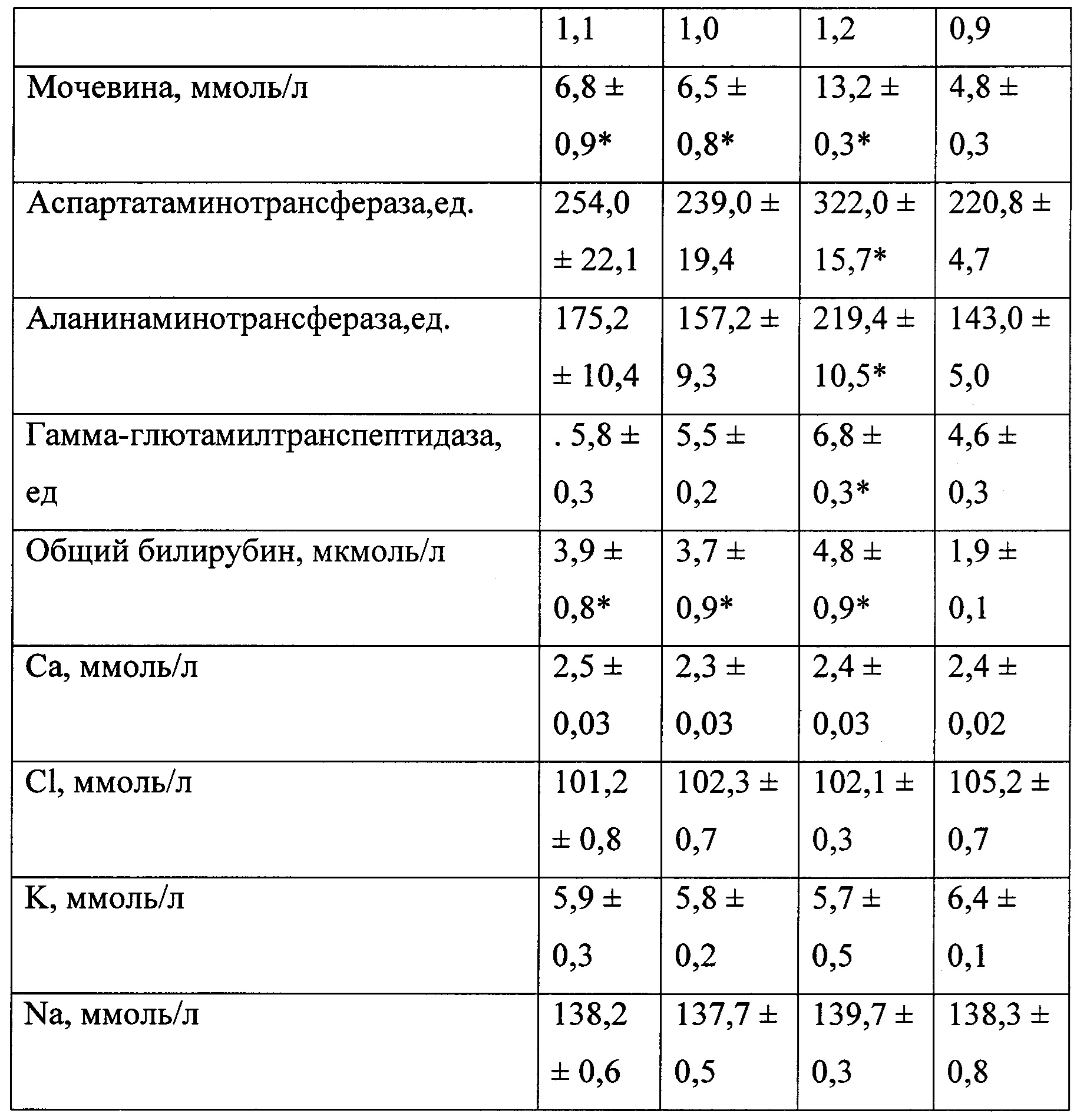
В таблице 3 представлены биохимические показатели у животных при моделировании экспериментального токсического цирроза печени.
Способ осуществляется следующим образом.
Для получения модели цирроза печени экспериментальным животным вводят этанол внутрижелудочно в течение 3-х недель через день в дозе 3 г/кг и одновременно осуществляют внутрибрюшинное введение 1% раствора диметилнитрозамина (ДМНА) в дозе 5 мг/кг.
Для доказательства соответствия заявленного технического решения критериям изобретения был проведен эксперимент на 80 белых беспородных крысах-самцах массой 180-220 г. Животные были разделены на четыре группы:
— 1-я группа (n=20) — внутрижелудочно вводили 40% этанол в дозе 3 г/кг в течение 3-х недель через 1 сут;
— 2-я группа (n=20) — внутрибрюшинно вводили 1% раствор N-нитрозодиметиламина (ДМНА) в дозе 5 мг/кг течение 4-х последовательных суток каждой недели в течение 3-х недель;
— 3-я группа (n=20) — внутрижелудочно вводили 40% этанол в дозе 3 г/кг в течение 3-х недель через 1 сут и одновременно внутрибрюшинно вводили 1% раствор N-нитрозодиметиламина (ДМНА) в дозе 5 мг/кг течение 4-х последовательных суток каждой недели;
— 4-я группа (n=20) — контрольная группа; животным вводили внутрижелудочно по 0,5 мл физиологического раствора через 1 день и внутрибрюшинно по 0,5 мл физиологического раствора в течение 4-х последовательных суток каждой недели в течение 3-х недель.
Наблюдение за лабораторными животными осуществляли в течение 2-х недель до эксперимента (карантин), в ходе 3-недельного внутрижелудочного и внутрибрюшинного введения гепатотоксикантов, а также в течение 3-х недель после окончания их введения. Оценка клинико-лабораторных и морфологических показателей у лабораторных животных опытных и контрольной групп проводилась до эксперимента, через 3 и 6 недель после начала введения гепатотоксикантов (второе исследование было выполнено для уточнения возможности возобновления процессов спонтанного фиброзобразования после отмены гепатотоксикантов).
Животных содержали в стандартных условиях вивария на обычном пищевом рационе, со свободным доступом к воде. Масса тела животных 1-3-й группы перед началом эксперимента была (147,9±5,2) г, 4-й (контрольной) группы — (148,0±6,3) г. Исходные клинико-лабораторные показатели у животных опытных и контрольной групп также не различались.
Наличие и выраженность токсического повреждения печени оценивали путем визуального наблюдения клинической картины интоксикации, изучения биохимических показателей периферической крови и морфологического исследования препаратов печени.
В качестве биохимических показателей, характеризующих основные функции печени, изучали: общий белок, креатинин, мочевину, глюкозу, билирубин, калий, натрий, хлор, кальций, аланинаминотрансферазу, аспартатаминотрансферазу, гамма-глютамилтранспептидазу и индикатор холестаза — щелочную фосфатазу. Оценку биохимических показателей осуществляли с помощью анализатора «Roche Omni С».
Для подтверждения факта развития экспериментального цирроза печени через 1, 2 и 3 недели после начала эксперимента проводили эвтаназию животных (по 5 особей из каждой группы) и осуществляли забор образцов печени с последующим гистологическим исследованием по стандартным методикам. Срезы печени оценивали с использованием исследовательских микроскопов «Polyvar» и «Leica DMRE», цифрового комплекса видеонаблюдения и программы анализа изображений «Видеотест-4». Морфологическую оценку степени повреждения печени проводили по результатам измерения площади, занимаемой соединительной тканью, в пределах 5-7 печеночных долек на 6 срезах печени, окрашенных по ван Гизону [Руководство по проведению доклинических исследований лекарственных средств / под ред. А.Н. Миронова. — М.: Гриф и К., 2012. — 944 с.]. С помощью компьютерной обработки сканированного изображения среза печени рассчитывали относительную площадь, занимаемую в ткани печени сформировавшимся коллагеном.
Значимость межгрупповых различий средних величин параметрических показателей оценивали с помощью t-критерия Стьюдента. В таблицах данные представлены в виде средней арифметической величины и ошибки средней величины (М±m).
Эксперименты показали (табл. 1), что уже к концу 3-й недели комбинированное воздействие этанола и ДМНА сопровождалось значительным ростом (более чем на 30 г по сравнению с фоновыми значениями) массы тела у животных 3-й группы.
При вскрытии через 3 недели после начала эксперимента у 50% животных 3-й группы отмечали наличие развитого асцита с большим количеством (около 6-8 мл) серозной жидкости в брюшной полости (табл. 2). Весовой коэффициент печени у крыс 3-й группы был статистически значимо меньшим, чем у крыс 4-й (контрольной) группы (р<0,05), влажность печени у животных 3-й группы была понижена.
Повышение воспроизводимости в формировании фиброза и цирроза печени достигается за счет потенцирования N-нитрозодиметиламином гепатотоксического эффекта этанола и наоборот. Кроме того, моделирование токсического фиброза и цирроза печени осуществляется в более короткие сроки, а развивающаяся при этом клинико-лабораторная и морфологическая картина поражения в значительной степени приближена к клиническому течению данной патологии печени у человека.
При использовании нашей модели формирование клинико-лабораторной и морфологической картины цирроза печени с развитием выраженного асцита (до 6-8 мл жидкости в брюшной полости) у 50% лабораторных животных начинается уже через 3 недели после начала сочетанного введения двух гепатотоксикантов — N-нитрозодиметиламина и этанола. У оставшихся 50% лабораторных животных в эти же сроки также формируется фиброз и цирроз печени, но в брюшную полость выпотевает до 1-2 мл жидкости. Таким образом, предлагаемая модель позволяет сократить сроки моделирования цирроза печени по сравнению со стандартной длительностью эксперимента в среднем в два раза (с 6 недель до 3 недель), а также повысить точность воспроизведения клинико-лабораторной и морфологической картины токсического фиброза и цирроза печени.
Комбинированное воздействие гепатотоксикантов способствует формированию у крыс экспериментального цирроза печени уже через 3 недели после начала инъекций, что проявляется в увеличении количества соединительной ткани в печени, цирротическом ее перерождении и развитии асцита. При этом, в первую неделю после начала комбинированного воздействия этанола и N-нитрозодиметиламина в ткани печени отмечается центральный геморрагический некроз, затем происходит формирование септ и волокнистой соединительной ткани (2-я неделя), а спустя 3 недели — мелкоузелкового цирроза. Таким образом, разработанная нами модель позволяет проследить последовательное развитие всех морфологических признаков повреждения вплоть до развития цирроза.


Способ моделирования экспериментального цирроза печени, включающий дозированное введение этанола крысам, отличающийся тем, что этанол вводят внутрижелудочно в течение 3-х недель через день в дозе 3 г/кг, одновременно осуществляют внутрибрюшинное введение в течение 4-х последовательных дней каждой недели 1% раствора диметилнитрозамина (ДМНА) в дозе 5 мг/кг.
Источник
Экспериментальные
модели патологии
печени и
почек: патогенетический аспект
1Мышкин
В.А. 2Еникеев Д.А., 2Галимов Д.М., 1Репина
Э.Ф., 3Гимадиева А.Р., 2Еникеева С.А., 2Идрисова
Л.Т., 2Мышкин И.В.
1. ФГУН «Уфимский НИИ медицины труда и экологии
человека» Федеральной службы по надзору в сфере защите прав и благополучия
человека, г.Уфа
2. ГБОУ ВПО «Башкирский
государственный медицинский университет», г.Уфа
3. ИОХ Уфимского научного центра РАН г.Уфы
Описаны 11 экспериментальных моделей
патологии печени и почек (гепато-ренальной системы), обусловленные нарушением
процессов перекисного окисления липидов (ПОЛ). Изменение активности процесса
ПОЛ представляет собой наиболее общее звено токсогенеза в цепи: повреждение
мембран-цитолиз. Патогенетическое значение может иметь не только активация ПОЛ
(модели 1-4, 6,7,8,9), но и его угнетение (модели 5,11). Модели предназначаются
для поиска новых гепато-нефрозащитных средств и изучения механизмов их
действия.
Вследствие принципиальной общности
молекулярных механизмов повреждения печени вне зависимости от природы
химического повреждающего воздействия общемедицинское значение приобрели
исследования повреждения гепатоцитов тетрахлорметаном. Эта классическая модель
патологии печени широко и с успехом используется для решения различных проблем
клинической и экспериментальной гепатологии, в том числе для изучения
патогенеза токсических вирусных поражений печени и поиска новых эффективных
гепатозащитных средств. На этой основе разработана модель сочетанного поражения
печени и почек (гепаторенального синдрома), которая также нашла применение в
области изыскания новых биологически активных веществ и лекарственных
препаратов. Однако, несмотря на усилия многих исследователей, ряд вопросов
патохимических механизмов поражения гепатоцитов остались невыясненными, а
способы специфической профилактики и терапии химических поражений печени и
почек недостаточно эффективны.
Не вполне понятна роль окислительного
стресса в повреждении печени, в том числе в формировании определенных
нозологических форм. В этой связи важным подходом к лечению болезней печени и
почек может явиться разработка новых моделей патологии, обусловленных
перекисным окислением липидов. Ниже дано обобщение основных результатов
экспериментального моделирования патологии печени и почек химическими
проксидантами, проводившегося в отделе токсикологии Уфимского НИИ медицины
труда и экологии человека в течение последних 10 лет.
Модели патологии печени и почек
воспроизводили путем введения крысам-самцам гепатотоксикантов – этанола, дихлорэтана
(ДХЭ), смеси полихлорированных бифенилов (совтол) в сочетании с этанолом,
тетрахлорметана (ТХМ), хлорфенолов (орто-хлорфенола и 2,4-дихлорфенола) и
трихлорметафоса по схемам, описанным нами ранее (8-10, 12). Оценивали массу
печени и почек, гистологическое строение, биохимические показатели, отражающие
метаболизм и функции органов. Перекисное окисление липидов (ПОЛ) оценивали
путем количественного определения в липидных экстрактах гомогенатов продуктов
ПОЛ. Сравнительную активность процессов ПОЛ оценивали путем определения
коэффициента кратности различий в показателях ПОЛ в группах «опыт-контроль».
Модели тетрахлорметанового гепатита дифференцировали по возрастному признаку.
Статистическую обработку полученных данных проводили с использованием t-критерия Стьюдента. Различия считали достоверными при
Р < 0,05. результаты представлены в таблице.
Они свидетельствуют о том, что у
экспериментальных животных с патологией печени и почек (модели 1-11) изменение
активности процесса ПОЛ представляет собой наиболее общее звено патогенеза, что
требует соответствующей коррекции антиоксидантным действием независимо от того,
является ли оно первичным или носит вторичный характер. Патогенетическое
значение может иметь не только активация ПОЛ (модели 1-4, 6, 7, 8, 9), но и его
подавление (модели 5, 11). Важным условием активации процесса ПОЛ в печени является
ослабление функционирования супероксиддисмутазы, каталазы и глутатионпероксидазы
(1, 4, 6-11).
Целесообразность выдвижения нарушений
процесса ПОЛ на роль важнейшего универсального патогенетического механизма
развития гепатита на фоне метаболических нарушений печени, вызванных различными
химическими прооксидантами, состоит в том, что эффектами ПОЛ можно объяснить
основную часть наблюдаемых при гепатите (гепатите-фиброзе, гепатите-циррозе) метаболических
и морфо-функциональных изменений.
Впервые в комплексе изучены возрастные
особенности функционально-метаболических изменений в печени при интоксикации
тетрахлорметаном, выявлены возрастные различия в показателях активности
процессов ПОЛ и антиоксидантной защиты (АОЗ) в печени. Установлено, что
дисбаланс в системе ПОЛ-АОЗ сопровождается гепатотоксическими и
нефротоксическими эффектами, которые характеризуются развитием цитолитического
и холестатического синдромов, нарушением экскреторной и антитоксической функций
печени и почек более выраженном у старых крыс (модели 1, 4, 5, 10).
Определенный интерес для экспериментальной фармакологии, токсикологии и
патофизиологии представляют модели патологии печени, индуцированные хлорфенолами,
на которые получен гепатопротекторный эффект производных бензимидазола, обладающих
антиоксидантной и мембраностабилизирующей активностью (модели 2, 3, 7, 8, 10).
Таким образом, в результате полученных
исследований установлено возрастание активности процессов свободно-радикального
окисления и их включение в развитие патологического процесса в печени и почках
при введении животным химических токсикантов – дихлорэтана, этанола,
полихлорированных бифенилов (совтола), тетрахлорметана, хлорфенолов, трихлорметафоса
(модели 1-7), что позволяет объединить модели патологий на основе критериальной значимости перекисного окисления липидов.
Целесообразны дальней-
Таблица
Экспериментальные
модели патологии печени и почек, индуцированные введением химических веществ
№ | Модель патологии | Молекулярно-патологические нарушения |
1. | Острый гепатит, моделируемый | Высокая степень активации |
2. | Гепатозо-гепатит, моделируемый | Высокая степень активации ПОЛ, |
3. | Гепатит-фиброз, моделируемый | Высокая степень активности |
4. | Гепатит-цирроз, моделируемый | Крысы зрелого возраста. Умеренная |
5. | Гепатит-цирроз, моделируемый | Старые крысы. Фазовая |
6. | Гепато-ренальный синдром, | Умеренная степень активации |
7. | Острый гепатит, моделируемый | Умеренная активация ПОЛ, |
8. | Хроническая гепатопатия, | Умеренная активация ПОЛ, |
9. | Токсическая нефропатия, моделируемая | Умеренная степень активации |
10. | Хронический гепатит, моделируемый | Умеренная активация ПОЛ, |
11. | Токсическая гепатаргия, моделируемая | Экстремальное подавление |
Примечание: Умеренная степень активации
ПОЛ – кратность различий в уровне продуктов ПОЛ опыт/контроль 2,0
Высокая степень активации – кратность различий 2,0
Снижение/подавление активности – кратность
различий < 1
шие исследования на их соответствие другим критериям
свободно-радикальной патологии. Тетрахлорметан, полихлорированные бифенилы
(совтол), дихлорэтан, хлорфенолы, трихлорметафос в смертельных дозах (модель 4)
вызывают в органах депрессию метаболических процессов, общим проявлением
которой является практически одновременное по времени и степени подавление активности
перекисного окисления липидов в печени, почках и полушариях головного мозга
крыс. Выявленные особенности поражения печени можно рассматривать как
клинический эквивалент токсической гепатаргии (аргия–бездействие).
Представленные данные могут
свидетельствовать о важном значении нарушений перекисного окисления липидов в
патогенезе поражений печени химическими токсикантами, обладающими
гепатонефротоксическим действием. Можно констатировать, что эти нарушения в
виде активации, подавления активности или фазных изменений (активация/снижение
активности) представляют собой важное звено токсогенеза. В тоже время, при
интоксикации этанолом, дихлорэтаном или сочетанием полихлорированных бифенилов
и алкоголизации (модели 1-3), активация ПОЛ играет ключевую роль в повреждении
печени. Полученные результаты могут быть использованы при разработке новых подходов
к лечению болезней печени и почек токсико-химической этиологии.
Литература.
1.
Влияние тетрахлорметана,
мексидола и соединения оксиметилурацила с янтарной кислотой на устойчивость
взрослых и старых крыс к гипоксической гипоксии / Чернов В.Н., Еникеев Д.А., Мышкин
В.А. // Family Health in the XXI century. Oncology – XXI century
(Materials of XI International Scientific Oncological Conference.
24.04-02.05.2007) Netherlands – Germany – France – Пермь: Изд-во «ПОНИЦАА», 2007 – С. 293-294
2.
Ибатуллина Р.Б., Мышкин В.А.,
Сергеева С.А. и др. Профилактическая эффективность тиетазола и оксиметилурацила
при воздействии хлорфенолов // Медицина труда и промышленная экология. – 2002.
— №5 – С. 16-19
3.
Ибатуллина Р.Б., Мышкин
В.А. Защитно-восстановительный эффект антиоксидантов при экспериментальной
интоксикации хлорфенолами //Медицина труда и промышленная экология. – 2008. —
№5 – С. 28-31
4.
Мышкин В.А., Бакиров
А.Б. Оксиметилурацил. Очерки экспериментальной фармакологии. – Уфа, 2001. – 218
с.
5.
Мышкин В.А., Бакиров
А.Б. Экспериментальная коррекция химических поражений печени производными
пиримидина. Эффективность и механизм действия. – Уфа, 2002. – 150 с.
6.
Мышкин В.А., Ибатуллина
Р.Б. и др. Способ моделирования токсической гепатопатии / Патент РФ №2188457 от
27.08.2002г.
7.
Мышкин В.А., Ибатуллина
Р.Б. и др. Способ моделирования цирроза печени / Патент РФ №2197018 от
20.01.2003г.
8.
Мышкин В.А., Ибатуллина
Р.Б. и др. Токсическая гепатопатия (экспериментальная разработка моделей и
методов коррекции). – Уфа, 2004. – 119 с.
9.
Мышкин В.А., Еникеев
Д.А. Коррекция постинтоксикационных нарушений. – Уфа, 2005. – 349 с.
10.
Ибатуллина Р.Б., Бакиров
А.Б. Поражение печени химическими веществами. Функционально-метаболические
нарушения, фармакологическая коррекция. – Уфа: Гилем, 2007. – 177 с.
11.
Мышкин В.А., Гуляева
И.Л. и др. Коррекция прооксидантно-антиоксидантного равновесия после тяжелых
острых отравлений // Общая реаниматология. – 2007. – Т.3, №5-6. – С. 69-74
12.
Мышкин В.А., Еникеев Д.А., Ибатуллина Р.Б.
Полихлорированные бифенилы: моделирование и патогенез гепатотоксического
действия // Вестник Российской академии естественных наук. – 2007. – Т.7, №2. –
С. 46-51
13.
Чернов В.Н., Мышкин
В.А., Ибатуллина Р.Б. и др. Влияние оксиметилурацила на перекисное окисление
липидов и функционально-метаболические показатели печени при интоксикации
старых крыс тетрахлорметаном // Патологическая физиология и экспериментальная
терапия. – 2007. — №4. – С. 29-30
Источник


