Вирус гепатит а геном и белки
Гепатит А — острое инфекционное заболевание печени, вызываемое вирусом гепатита А (англ. HAV). Заражение HAV может приводить к развитию смертельно опасного молниеносного гепатита (острой печеночной недостаточности). С «болезнью немытых рук» близко знакомы миллионы людей, а вот HAV пока остается одним из самых малоизученных вирусов. Недавно была получена кристаллическая структура этого инфекционного агента. Удивительно, но она оказалась похожей на структуру пикорнаподобных вирусов насекомых. Возможно, эта информация сможет пролить свет как на происхождение HAV, так и на некоторые его загадочные свойства.
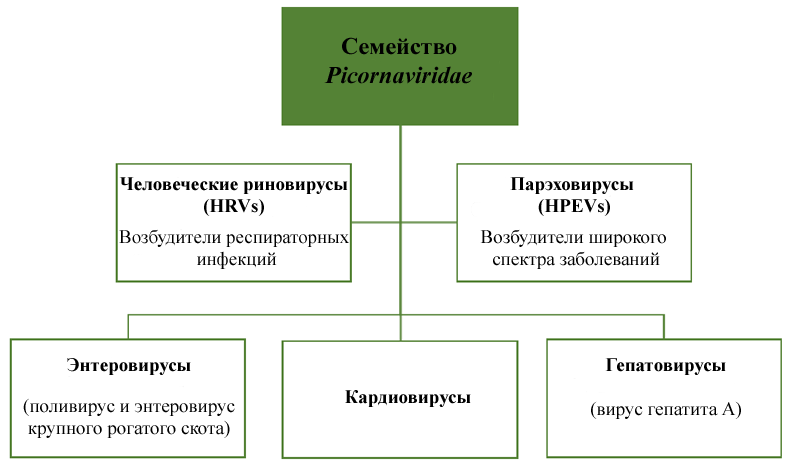
Рисунок 1. Классификация пикорнавирусов.
По данным ВОЗ, в мире ежегодно регистрируется около 1,4 млн случаев заболевания гепатитом А. В основном это удел населения развивающихся стран с неблагополучной санитарной обстановкой и низким уровнем личной гигиены [1]. Но именно в таких странах проживает большинство землян. Почему же до сих пор возбудитель столь распространенной и опасной инфекции не был досконально изучен? Одна из причин — его необычная структура. Вирус гепатита А относится к семейству Picornaviridae. Пикорнавирусы — маленькие икосаэдрические вирусы, у которых нет внешней оболочки, а геном представлен одноцепочечной РНК. К пикорнавирусам относятся одни из самых маленьких известных патогенов человека и животных (рис. 1), в том числе такие привычные нам «простудные» вирусы [2].
Структура пикорнавирусов
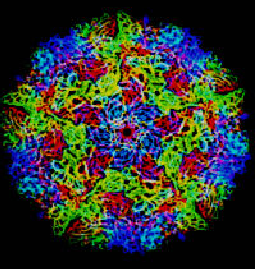
Рисунок 2. Структура энтеровируса крупного рогатого скота. Белок VP1 обозначен синим цветом, VP2 — зеленым, VP3 — красным и VP4 — желтым. Рисунок из [3].
Все вирусы имеют белковую оболочку, предохраняющую их нуклеиновую кислоту от внешних воздействий — капсид (от лат. capsa — вместилище, ящик). Капсид, в свою очередь, состоит из отдельных одинаковых структурных единиц (белков) — капсомеров. Капсид пикорнавирусов имеет шарообразную структуру диаметром 30 нм и состоит из 60 копий каждого из четырех структурных белков — VP1, VP2, VP3 и VP4. Кристаллическая структура пикорнавирусной частицы следующая: белки VP1, VP2 и VP3 состоят из 240–290 аминокислотных остатков; каждый из белков принимает форму восьмицепочечной антипараллельной β-складчатой структуры (так называемая структура «рулет с вареньем» (jelly roll)) (рис. 2). Эти белки образуют наружную поверхность капсида, толщина которого составляет приблизительно 5 нм. Белок VP4 состоит всего лишь из 70 аминокислотных остатков и лежит поперек внутренней поверхности капсида [3]. В итоге капсид пикорнавирусов приобретает форму икосаэдра, или, другими словами, он обладает икосаэдрической симметрией. То есть субъединицы вируса расположены в виде правильного икосаэдра вокруг РНК, скрученной в клубок. Белковые субъединицы (капсомеры) больших икосаэдрических вирусов для сохранения формы сгруппированы в морфологические группы, различимые с помощью электронного микроскопа: это могут быть пентамеры (5 субъединиц) или гексамеры (6 субъединиц), формирующие в капсиде каналы [4, 5]. Структурный белок VP1 образует пентамеры, к которым примыкают белки VP2 и VP3, образующие вершины икосаэдра с трехлучевой симметрией. Между пентамерами и белками VP2 и VP3 образуется углубление, которое называется каньон. В этом каньоне у большинства пикорнавирусов есть так называемый карман — пространство, в которое при упаковке вируса попадает небольшая молекула, обычно некий липид. Этот липид, или «карманный фактор», нужен для того, чтобы стабилизировать капсид вне клетки. Как только вирус связывается с нужным рецептором и попадает в клетку, фактор выходит из кармана, запуская распаковку частицы и делая возможным проникновение РНК в цитоплазму [2].
Сверчок и HAV: связь раскрыта!
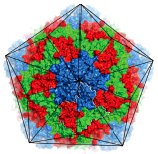
Рисунок 3. Поверхность HAV. Синим цветом обозначен белок VP1, зеленым — VP2, красным — VP3. Черными линиями обозначены границы частицы. Рисунок из [6].
Как выяснила группа ученых из Великобритании и Китая, структура вируса гепатита А отличается от таковой других пикорнавирусов [6]. Внешняя поверхность HAV — гладкая, без углублений (рис. 3). Основные белки капсида — VP1, VP2 и VP3 — формируют восемь антипараллельных β-структур и охватывают всю толщину капсида. В целом, HAV является высокоупорядоченным вирусом, и организация его белковых цепей сходна с таковой других представителей Picornaviridae. Однако ученые нашли несколько отличий. Во-первых, у вируса гепатита А отсутствует типичный для пикорнавирусов «карманный фактор». Вторая тонкая деталь — небольшое изменение в N-конце белка VP2, а именно — небольшое сгибание на границе пентамеров. Это сгибание усиливает взаимодействие одного пентамера с соседним за счет образования дополнительной цепи на VP2-β-структуре. В итоге меняется связность субъединицы: смежные протомеры (полипептидные цепи, являющиеся исходной единицей организации структуры белка) одного пентамера сшиты вместе примыкающим пентамером. Из всех пикорнавирусов такой структурой обладает только вирус гепатита А, однако похожие структуры есть и у пикорнаподобных вирусов насекомых, например, у паралитического вируса сверчка (cricket paralysis virus (CrPV)). Таким образом, некоторые загадочные свойства HAV могут объясняться тем, что этот вирус является связующим звеном между «современными» пикорнавирусами и более «примитивными» предшественниками вирусов насекомых.
Новые факты о HAV
Было обнаружено, что вирусные частицы HAV более устойчивы к физическим и химическим воздействиям, чем частицы других Picornaviridae [6]. Они остаются стабильными при температуре до 80 °С и значениях pH около 2. Можно было бы предположить, что такая устойчивость вызвана изменениями домена VP2 на границе пентамеров, что описывалось выше. Однако, стабильность паралитического вируса сверчка, организованного подобно HAV, ничем не отличается от таковой прочих пикорнавирусов. Дальнейшие исследования показали, что устойчивости частицы HAV способствует состыковка небольших аминокислотных остатков и тирозиновых боковых цепей, прижатых вокруг оси двойной симметрии.
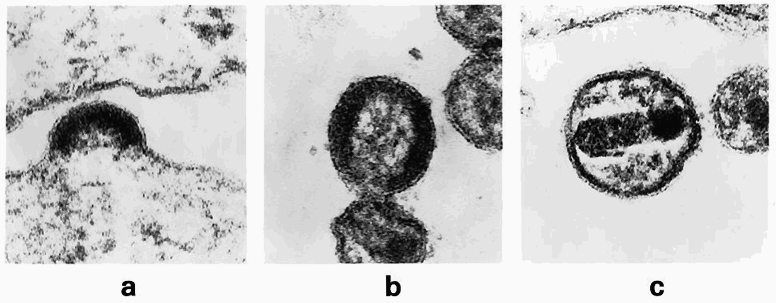
Рисунок 4. Вирусный бадинг на примере вируса иммунодефицита человека (ВИЧ). a — накопление вирусных белков в клетке приводит к «выпячиванию» вируса наружу; b — работа ESCRT приводит к сужению в основании мембранного выступа, что вызывает образование вирусной частицы, содержащей пузырек; c — «почка» отщепляется, оставляя свободным внеклеточный вирион. Фотография предоставлена доктором Matthew Gonda для Wikimedia.
Также HAV отличается от других пикорнавирусов (в частности, энтеровирусов) и механизмом проникновения в клетку-хозяина. Энтеровирусы передают свой геном через поры в мембране эндосомы, формируемые амфипатической (включающей участки с противоположными — гидрофильными и гидрофобными — свойствами) N-концевой спиралью VP1 и белком VP4. Процесс инфицирования состоит из двух шагов: проникновения вирусной частицы и высвобождения ее генома. Первый шаг для HAV хорошо изучен: вирус без изменений попадает в клетку путем трансцитоза (что как раз-таки свойственно пикорнаподобным вирусам насекомых), тогда как второй шаг — высвобождение РНК-генома — остается неясным. Возможно, для разборки вирусной частицы требуются специфические факторы инфицируемой клетки-хозяина. Недавние исследования показали, что HAV содержит тандем мотивов YPX3L, которые связывают ALIX-компонент ESCRT-пути [7]. То есть вирус способен привлекать ESCRT-комплекс, обычно служащий для облегчения высвобождения частиц оболочечных вирусов путем экзоцитоза. ESCRT (endosomal sorting complex required for transport) — совокупность белков, необходимых для мембранных перестроек при формировании выпячиваний и впячиваний. Работая вместе с другими вспомогательными белками, ESCRT включает режим ремоделирования (изменения) мембраны, что приводит к ее изгибанию, отделению от цитоплазмы и дальнейшему «перерезанию» шейки выпячивания. Таким образом происходит выход вируса, или вирусный бадинг (англ. budding — почкование) (рис. 4). ESCRT играет важную роль в ряде клеточных процессов, таких как биогенез мультивезикулярных тел, отделение клеток и попадание вирусов в клетку. Чтобы помочь вирусу гепатита А проникнуть в клетку, белок ALIX связывает и рекрутирует ESCRT-III, компоненты которого участвуют в основных процессах ремоделирования мембраны.
HAV — переходная эволюционная форма
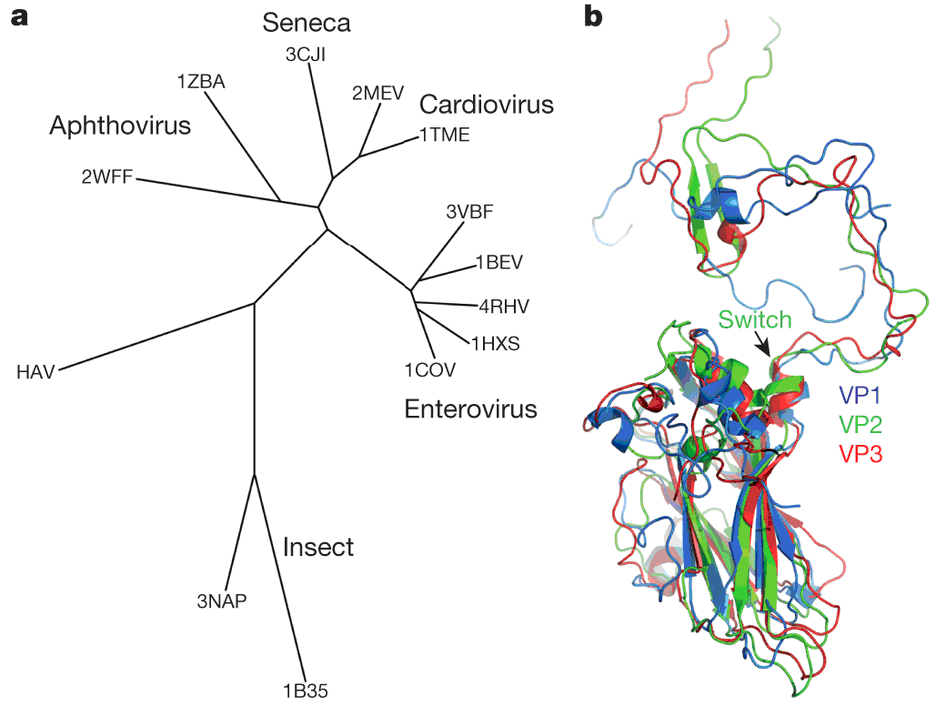
Рисунок 5. Филогения. a — дендрограмма представителей пикорнавирусов и крипавирусов: EV71 — энтеровирус 71, 1BEV — энтеровирус крупного рогатого скота, 4HRV — человеческий риновирус 14, 1HXS — полиовирус 1 типа, 1COV — вирус Коксаки B3, 1TME — вирус Тейлера, 2MEV — вирус менго, 3CJI — Seneca valley virus, 1ZBA — вирус ящура A10, 2WFF — вирус конского ринита А, 3NAP — вирус клопов Triatoma и 1B35 — вирус CrPV, паралитический вирус сверчка; b — суперпозиция (наложение) белков VP1 (синий), VP2 (зеленый) и VP3 (красный) вируса гепатита А. Рисунок из [6].
Таким образом, можно сделать вывод, что HAV обладает тонкими, но глубокими структурными различиями с другими пикорнавирусами. Филогенетический анализ показывает, что HAV связан как с классическими пикорнавирусами, так и с пикорнаподобными вирусами насекомых (рис. 5а). Кроме того, замена N-концевого домена в белке VP2 повышает уровень его гомологии с белками VP1 и VP3 (рис. 5b). Это подтверждает идею о том, что HAV сохранил структурные и функциональные особенности первичных пикорнавирусов, которые были родственны пикорнаподобным вирусам насекомых. Та же замена в белке VP2 позволила вирусу гепатита А приобрести эффективные механизмы внедрения своего генома в клетку, что стимулировало взрывное появление разнообразных форм современных пикорнавирусов млекопитающих.
Полученные знания о кристаллической структуре и происхождении HAV раскрывают широкие перспективы в борьбе с этим вирусом. Например, можно синтезировать препараты, направленные на разрушение структуры вируса. Или, зная, что HAV, как и его предки, попадает в клетки путем трансцитоза, пытаться блокировать этот процесс. Можно сделать лекарства, направленные на разрушение комплекса HAV-ESCRT, и таким образом предотвращать активную репликацию вируса в клетках. Думаю, что исследования в этой области не заставят себя ждать, и скоро мы узнаем о появлении на рынке новых препаратов, способных эффективно бороться с вирусом гепатита А.
- «Гепатит А». (2014). Сайт ВОЗ. Информационный бюллетень N°328;
- Залезть в карман к простуде;
- Ферменты лишают донорскую кровь групповой специфичности;
- Вирусы-платформы: яд во благо;
- «Огуречная» мечта;
- Wang X., Ren J., Gao Q., Hu Z., Sun Y., Li X., Rowlands D.J., Yin W., Wang J., Stuart D.I., Rao Z., Fry E.E. (2015). Hepatitis A virus and the origins of picornaviruses. Nature. 517, 85–88;;
- Feng Z., Hensley L., McKnight K.L., Hu F., Madden V., Ping L. et al. (2013). A pathogenic picornavirus acquires a nenvelope by hijacking cellular membranes. Nature. 496, 367–371..
Источник

КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
1.Таксономия, классификация
Гепатит А(инфекционный гепатит, эпидемический гепатит, болезнь Боткина, катаральная желтуха) — острое инфекционное антропонозное заболевание с фекально-оральным механизмом передачи, характеризующееся преимущественным поражением печени и проявляющееся клинически гепатомегалией, интоксикацией и желтухой.
Вирус гепатита А (ВГА, HAV) относится к семейству Picornaviridae,роду Hepatovirus(ранее этот вирус считался серотипом 72 рода Enterovirus).
2. Морфология, размеры, особенности генома
Строение вириона. Диаметр вириона равен 27 нм, капсид имеет икосаэдрический тип симметрии (рис. 23), содержит 60 капсомеров и не имеет наружной суперкапсидной оболочки, поэтому не содержит липидов и углеводов. Каждая структурная единица капсида (протомер) построена из 4-х полипептидов: VP1, VP2, VP3, VP4, из них VP1, VP2, VP3 располагаются на поверхности вириона, a VP 4, вероятно, лежит внутри вирусной частицы и имеет тесный контакт с геномной РНК.
Рис. 23 Схема вируса гепатита А
Геном вируса представлен линейной однонитевой молекулой плюс-РНК, выполняющей также функции информационной РНК и обладающей инфекционностью.
Антигены. В антигенном отношении ВГА является однородным, его антигенная активность обусловлена тремя поверхностными капсидными белками, которые представляют собой единый вирусспецифический антиген вируса гепатита A (HAV-Ag).
Резистентность. ВГА относительно устойчив к низким значениям рН (до 1.0), низким температурам (при -20°С сохраняется годами), жирорастворителям (эфиру, хлороформу, детергентам), высушиванию. При комнатной температуре вирус выживает несколько недель.
Чувствителен к формалину (0,35%), хлору, ультрафиолетовым лучам. Вирус инактивируется при 60°С в течение нескольких часов, полностью теряет свою инфекционность при автоклавгировании (120°С) за 20 мин, при обработке сухим жаром (180°С) — через 1час.
3.Этапы репродукции
Репродукция. Вирус размножается в организме обезьян шимпанзе и мармозет, а также в отдельных первичных и перевиваемых линиях культур клеток человека и обезьян, в которых происходит репродукция лабораторных и вакцинных штаммов вируса гепатита А, но использование культур клеток для выделения вируса из клинического материала затруднено.
Считается, что цикл репродукции ВГА сходен с репродукцией других пикорнавирусов. Первично вирион взаимодействует со специфическими рецепторами на плазматической мембране чувствительных клеток (эпителиоциты, гепатоциты) и проникает в их цитоплазму, при этом теряется капсид и вирусная РНК освобождается.
Далее геномная РНК связывается с рибосомами клетки и транслируется с образованием гигантского белка-предшественника. Этот полипептид нарезается протеазами на три фрагмента: PI, P2 и РЗ. Фрагмент Р1 является предшественником для структурных белков (VP1 — VP4), из РЗ образуются неструктурные вирусспецифические белки — протеаза и РНК-полимераза, фрагмент Р2 разрушается.
В дальнейшем РНК-полимераза обеспечивает синтез дочерних геномов вируса. При этом вирионная плюс-РНК транскрибируется в комплементарную минус-РНК, которая и служит матрицей для синтеза дочерних геномов. Процесс репликации РНК идет на гладком эндоплазматическом ретикулуме.
При накоплении достаточного количества структурных белков и вирусных дочерних геномов на мембранах эндоплазматического ретикулума осуществляется самосборка вирионов (идет упаковка плюс-РНК в белковые капсиды).
Выход вируса из клетки осуществляется путем экзоцитоза и, возможно, при разрушении гепатоцитов цитолитическими Т-лимфоцитами.
4. Эпидемиология
Гепатит А является антропонозной инфекцией, преимущественно поражает детей. Распространен повсеместно. Характеризуется сезонностью с максимумом заболеваемости в осенне-зимний период, периодичностью с циклами подъема заболеваемости. Для гепатита А характерны отдельные вспышки, мелкие и средние, реже крупные эпидемии. В странах с высоким уровнем общественной гигиены и санитарной культуры заболеваемость гепатитом А ниже, чем в развивающихся странах. Летальность не превышает 0,1 — 0,5%.
Источником и резервуаром инфекции служат больные в инкубационном периоде желтушной и безжелтушной формы инфекции. Наиболее заразительны больные в последние 7-10 дней инкубационного периода и в течение 2-х недель преджелтушного периода заболевания. В это время наблюдается массированное выделзние вируса с фекалиями, которое прекращается в период разгара заболевания (желтушный период).
Основной механизм передачи при гепатите А — фекально-оральный. Заражение происходит через контаминированную вирусами воду, пищу и контактным путем. Передача вируса возможна от больных и через кровь в период вирусемии при проведении парентеральных манипуляций.
5. Клинические проявления
Входными воротами для ВГА являются слизистые ротоглотки и тонкого кишечника, в эпителиоцитах которых, возможно, происходит первичная репродукция, откуда вирус проникает в мезентериальные лимфатические узлы и далее в кровь, вызывая кратковременную вирусемию. С кровотоком через портальную вену вирус заносится в печень, где активно размножается в гепатоцитах.
Поражение клеток печени при гепатите А обусловлено клеточными цитотоксическими иммунными реакциями, их сущность заключается в том, что вирусные антигены появляются на мембране гепатоцитов вместе с антигенами главного комплекса гистосовместимости (HLA) 1-го типа. Далее пораженные вирусом клетки узнаются цитотоксическими Т-лимфоцитами и уничтожаются. Таким образом, организм освобождается от вируса, уничтожая клетки, пораженные ВГА. Но не исключается и частичное прямое цитопатическое действие этого вируса на клетки печени.
Гибель гепатоцитов ведет к развитию воспалительных и некробиотических процессов и, как следствие, к снижению дезинтоксикационной и барьерной функций печени.
Основными признаками вирусного гепатита А являются дистрофические изменения клеток печени, набухание гепатоцитов, отек портальных трактов. В тяжелых случаях развиваются некрозы. Воспалительные некробиотические процессы приводят к возникновению цитолитического, мезенхимально-воспалительного и холестатического клинико-биохимических синдромов.
Клиника. При типичном течении гепатита А характерна четкая смена периодов: инкубационный, продромальный (преджелтушный), разгар болезни (желтушный период) и реконвалесценция.
Инкубационный период при гепатите А продолжается в среднем 21-28 дней, а продромальный период 2-14 дней и характеризуется катаральными и диспептическими явлениями с токсическим синдромом. Разгар болезни продолжается в среднем 2-3 недели и знаменуется появлением желтухи.
Далее заболевание переходит в стадию реконвалесценции продолжительностью 1-12 месяцев, во время которой происходит постепенное угасание всех клинических симптомов. Болезнь, как правило, заканчивается полным выздоровлением. В результате развития иммунного ответа вирус элиминируется из организма.
Наиболее типичной формой является острая желтушная циклическая форма, возможен безжелтушной и бессимптомный варианты гепатита А. Хронические формы и вирусоносительство гепатита А не возникают.
6. Лабораторная диагностика, характер исследуемого материала
Вирусный гепатит А диагносцируется преимущественно с помощью иммунологических методов исследования, реже применяют иммунную электронную микроскопию (ИЭМ), в последнее время начали применять ПЦР. Вирусологические исследования проводят ограничено, главным образом для научных целей, что связано с трудностью культивирования ВГА на клеточных культурах.
Исследуемый материал — сыворотка крови, фекалии, реже моча икровь.
На ранней стадии заболевания — в продромальном (безжелтушном) периоде обнаруживают вирусспецифические антигены и/или антитела класса IgM в сыворотке крови.
ВГА-антиген (HAV-Ag) выявляют в фильтрате фекалий, используя соответствующую тест-систему ИФА или РИА.
ИЭМ, основанная на связывании специфических антител с находящимися в фекалиях вирусами и последующим образовании агрегатов вирионов, выявляемых при электронноскопии, в настоящее время применяется реже.
В то же время расширяется применение ПЦР.
Наиболее распространенным и доступным способом диагностики, позволяющим диагносцировать гепатит А как в раннем периоде, так и в более поздние сроки, является серологическое исследование испытуемой сыворотки с целью обнаружения антител класса IgM. Эти антитела появляются в безжелтушном периоде, их титр значительно нарастает в период разгара заболевания, а затем в течение нескольких месяцев постепенно снижается. Антитела класса IgM (ранняя диагностика) обнаруживаются с помощью ИФА (используя тест-систему ИФА-анти-HAV-M), применяют также РПГА и РГА.
Постановка этих же реакций с парными сыворотками позволяет выявить четырехкратное и более увеличение титра антител, характерное для желтушного периода и реконвалесценции.
Ретроспективный диагноз, а также наличие постинфекционного иммунитета, устанавливают путем обнаружения специфических IgG антител, которые сохраняются в организме в течение многих лет.
Дата добавления: 2015-06-27; Просмотров: 4980; Нарушение авторских прав?
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Рекомендуемые страницы:
Читайте также:
Источник
