Тромбоцитопения при хроническом гепатите с
Одно из ведущих мест в структуре этиологических причин поражения печени занимает хронический гепатит С. Часто именно у пациентов с хроническим гепатитом С наблюдается тромбоцитопения.
Клиническое значение тромбоцитопении при хроническом гепатите С определяется повышенным риском развития кровотечений при проведении инвазивных диагностических и лечебных манипуляций (пункционная биопсия печени, эндоскопия, трансплантация печени). Даже при тромбоцитопении менее 50х103/мкл спонтанные кровотечения и кровоточивость встречаются крайне редко. Однако у пациентов со сформированным циррозом печени в исходе гепатита С риск кровотечений при тяжелой тромбоцитопении выше, чем у пациентов с небольшим уровнем фиброза. Уровень тромбоцитов оценивается врачом для решения вопроса о назначении интерферонотерапии.
Тромбоцитопения у пациентов с хроническим гепатитом С возникает вследствие нарушенной продукции и повышенного разрушения тромбоцитов. При гиперспленизме происходит избыточный распад тромбоцитов в гипертрофированной селезенке. Аутоиммунный процесс поломки тромбоцитов связан с образованием антитромбоцитарных антител, которые связывают поверхностные антигены тромбоцитов и образованные иммунные комплексы разрушаются в печени и селезенке. Нарушение выработки тромбоцитов вызвано подавлением костномозгового кроветворения вследствие прямого цитотоксического действия. Кроме того, печень является основным органом, в котором происходит синтез тромбопоэтина, который регулирует созревание и дифференцировку мегакариоцитов в тромбоциты в костном мозге. С развитием фиброза в печени снижается выработка тромбопоэтина. Также нарушается синтез тромбоцитов вследствие действия на процесс кроветворения интерферона-α — основного препарата, который в комбинации с рибавирином используется для лечения вирусного гепатита С. Снижение уровня тромбоцитов происходит у 20-30% пациентов, получающих комбинированную противовирусную терапию. Обычно тромбоциты снижаются на 10-50% от исходного уровня.
Пороговым безопасным исходным значением уровня тромбоцитов для комбинированной противовирусной терапии пегилированными интерферонами и рибавирином является уровень тромбоцитов более 90х103/мкл для Пег-интерферонов более 100х103/мкл. На практике такая выраженная исходная тромбоцитопения встречается преимущественно у пациентов с декомпенсированным циррозом печени (класс С по системе Чайлда-Таркотта-Пью), при котором нельзя проводить противовирусную терапию в связи с риском осложнений.
Инфузии тромбомассы не приводят к желаемому уровню тромбоцитов, имеют высокую стоимость, в связи с чем их введение не используется для подготовки пациентов к противовирусной терапии.
Около 3-6% пациентов требуется модификация терапии пегилированным интерфероном. В соответствии с инструкциями к лекарственным препаратам (Пег-интерферон-α 2а и Пег-интерферон-α 2b) рекомендуется снижение дозы интерферона до половины терапевтической, если число тромбоцитов менее 50х103/мкл и прекращение приема интерферона, если число тромбоцитов менее 25х10з/мкл. Есть данные о том, что такое снижение дозы сопровождается снижением вероятности излечения гепатита С.
Для коррекции начальной и интерферон-индуцированной тромбоцитопении у пациентов с гепатитом С для проведения противовирусной терапии Федеральным агентством по контролю качества пищевых продуктов и лекарственных препаратов США одобрено применение фактора роста тромбоцитов — элтромбопага, который стимулирует пролиферацию и дифференцировку мегакариоцитов. Начальная дозировка элтромбопага — 25 мг перорально ежедневно, максимальная дозировка — 100 мг/сут. Рекомендуемый уровень тромбоцитов на фоне терапии элтромбопагом — (50-150)х10з/мкл. Прием препарата прекращается при прекращении противовирусной терапии.
ТРОМБОЗЫ СОСУДОВ ПЕЧЕНИ
Анатомия сосудов печени
Печень снабжается кровью из двух сосудов: венозного — воротной вены и артериального — печеночной артерии. Воротная (или портальная) вена несет кровь от селезенки, желудка, поджелудочной железы, кишечника. Печеночная артерия ответвляется от чревного ствола, который является одной из основных ветвей аорты. Эти сосуды входят в печень в области ее ворот, где оба сосуда дают ветви к левой и правой долям печени. Венозная кровь от печени оттекает по печеночным венам от левой и правой долей печени, печеночные вены впадают в нижнюю полую вену (рис. 11).
Тромбозы при декомпенсированных заболеваниях печени
У пациентов с декомпенсированным циррозом печени и гепатоцеллюлярной карциномой склонность к венозным тромбозам повышена по сравнению со здоровыми пациентами. Однако в структуре венозных тромбозов непосредственно сосудов печени (воротной вены и печеночных вен) цирроз печени занимает всего 5%, тогда как при гепатоцеллюлярной карциноме тромбоз вен печени происходит в 30% случаев.
Артериальные тромбозы для пациентов с циррозом печени не характерны. Исключение составляют пациенты с неалкогольной жировой болезнью печени, у которых высок риск артериальных тромбозов в рамках метаболического синдрома (инфаркт миокарда, острое нарушение мозгового кровообращения). Тромбоз печеночной артерии может являться осложнением оперативных вмешательств на печени.
При декомпенсированных заболеваниях печени микроскопически часто выявляют тромбозы мелких сосудов печени. Микротромбозы паренхимы печени являются фактором, усугубляющим процесс фиброзирования путем местной ишемии.
Не разработаны эффективные рекомендации по ведению пациентов с тромбозами при декомпенсированных заболеваниях печени.
Тромбоз воротной вены
Тромбоз воротной вены возникает вследствие:
• инфекции;
• спленэктомии и других хирургических вмешательств;
• трансплантации печени;
• травмы печени;
• миелопролиферативных заболеваний;
• гепатоцеллюлярной карциномы, реже — цирроза печени;
• беременности, длительного приема оральных контрацептивов.
Клинически хронический тромбоз портальной вены сопровождается предпеченочной портальной гипертензией. Первым клиническим проявлением может быть кровотечение из варикозно-расширенных вен пищевода или желудка. Также частым симптомом является спленомегалия. При остром тромбозе портальная гипертензия резко нарастает и может осложниться ишемией кишечника, что сопровождается болью в животе, лихорадкой и кишечной непроходимостью. Печень имеет нормальные размеры, отсутствуют «малые печеночные стигмы»: «печеночные ладони», телеангиэктазии (кроме случаев тромбоза воротной вены на фоне цирроза печени). Асцит умеренный, появляется и исчезает по мере развития коллатерального кровообращения. Также вследствие развития коллатерального кровообращения быстро нарастает печеночная энцефалопатия.
Диагностику тромбоза воротной вены проводят с помощью ультразвукового исследования, которое выявляет в просвете воротной вены тромб, ультразвуковое исследование с допплером оценивает нарушение кровотока. Визуализацию тромба можно проводить с помощью компьютерной и магнитно-резонансной томографии печени с контрастированием, также в воротах печени выявляется сеть расширенных мелких вен. Ангиография выявляет дефект наполнения воротной вены.
В результате гиперспленизма развиваются лейкопения и тромбоцитопения, анемия не развивается (если не происходит кровотечения из варикозно-расширенных вен пищевода). Функциональные печеночные пробы (аланинаминотрансфераза, аспартатаминотрансфераза, γ-глютамилтранспептидаза, щелочная фосфатаза, билирубин, протромбиновый индекс, альбумин) обычно долго остаются в пределах нормы (кроме случаев тромбоза воротной вены на фоне заболевания печени). При выполнении коагулограммы повышены фибриноген и протромбиновый индекс.
При остром тромбозе портальной вены возможно проведение тромболизиса урокиназой, стрептокиназой в воротную вену или верхнюю брыжеечную артерию.
Всем пациентам должна проводиться антикоагулянтная терапия с целью предотвращения распространения тромбоза и, по возможности, восстановления кровотока в воротной вене. Раннее применение антикоагулянтов способствует реканализации воротной вены.
Антикоагулянтную терапию начинают с внутривенного введения нефракционированного гепарина в течение 2-3 нед под контролем АЧТВ.
Можно назначать НМГ (далтепарин, эноксапарин, надропарин), которые так же эффективны и более удобны в применении.
При стабилизации состояния пациента назначается непрямой антикоагулянт — антагонист витамина K — варфарин, доза которого подбирается индивидуально под строгим контролем и поддержанием МНО в пределах 2-3.
Нельзя начинать антикоагулянтную терапию у пациентов с хроническим тромбозом воротной вены, не проведя профилактику кровотечения из варикозно-расширенных вен пищевода.
При циррозах печени с тромбозом портальной вены гепарин или варфарин могут оказать непредсказуемое действие. Ввиду высокого риска кровотечения эти препараты не назначаются у этой группы пациентов. Кроме того, контролировать их дозировку невозможно: АЧТВ у пациентов с циррозом печени зачастую удлиняется, МНО при развитии печеночной недостаточности повышено вследствие низкого синтеза протромбина.
При оперативном лечении имеется большой риск осложнений, в связи с этим хирургическое шунтирование воротной вены выполняется только при продолжающихся кровотечениях из вен пищевода и неэффективности консервативной терапии.
Прогноз определяется основным заболеванием.
Тромбоз печеночной артерии
Тромбоз печеночной артерии встречается крайне редко. Возможные причины тромбоза печеночной артерии:
• трансплантация печени;
• инфекционный эндокардит;
• травма;
• осложнение хирургических вмешательств на печени.
Диагноз редко ставится при жизни больного. Работ с описанием клинической картины тромбоза печеночной артерии очень мало. Боль в эпигастрии сопровождается шоковым состоянием, лихорадкой. В результате инфаркта печени быстро нарастает желтуха, повышаются трансаминазы, наблюдается лейкоцитоз. Резко снижается протромбиновый индекс, появляется кровоточивость. При тромбозе крупных ветвей печеночной артерии пациент погибает в течение нескольких суток. Легкое течение тромбоза печеночной артерии, сопровождающееся несильной болью в правом подреберье, может остаться недиагностированным и случайно выявляется при патологоанатомическом вскрытии.
Рутинные исследования показывают гипокоагуляцию. Изменения системы гемостаза, связанные с активацией свертывающих механизмов, можно выявить только с помощью специальных методик, например откалиброванной автоматической тромбинографии.
При ультразвуковом исследовании можно визуализировать гипоэхогенные инфарктные очаги. Также инфаркт печени можно выявить при компьютерной томографии, магнитно-резонансной томографии. Необходимо проведение печеночной артериографии.
Есть скудные данные о применении аспирина для профилактики тромбоза печеночной артерии.
Основной целью является терапия печеночной недостаточности.
Синдром Бадда-Киари
Синдром Бадда-Киари — это заболевание, характеризующееся нарушением оттока венозной крови от печени. Основная причина синдрома Бадда-Киари — тромбоз печеночных вен, а также печеночного отдела нижней полой вены.
Причинами синдрома Бадда-Киари могут служить:
• гематологические заболевания (истинная полицитемия, миело-пролиферативные заболевания, АФС);
• беременность;
• использование больших доз эстрогенов;
• гепатоцеллюлярная карцинома, редко — цирроз печени;
• метастатические поражения печени;
• инфекционные болезни печени (туберкулез, амебиаз, аспергиллез);
• саркоидоз печени.
Клинически синдром Бадда-Киари проявляется надпеченочной портальной гипертензией: гепатомегалией, диуретико-резистентным асцитом, позже присоединяются спленомегалия и варикозное расширение вен пищевода. Поэтому кровотечения из вен пищевода — редкое осложнение синдрома Бадда-Киари. Как правило, гепатомегалия и асцит появляются быстро. Характерен полицитоз, высокий уровень гемоглобина из-за перемещения жидкой части крови в брюшную полость. Быстро прогрессирует печеночная недостаточность, и вследствие этого пациенты погибают. При появлении отеков на ногах следует искать тромбоз нижней полой вены.
Обычно дифференциальная диагностика проводится с печеночной формой портальной гипертензии.
Специфических гематологических тестов не существует. Для диагностики используются допплеровское ультразвуковое исследование, магнитно-резонансная томография и компьютерная томография с контрастированием, золотым стандартом диагностики является печеночная венография. Биопсия печени, использующаяся для дифференциальной диагностики и оценки стадии фиброза печени в случае длительного тромбоза, показывает венозный застой, атрофию печеночных клеток, редко — микротромбозы печеночных венул.
Медикаментозная терапия, направленная на лечение портальной гипертензии и отечно-асцитического синдрома, малоэффективна. Незначительный эффект показали антикоагулянтная (НМГ с переводом на варфарин) и тромболитическая терапия.
Основным методом лечения является хирургическое лечение — проводится портосистемное шунтирование. Некоторым пациентам выполняют трансъюгулярное внутрипеченочное портосистемное шунтирование. Также проводится трансплантация печени.
Источник
ТРОМБОЦИТОПЕНИЯ У БОЛЬНЫХ ХРОНИЧЕСКИМ ГЕПАТИТОМ С, ПОЛУЧАЮЩИХ КОМБИНИРОВАННУЮ ПРОТИВОВИРУСНУЮ ТЕРАПИЮ. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ. ОСОБЕННОСТИ ПАТОГЕНЕЗА
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Донцов Д.В.
1
Амбалов Ю.М.
1
Пройдаков М.А.
1
Коваленко А.П.
1
Усаткин А.В.
1
Левина Л.Д.
1
1 Ростовский государственный медицинский университет
Применение комбинированной противовирусной терапии позволяет добиться устойчивого вирусологического ответа у больных хроническим гепатитом С, однако у некоторых пациентов на фоне лечения развиваются побочные эффекты. Особое место среди нежелательных проявлений специфической терапии хронического гепатита С занимают гематологические синдромы. Формирование данных синдромов зависит от целого ряда факторов. В данной работе изучены некоторые особенности патогенеза тромбоцитопении, развивающейся у больных хроническим гепатитом С на фоне приема противовирусных препаратов. С этой целью нами был выполнен ряд высокоспециализированных исследований: автоматический гематологический анализ, электронная микроскопия клеток крови, определение уровня антитромбоцитарных ауто-IgG, концентрации эндогенного тромбопоэтина и ДНК полиморфизмов гена MPL. В общей сложности, в исследование было включено 228 пациентов, получающих комбинированную противовирусную терапию хронического гепатита С. Работа проводилась на базе кафедры инфекционных болезней РостГМУ.
хронический гепатит С
противовирусная терапия
тромбоцитопения
1. Adinolfi L.E., Giordano М.G., Аndгеаnа А. Hepatic fibrosis plays а central rоlе in the pathogenesis of thrombocytopenia in patients with chгonic viral hepatitis // Вr. Journal Наеmаtоlogy. – 2001. – Vol. 113. – pp. 590–595.
2. Afdhal N., McHutchison J., Brown R. Тhrombocytopenia associated with chronic liver disease // Journal Нераtоlogy. – 2008. – Vol. 48. – pp. 1000–1007.
3. Berry L., Irving W. Predictors of hepatitis C treatment response: what’s new? // Expert Review of Anti-infective Therapy. – 2014. – Vol. 12, no. 2. – pp. 183–191.
4. Flisiak R., Jaroszewicz J., Parfieniuk-Kowerda A. Emerging treatments for hepatitis C // Expert Opinion on Emerging Drugs. – 2013. – Vol. 18, no. 4. – pp. 461–475.
5. Hashemi N., Rossi S., Navarro V.J. Safety of peginterferon in the treatment of chronic hepatitis C // Expert Opinion on Drug Safety. – 2008. – Vol. 7, no. 6. – pp. 771–781.
6. Suarez A., Redmond D. Desired Social Distance From People Who Have Hepatitis C Virus: An Exploration Among Staff in Health Care, Dentistry, Drug Treatment, and Tattoo/Body Piercing // Substance Use & Misuse. – 2014. – Vol. 49, no. 4. – pp. 466–474.
7. Toyoda H., Kumada T. Pharmacotherapy of chronic hepatitis C virus infection – the IDEAL trial: ‘2b or not 2b (=2a), that is the question’ // Expert Opinion on Pharmacotherapy. – 2009. – Vol. 10, № 17. – pp. 2845–2857.
Хронический гепатит С (ХГС) является одним из наиболее распространенных инфекционных заболеваний человека [6]. Применение современной комбинированной противовирусной терапии (КПТ) ХГС позволяет добиться у многих пациентов полной элиминации возбудителя [3, 4, 5], однако, актуальной проблемой при этом остается развитие нежелательных явлений (НЯ), среди которых особое место занимают гематологические осложнения [1, 7]. Одним из наиболее серьезных гематологических синдромов у больных ХГС является КПТ-ассоциированная тромбоцитопения, развитие которой значительно увеличивает риск возникновения состояний, угрожающих жизни пациентов [1, 2]. К сожалению, многие стороны патогенеза данного НЯ этиотропного лечения хронической HCV-инфекции остаются практически не изученными.
Цель исследования – детально изучить патогенез и клинические проявления КПТ-ассоциированной тромбоцитопении у больных ХГС.
Материалы и методы исследования
В исследование было включено 228 больных ХГС, имевших показания к КПТ. Генотип HCV 1a встречался у 3,5 %, 1b – 51,3 %, 3а – 28,9 % и 2а – 16,2 % человек. Уровень вирусной нагрузки (ВН) у 30,3 % пациентов составил < 3×105 МЕ/мл, у 46,1 % – 3×105 – 6×105 МЕ/мл и у 23,7 % > 6×105 МЕ/мл. Всем испытуемым была назначена КПТ согласно современным международным стандартам. 51,3 % пациентов получали рибавирин в сочетании с пегилированными α-интерферонами (пег-ИНФ-α), 48,7 % – в сочетании с «короткими». В ходе работы наблюдаемым лицам был выполнен ряд высокоспециализированных исследований. Определение показателей гемограммы проводилось методом автоматического гематологического анализа («Advia 2120i» (Siemens)) непосредственно перед началом КПТ, через 4, 8, 12, 24 и 48 (лица, инфицированные 1-м генотипом HCV) недель КПТ. Внутриклеточная ультраструктура тромбоцитов ПК изучалась с помощью трансмиссионной электронной микроскопии на просвечивающем электронном микроскопе «Tecnai G2 Spirit BioTWIN» (Philips, Нидерланды). Уровень человеческого тромбопоэтина (THPO) исследовали методом твердофазного ИФА с использованием набора реактивов Human Thrombopoietin Quantikine ELISA Kit (R&D Systems, США) на спектрофотометре xMark (Bio-Rad, США). Определение антител к поверхностным антигенам (GP IIa-IIIb) базальной мембраны тромбоцитов в сыворотке крови осуществляли путем постановки реакции непрямой иммунофлюоресценции. При этом использовались диагностические наборы «Thrombocytes IIFT» (EUROIMMUN AG, Германия) с меченными ФИТЦ вторичными антителами к антитромбоцитарным IgG человека. Характер флуоресцентного свечения оценивался на микроскопе Olympus СХ41 (Япония). Результат реакции выражался в титрах. Перечисленные выше методы исследования проводились дважды: перед началом и сразу после завершения или вынужденного прекращения КПТ. Помимо этого у испытуемых лиц методом «ПЦР в реальном времени» было выполнено изучение однонуклеотидных ДНК-полиморфизмов (SNP) гена рецептора тромбопоэтина MPL, в частности частота точковых мутаций W515L/K (rs121913615/121913616). Для генотипирования SNP использовали аллель-специфичные зонды наборов реагентов «SNP-Скрин» (Синтол, РФ). Заключительным этапом явился тщательный статистический анализ полученных результатов, который был выполнен после полного завершения клинико-лабораторно-инструментального мониторинга всех пациентов.
Результаты исследования и их обсуждение
В результате проведенного лечения УВО в общей сложности был достигнут у 155 (68,0 %) пациентов, из них 64 (41,3 %) были инфицированы 1-м; 34 (21,9 %) – 2-м и 57 (36,8 %) – 3-м генотипами HCV. Среди получавших пег-ИФН-α-2а (n = 117) частота УВО составила 54,7 % (n = 64); получавших «короткие» ИФН-α (n = 111) – 82,0 % (n = 91). У больных, инфицированных 1-м генотипом HCV (n = 125), УВО отмечался в 51,2 % (n = 64) случаев; у инфицированных 2-м (n = 37) и 3-м (n = 66) генотипами HCV – в 91,9 % (n = 34) и 86,4 % (n = 57) случаев соответственно. Проведение КПТ прекращалось при отсутствии через 12 недель лечения РВО и/или развитии у пациентов тяжелых НЯ противовирусной терапии. В итоге, из 228 больных ХГС полностью закончили курс КПТ 163 человека (71,5 %). У 8 пациентов (3,5 %) терапия была отменена уже через 8 недель лечения исключительно по причине развития тяжелых гематологических осложнений КПТ. У 57 больных ХГС (25,0 %) было зафиксировано отсутствие РВО, причем у 9 из них (3,9 %) параллельно наблюдалось развитие к 12-й неделе КПТ тяжелых осложнений со стороны системы крови, также требовавших отмены терапии.
При изучении степени тяжести КПТ-ассоциированной тромбоцитопении нами была использована классификация Всемирной организации здравоохранения, согласно которой выделяют легкую (Тр 150–75×109/л), умеренную (Тр 74–50×109/л) и тяжелую (Тр < 50×109/л) степени тромбоцитопении. В результате было установлено, что на разных этапах КПТ тромбоцитопения в общей сложности развилась у 30,3 % пациентов, при этом легкая степень отмечалась у 16,2 %; умеренная – у 10,5 % и тяжелая – у 3,5 % больных ХГС.
Объективные изменения в виде геморрагий в местах инъекций, появления петехиальной сыпи на нижних конечностях, частых носовых кровотечений, гематурии были выявлены исключительно у лиц с умеренной и тяжелой степенью тромбоцитопении. У 21,4 % пациентов, начиная с 20 недели КПТ, было зафиксировано развитие спленомегалии.
Легкая степень тромбоцитопении через 4 недели КПТ была зафиксирована у 8,3 %, через 8 недель – у 11,8 %, через 12 – у 15,0 %, через 24 – у 29,4 % и через 48 (пациенты с 1-м генотипом HCV) – у 34,8 % больных ХГС. Умеренная степень тромбоцитопении через 12 недель КПТ отмечалась у 1,4 % больных ХГС, через 24 недели – у 8,0 % и через 48 недель – у 11,1 % пациентов. Развитие тромбоцитопении тяжелой степени было выявлено у 3,6 % больных ХГС через 12 недель лечения, совпав при этом с отсутствием РВО у данной категории лиц (табл. 1).
Все участники исследования в зависимости от минимального количества тромбоцитов, зафиксированного у каждого пациента за весь период КПТ (Трmin), были разделены на три группы. В 1-ю группу (n = 159) вошли лица, у которых Трmin на протяжении КПТ оставался в пределах допустимой нормы, т.е. > 150×109/л. 2-я группа (n = 37) включала больных ХГС с легкой степенью КПТ-ассоциированной тромбоцитопении: Трmin в пределах 75–150×109/л. 3-ю группу (n = 32) составили лица с умеренной и тяжелой степенью тромбоцитопении: Трmin < 75×109/л. Средний показатель Трmin в 1-й группе оказался равен 176,03 ± 2,77; во 2-й – 127,89 ± 3,45 и в 3-й – 64,69 ± 2,03×109/л.
Проведенный корреляционный анализ позволил установить наличие умеренной обратной ассоциативной связи между Трmin и такими исходными показателями пациентов как возраст, индекс массы тела (ИМТ), величина ВН и индекс фиброза (ИФ), что же касается количества Тр перед началом КПТ, то в данном случае была получена сильная прямая ассоциативная связь (табл. 2).
Таблица 1
Характер распределения больных ХГС в зависимости от количества тромбоцитов перед началом КПТ, через 4, 8, 12, 24, 48 недель от начала КПТ и через 24 недели после окончания КПТ
Тр. (×109/л) | Абсолютное (n) и относительное (%) число больных ХГС | ||||||
перед КПТ (n = 228) | 4 недели КПТ (n = 228) | 8 недель КПТ (n = 228) | 12 недель КПТ (n = 220) | 24 недели КПТ (n = 163) | 48 недель КПТ (n = 72) | 24 недели после КПТ (n = 221) | |
> 150 | 225 (98,7 %) | 209 (91,7 %) | 201 (88,2 %) | 176 (80,0 %) | 102 (62,6 %) | 39 (54,1 %) | 209 (94,6 %) |
150–75 | 3 (1,3 %) | 19 (8,3 %) | 27 (11,8 %) | 33 (15,0 %) | 48 (29,4 %) | 25 (34,8 %) | 12 (5,4 %) |
75–50 | 3 (1,4 %) | 13 (8,0 %) | 8 (11,1 %) | ||||
< 50 | 8 (3,6 %) | ||||||
Таблица 2
Характер корреляционных связей Трmin с возрастом, ИМТ, количеством Тр, величиной ВН и ИФ перед КПТ у наблюдаемых нами больных ХГС
Исследуемый показатель | Возраст пациентов | ИМТ перед КПТ | Количество Тр перед КПТ | ВН перед КПТ | ИФ перед КПТ | |||||
r | p | r | p | r | p | r | p | r | р | |
Трmin | -0,28 | < 0,01 | -0,31 | < 0,01 | 0,65 | < 0,01 | -0,35 | < 0,01 | -0,27 | < 0,01 |
На старте КПТ среди пациентов 3-й группы в сравнении с 1-й и 2-й преобладали лица старше 40 лет, имеющие ИМТ > 25 и ИФ F2-3 (р < 0,05). Перед началом КПТ средний показатель количества Тр в 1-й группе больных ХГС составил 260,83 ± 3,96; во 2-й – 218,46 ± 5,73 и в 3-й – 180,78 ± 3,76 ×109/л (во всех случаях р > 0,05). Уже через 4 недели терапии отмечалось достоверное снижение среднего показателя количества Тр у пациентов всех групп (р > 0,05), минимальные же значения данного показателя были зафиксированы в период с 24-й по 48-ю недели КПТ. В целом же, наиболее выраженные изменения на всех этапах лечения отмечались в 3-й группе больных ХГС (р < 0,05). Что касается среднего объема Тр, то в процессе КПТ отмечалось статистически значимое (р < 0,05) повышение среднего показателя MPV, наиболее выраженного опять-таки у пациентов 3-й группы.
В ходе исследования во всех сравниваемых группах были выявлены пациенты с разнообразными структурными дефектами как цитоплазматической мембраны тромбоцитов (участки локального разрыхления, патологические выпячивания, микро- и макровезикулобразование), так и их стромы (образование полостей и эндовезикул, гипертрофия грануломера, отек и набухание митохондрий) (рис. 1, 2).
Как показал сравнительный анализ, на старте лечения в 3-й группе пациентов гораздо чаще встречались лица с вышеуказанными дефектами. После завершения КПТ удельный вес больных ХГС с выявленными структурными изменениями тромбоцитов либо имел тенденцию к снижению, либо достоверно снижался во всех группах (р < 0,05), оставаясь, тем не менее, наиболее высоким в 3-й группе.
Что касается уровня антитромбоцитарных антител, то в 1-й и 2-й группе пациентов перед началом КПТ были обнаружены лица с отсутствием, а также с низким и умеренным уровнем IgG к поверхностным антигенам GP IIa-IIIb, при этом существенных отличий их удельного веса между данными группами зафиксировано не было. В 3-й же группе больных ХГС статистически более высоким оказалось относительное количество пациентов с низким и умеренным уровнем антитромбоцитарных IgG. После КПТ в 1-й группе удельный вес пациентов с выявленным уровнем антитромбоцитарных IgG существенно не изменился, во 2-й – достоверно повысился удельный вес больных с умеренным, а в 3-й – с высоким уровнем антитромбоцитарных IgG, кроме того, в 3-й группе отмечалось появление пациентов с крайне высоким уровнем антитромбоцитарных IgG.
Средний показатель уровня THPO перед началом КПТ в 1-й группе наблюдаемых нами лиц составил 24,43 ± 1,1 пг/мл, во 2-й – 25,77 ± 0,97 пг/мл, в 3-й же группе данный показатель оказался достоверно выше – 29,08 ± 1,01 пг/мл (р < 0,05). После окончания КПТ средний уровень THPO статистически значимо повысился лишь в 1-й и 2-й группах, тем самым достоверно превысив таковой у пациентов 3-й группы.
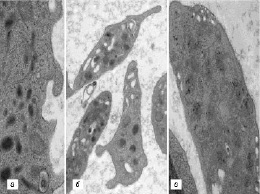
Рис. 1. Признаки деструкции плазмолеммы тромбоцитов, выявленные у наблюдаемых пациентов. Трансмиссионная электронная микроскопия: а – локальные участки истончения и разрыхления (×58 000); б – патологические выпячивания плазмолеммы (×22 000); в – образование микро- и макровезикул (×36 000)
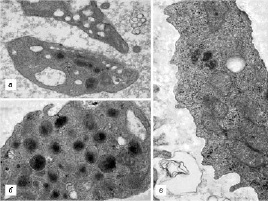
Рис. 2. Признаки деструкции цитоплазмы тромбоцитов, выявленные у наблюдаемых пациентов. Трансмиссионная электронная микроскопия: а – тромбоциты с множественными эндовезикулами (×22 000); б – гипертрофия грануломера (×44 000); в – отек и набухание митохондрий (×38 000)
Частота встречаемости точковой мутации W515L (rs121913615) гена MPL в 1-й группе больных ХГС составила 27,8 ± 7,5 % пациентов, во 2-й группе – 22,6 ± 7,5 % и наконец в 3-й – 71,9 ± 7,9 % человек, что оказалось значительно выше нежели у пациентов первых двух групп (р < 0,001). Совсем иная ситуация складывалась с мутацией W515K (rs121913616), в данном случае «мутантный» генотип был зафиксирован в 1-й и во 2-й группах больных ХГС в 16,7 ± 6,2 %, и 16,1 ± 6,6 % случаев соответственно (р > 0,05), в 3-й же группе данная мутация выявлена не была.
Выводы
- Степень выраженности КПТ-ассоциированной тромбоцитопении у больных ХГС определена целым рядом факторов, среди которых можно выделить как непосредственное действие HCV, так и индивидуальные характеристики самого пациента.
- Перед началом противовирусного лечения у больных ХГС имеются разнообразные ультраструктурные дефекты мембраны и стромы эритроцитов, которые, вполне возможно, могут играть важную роль в развитии КПТ-ассоциированной тромбоцитопении.
- В патогенезе КПТ-ассоциированной тромбоцитопении существенное место занимает повышение уровня антитромбоцитарных аутоантител к поверхностным антигенам GP IIa-IIIb.
- В процессе антивирусной терапии у лиц с отсутствием или же легкой степенью КПТ-ассоциированной тромбоцитопении происходит компенсаторное увеличение выработки эндогенного THPO, что вполне обеспечивает адекватный уровень тромбоцитопоэза у данной категории лиц.
- Развитие у больных ХГС средней и тяжелой степени КПТ-ассоциированной тромбоцитопении ассоциируется с высокой частотой точковой мутации W515L (rs121913615), происходящей в структуре гена MPL, ответственного, как известно, за синтез R эндогенного THPO.
Рецензенты:
Николаев Б.Ф., д.м.н., МЛПУЗ «ГБ № 1 им. Н.А. Семашко», г. Ростов-на-Дону;
Яговкин Э.А., д.м.н., Ростовский научно-исследовательский институт микробиологии и паразитологии министерства здравоохранения РФ, г. Ростов-на-Дону.
Работа поступила в редакцию 07.08.2014.
Библиографическая ссылка
Донцов Д.В., Амбалов Ю.М., Пройдаков М.А., Коваленко А.П., Усаткин А.В., Левина Л.Д. ТРОМБОЦИТОПЕНИЯ У БОЛЬНЫХ ХРОНИЧЕСКИМ ГЕПАТИТОМ С, ПОЛУЧАЮЩИХ КОМБИНИРОВАННУЮ ПРОТИВОВИРУСНУЮ ТЕРАПИЮ. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ. ОСОБЕННОСТИ ПАТОГЕНЕЗА // Фундаментальные исследования. – 2014. – № 10-1. – С. 59-63;
URL: https://fundamental-research.ru/ru/article/view?id=35214 (дата обращения: 28.05.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник

